TRAVAUX
DIRIGES : « ATOMES ET MOLECULES » - Cours de Thierry Briere
Série 3 : Le Cortège électronique - La classification périodique
Rappels
sur les 4 nombres quantiques :
Nombre
quantique principal n : entier non nul, caractérise la couche occupée par
l'électron, la couche est aussi symbolisée par une lettre majuscule avec la
correspondance suivante :
|
n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
couche |
K |
L |
M |
N |
O |
P |
Q |
Nombre
quantique secondaire (ou azimutal) l : nombre entier avec 0 £ l £ n - 1 caractérise la sous-couche occupée par l'électron. La
sous-couche est aussi symbolisée par une lettre minuscule avec la correspondance
suivante :
|
l |
0 |
1 |
2 |
3 |
4 |
5 |
|
Sous-couche |
s |
p |
d |
f |
g |
h |
Nombre
quantique magnétique m : Nombre entier avec -l £ m £ +l caractérise la "case
quantique" occupée par l'électron peut être aussi symbolysée graphiquement
par une case rectangulaire.
Nombre
quantique de spin s : ne peut prendre que deux valeurs : s = ± 1/2, peut être symbolisé graphiquement par une flèche
verticale dirigée vers le haut pour s = +
1/2 ou dirigée vers le bas ¯ pour s = -
1/2.
Exercice 1
: Les
affirmations suivantes sont-elles exactes ou inexactes? Pourquoi ?
Un électron pour lequel n=4 et m=2
a) Doit avoir
nécessairement l=2
n = 4 è l = 0,1 ,2, 3
l = 0 è m = 0
l = 1 è m = -1 , 0 , 1
l = 2 è m = -2 , -1 , 0 , 1 , 2
l = 3 è m = -3 , -2 , -1 , 0 , 1 , 2 , 3
Pour que m = 2, il faut que l soit égal
soit à 3 soit à 2
Il n'est donc pas obligatoire que l
soit égal à 2 : FAUX
b) peut avoir l=2
VRAI
c) doit
nécessairement avoir un spin égal à + 1/2
Non car une case quantique de m donné
peut contenir deux électrons à spins antiparallèles. s peut donc avoir
indifféremment les deux valeurs +1/2 ou -1/2 : FAUX
d) est nécessairement dans un
sous-niveau d
FAUX : l pouvant avoir les valeurs 2 ou 3 il peut s'agir d'un
sous-niveau d ou f.
Exercice 2
: Les
affirmations suivantes sont-elles exactes ou inexactes? Pourquoi ?
a) Si l=1, l’électron est dans une sous
couche d.
b) Si n=4 l’électron est dans la couche
O.
c) Pour un électron d, m peut être égal
à 3.
d) Si l=2, la sous-couche correspondante
peut recevoir au plus 6 électrons
e) Le nombre n d’un électron d’une
sous-couche f peut être égal à 3.
f) Si deux « édifices atomiques » ont la même configuration électronique, il s’agit forcément du même élément.
g) Si deux « édifices
atomiques » ont des configurations électroniques différentes il s’agit
forcément de deux éléments différents.
a) Si l = 1, l’électron est dans une sous couche d.
l
= 1 à sous-couche p : FAUX
b) Si n = 4 l’électron est dans la couche O.
n
= 4 à couche N : FAUX
c) Pour un électron d, m peut être égal à 3.
d
à l = 2 à ml = -2, -1, 0, 1, 2 : FAUX
d) Si l = 2, la sous-couche correspondante peut recevoir au plus 6 électrons.
l = 2 à ml = -2, -1, 0, 1, 2 à 5 cases quantiques à 10 électrons maximum : FAUX
e) Le nombre n d’un électron d’une sous-couche f peut être égal à 3.
n
= 3 à l = 0, 1, 2 (s,p,d) à pas de f sur couche 3 : FAUX
f) Si deux " édifices atomiques " ont la même configuration électronique, il s’agit forcément du même élément.
" édifice atomique " = atome " neutre " ou ion
Un ion a la même configuration électronique qu’un atome neutre d’un autre élément : FAUX
Exemples : Na+ , Ne et O2- ont la même
configuration électronique.
g) Si deux " édifices atomiques " ont des configurations électroniques différentes il s’agit forcément de deux éléments différents.
L’ion et l’atome neutre du même élément ont forcement des configurations électroniques différentes : FAUX
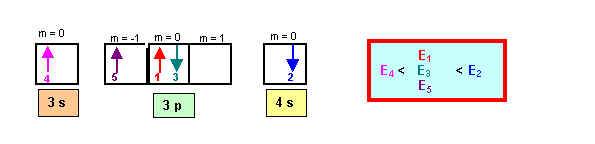
Exercice 3 : Classer par
ordre croissant de leur énergie les électrons d'un même atome définis par les
valeurs suivantes de leurs nombres quantiques. Identifier le sous-niveau auquel
ils appartiennent.
1) n = 3 ; l = 1 ; m = 0 ; s = +1/2
2) n = 4 ; l = 0 ; m = 0 ; s = -1/2
3) n = 3 ; l = 1 ; m = 0 ; s = -1/2
4) n = 3 ; l = 0 ; m = 0 ; s = +1/2
5) n = 3 ; l = 1 ; m = -1 ; s = +1/2
Electron 1 : n = 3 ; l = 1 (è 3 p ) ; m = 0 ; s = +1/2
Electron 2 : n = 4 ; l = 0 (è 4 s ) ; m = 0 ; s = -1/2
Electron 3 : n = 3 ; l = 1 (è 3 p ) ; m = 0 ; s = -1/2
Electron 4 : n = 3 ; l = 0 (è 3 s ) ; m = 0 ; s = +1/2
Electron 5 : n = 3 ; l = 1 (è 3 p ) ; m = -1 ; s = +1/2
L'énergie d'un électron dépend de n et de l.
Les énergies des sous-couches sont dans l'ordre 3 s < 3 p < 4 s
Les 3 électrons appartenant à la même sous-couche 3 p ont la même énergie.
Exercice
4 : Les
alcalino-terreux
On connaît actuellement 6 éléments
appartenant à cette famille qui sont (classés par ordre croissant de leur
numéro atomique) : Béryllium – Magnésium - Calcium – Strontium – Baryum et
Radium.
1) Quelle colonne de la classification
périodique occupe la famille des alcalino-terreux ?
2) Donnez à chacun son numéro atomique et
sa configuration électronique.
3) Un autre élément devrait normalement
appartenir à cette famille mais en a été exclu. Lequel et pour quelle raison ?
4) Si l’on réussit un jour à obtenir un
septième alcalino-terreux quels seront son numéro atomique et sa configuration
électronique ?
5) Par utilisation de la règle de
Sanderson montrer que ces éléments sont des métaux.
6) Quel type d’ion donnent les
alcalino-terreux ?
7) Quelles sont les formules des oxydes
des alcalino-terreux sachant qu’il s’agit de composés ioniques ?
8) Ces oxydes sont-ils acides ou basiques
?
CORRIGE : Les alcalino-terreux
On connaît actuellement 6 éléments appartenant à cette famille qui sont (classés par ordre croissant de leur numéro atomique) : Béryllium – Magnésium - Calcium – Strontium – Baryum et Radium.
- Quelle colonne de la classification périodique occupe la famille des alcalino-terreux ?
Colonne 2
- Donnez à chacun son numéro atomique et sa configuration électronique.
Il suffit de savoir qu'un alcalino-terreux est équivalent "à un gaz rare auquel on a ajouté 2 électrons"
|
|
|
Z |
Configuration électronique |
|
Béryllium |
Be |
4 |
1s2 2s2 = (He) 2s2 |
|
Magnésium |
Mg |
12 |
(He)
2s2 2p6 3 s2 = (Ne) 3s2 |
|
Calcium |
Ca |
20 |
(Ne) 3s2 3p6 4s2 = (Ar)
4s2 |
|
Strontium |
Sr |
38 |
(Ar) 3 d10 4s2
4p6 5s2
= (Kr) 5s2 |
|
Baryum |
Ba |
56 |
(Kr) 4d10 5s2 5p6 6s2 = (Xe) 6s2 |
|
Radium |
Ra |
88 |
(Xe)4f14 5d10 6s2 6p6 7s2 = (Rn) 7s2 |
1) Un autre élément devrait normalement appartenir à cette famille mais en a été exclu. Lequel et pour quelle raison ?
Hélium He : Z = 2 soit 1s2 2s2 mais il appartient à la famille des gaz rares (chimiquement presque inertes) et est donc placé en colonne 18.
2) Si l’on réussit un jour à obtenir un septième alcalino-terreux quel seront son numéro atomique et sa configuration électronique ?
Z = 120
(Rn) 7s2 5f14 6d10 7p6 8s2
3) Quel type d’ion donnent les alcalino-terreux ?
Ils perdent leurs deux électrons ns2 pour ressembler au gaz rare précédent : X2+
4) Quelles sont les formules des oxydes des alcalino-terreux sachant qu’il s’agit de composés ioniques ?
O prend 2 électrons pour ressembler à Ne soit O2-
M2+ + O2- = MO
5) Ces oxydes sont-ils acides ou basiques ? Justifiez simplement.
Avec 2 électrons
seulement sur leur couche de valence, les alcalino-terreux sont tous des métaux et
leurs oxydes sont donc basiques. (Règle
de Sanderson)
Exercice 5 : Etablir les
configurations électroniques des atomes ou ions suivants puis décrire leur
couche de valence. On supposera qu'ils
suivent tous la règle de Klechkowski. (Entre parenthèses Valeur de Z)
Na(11) -
K(19) - Ca2+(20) - Sr(38) - V(23) - Fe2+(26) -
Pb(82) - Co3+(27) - Br(35) -
S2-(16) - Al3+(13)
- Cs(55)
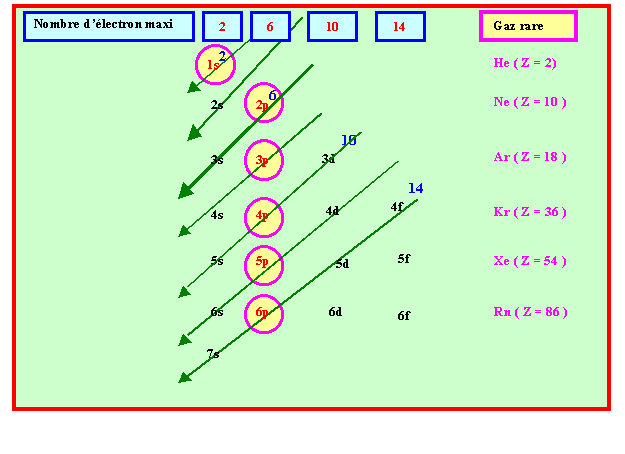
Règle de Klechkowski :
A quelques exceptions près, le remplissage des couches et des sous-couches se fait dans l’ordre des valeurs de ( n + l ) croissant. Si plusieurs combinaisons possibles conduisent à la même valeur, on choisit celle possédant la plus petite valeur de n .
Soit la représentation mnémotechnique suivante :
Na(11) : 1s2 2s2
2p6 3s1 ou (Ne) 3s1
ou K2 L8 M1
K(19) : 1s2 2s2 2p6 3s2 3p6 4s1 ou (Ar) 4s1 ou K2
L8 M8 N1
Ca2+(20) : 1s2 2s2
2p6 3s2 3p6 ou (Ar) 4s1 ou K2
L8 M8
Sr(38) : 1s2
2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2 ou (Kr) 5s2 ou K2
L8 M18 N8 O2
V(23) : 1s2
2s2 2p6 3s2 3p6 3d3 4s2 ou (Ar) 3d3 4s2 ou K2
L8 M11 N2
Fe2+(26) : 1s2 2s2
2p6 3s2 3p6
3d6 4s2
ou (Ar) 3d6
4s2 ou K2 L8 M14 N2
Pb(82) : 1s2 2s2
2p6 3s2 3p6
3d10 4s2
4p6 4d10 4f14 5s2 5p6
5d10 6s2 6p2
Ou (Xe) 4f14 5d10 6s2 6p2 ou K2 L8 M18 N32 O18
P4
Co3+(27) : 1s2 2s2
2p6 3s2 3p6
3d6 ou (Ar)
3d6 ou K2 L8 M14
Br(35) : 1s2
2s2 2p6 3s2 3p6 3d10 4s2 4p5 ou (Ar) 3d10 4s2
4p5 ou K2 L8 M18
N7
S2-(16) : 1s2 2s2
2p6 3s2 3p6 ou (Ar) ou
K2 L8 M8
Al3+(13) 1s2
2s2 2p6 ou (Ne) ou K2 L8
Cs(55) : 1s2
2s2 2p6 3s2 3p6 3d10 4s2 4p6
4d10 5s2 5p6 6s1 ou (Xe) 6s1
ou K2 L8
M18 N18 O8 P1
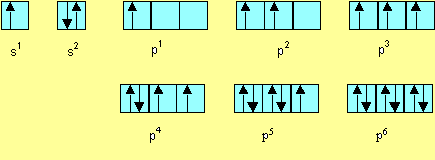
Exercice 6 : Un élément a
moins de 18 électrons et possède 2 électrons célibataires. Quelles sont les
configurations électroniques possibles pour cet élément ? Quel est cet élément
sachant qu'il appartient à la période du lithium(3) et au groupe de
l'étain(50).
L’élément
en question appartient à l’une des trois premières lignes de la classification.
La
représentation sous forme de cases quantiques montre que seules les
configurations p2 et p4 possèdent "exactement"
deux électrons célibataires. On peut aussi considérer que la configuration s2p3
peut convenir puisqu'elle compte 3 électrons célibataires. L’élément en question
ne peut donc être que : C, Si, O , S , N ou P.
On
sait qu’il appartient a la période du lithium, donc Si , S et P sont éliminés.
Cherchons
la configuration de l'étain ( Z = 50)
50 = 36 + 14 à (Kr) 4d10 5s2 5p2
L’élément cherche appartenant au même groupe que l’étain est donc le Carbone C.
|
s1 |
s2 |
p1 |
p2 |
p3 |
p4 |
p5 |
p6 |
|
H |
He |
|
|
|
|
|
|
|
Li |
Be |
B |
C |
N |
O |
F |
Ne |
|
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
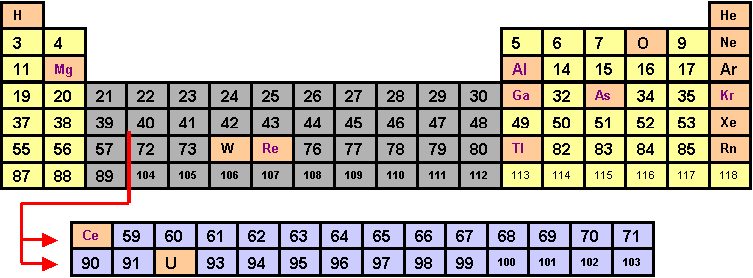
Exercice
7 :
Représentez la classification périodique et y placer les éléments suivants
:
Al, Ar, As,
Ga(31) , H, He, Kr, Mg, Ne, O , Re(75) , Ce(58) , Tl(81) , W(74) , Te(52)
, U(92)
On rappelle que
pour les éléments du bloc f un électron (n+1) d se place avant les électrons n
f et qu'exceptionnellement pour ces éléments qui sont des exceptions à la règle
de Klechkowski on en tient compte pour les placer dans la classification
périodique (voir leur position dans le cours).
Pour placer facilement les éléments il suffit de connaître
les numeros atomiques des gaz rares qui serviront de repères.
He (2) – Ne (10) – Ar (18) – Kr (36) – Xe (54) – Rn (86)
Il faut également penser au bloc f qui se place après que le
premier électron d.
Vous devez également connaître « par cœur » les
trois premières lignes, alcalins, halogènes….
Exercice 8 : Les éléments Gallium et Arsenic
Numéro atomique de quelques
éléments :
Oxygène O (Z = 8) - Magnésium Mg
(Z=12) - Gallium Ga (Z = 31) - Arsenic
As (Z = 33)
Règle de
Sanderson : un élément est métallique si le nombre d’électrons sur son
niveau de n le plus élevé est inférieur ou égal au numéro de sa période.
1)
Donner la configuration électronique de ces deux éléments.
Ga Z = 31 : 1s2 2s2
2p6 3s2 3p6
3d10 4s2
4p1 ou (Ar) 3d10 4s2 4p1 ou K2
L8 M18 N3
As Z = 33 : 1s2 2s2
2p6 3s2 3p6
3d10 4s2
4p3 ou (Ar) 3d10 4s2 4p3 ou K2
L8 M18 N5
2)
Représenter leur schéma de Lewis.
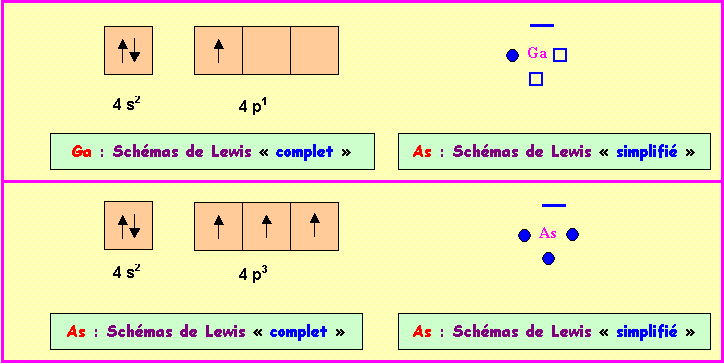
3)
Pour ces deux éléments donner sa position (Ligne et Colonne)
dans la classification périodique.
Ga : Ligne 4 - Colonne 13
As : Ligne 4 - Colonne 15
Mendeleiev dès 1869 prédit l’existence et décrivit à
l’avance les propriétés d’un de ces deux éléments qu’il nomma alors
« eka-aluminium » car il prévoyait des propriétés similaires à celle
de l’Aluminium.
4)
Quel est cet élément Ga ou As ? (justifier simplement
votre réponse)
L’élément en
question doit être dans la même colonne que celle de l’Aluminium.
Al : Z = 13 : 1s2
2s2 2p6 3s2 3p1 (colonne 13)
il
s’agit donc du Gallium.
Métaux ou non
métaux ?
Un
de ces élément est un métal qui possède la propriété d’être liquide à
température ambiante ce qui permet son utilisation dans les thermomètres.
L’autre n'est pas un métal.
5)
Rappeler les 2 critères chimiques qui permettent de
caractériser les métaux et les non-métaux.
Les métaux donnent des cations et leurs oxydes sont basiques.
Les non métaux (ou métalloïdes) donnent des anions et leurs oxydes
sont basiques.
6)
La règle dite de Sanderson permet, elle aussi, de déterminer
si un élément est métallique ou non. Par utilisation de cette règle dire entre
Ga et As qui est métallique et qui ne l’est pas.
Ga Z = 31 : (Ar) 3d10 4s2 4p1 : 3 électrons
et période 4 è Métal
As Z = 33 : (Ar) 3d10 4s2 4p3 : 5
électrons et période 4 è Non Métal
Le composé MgGa2O4 peut émettre dans certaines
conditions de la lumière verte s’il est excité par des U.V. Cette propriété
fait qu’il est utilisé dans les photocopieurs "Xerox".
7)
En supposant que le composé MgGa2O4 est de nature ionique
et que les ions sont les plus stables des éléments concernés déterminer la
charge de l’ion du Gallium dans ce composé
Cela
est-il en accord avec la question précédente ?
Magnésium Mg (Z=12)
(Ne) 3s2 cherche à ressembler à Ne en perdant deux électrons è Mg2+
Oxygène O (Z=8)
(He) 2s2 3s4 cherche à ressembler à Ne en gagnant deux électrons è O2-
MgGa2O4 doit être électriquement neutre
si on appelle x la charge de l’ion Ga :
2 + 2 x – 8 = 0 è x = + 3 è Ga3+
C’est bien un cation et Ga est donc bien un métal.
8)
Il existe un composé nommé arséniure de gallium de formule GaAs. Ce composé est
très utilisé dans la technologie des lasers car il présente la propriété intéressante de pouvoir convertir
l’électricité en lumière cohérente.
Quel
sont les deux ions qui le composent ? Cela est-il en accord avec la
question 7.
Gallium Ga (Z=31)
(Ar)
3d10
4s2 4p1 peut
facilement perdre ses électrons 4s2 4p1 è Ga3+ (cation :
Ga est un métal)
Arsenic As (Z=33)
(Ar) 3d10 4s2 4p3 peut facilement
gagner 3 électrons pour acquérir la structure 4s2
4p3 du Krypton è As3-(anion :
As est un non-métal)
GaAs = Ga3+ et As3-
10)
Il est bien connu que l’Arsenic est un poison violent. Le composé appelé couramment
Arsenic n’est pas en réalité l’élément Arsenic lui même mais un de ces oxydes
l’anhydride arsénieux de formule As2O3. Quel est la
nature de l’ion de l’Arsenic dans ce composé ?
2 x – 6 = 0 è x = + 3 è As3+
11)
Il existe un autre oxyde de l’Arsenic nommé anhydride arsénique de formule As2O5.
Quel est la nature de l’ion de l’Arsenic dans ce composé ?
2 x – 10 = 0 è x = + 5 è As5+
12)
Les deux oxydes précédants sont solubles dans l’eau et donne alors deux acides
appelés acide arsénieux HAsO2 et acide arsénique H3AsO4.
Ecrire les réactions de formation de ces deux acides.
As2O3
+ H2O = 2 HAsO2
As2O5
+ 3 H2O = 2 H3AsO4
13)
L’existence des composés As2O3, As2O5,
HAsO2 et H3AsO4 permet-elle de dire si
l’Arsenic est un métal ou un non-métal ?
Les
ions de As sont des cations et ses oxydes sont acides.
Cela
est contradictoire avec la définition normale des métaux et des non-métaux.
On ne
peut donc rien conclure.
L’Arsenic
possède donc en réalité, des propriétés intermédiaires entre celles des métaux
et des non-métaux et on le qualifie souvent de semi-métal. Il donne ainsi trois
ions différents.
14) Préciser la nature de ces trois ions et justifier
simplement leur formation à partir du
schéma de Lewis de l’Arsenic .
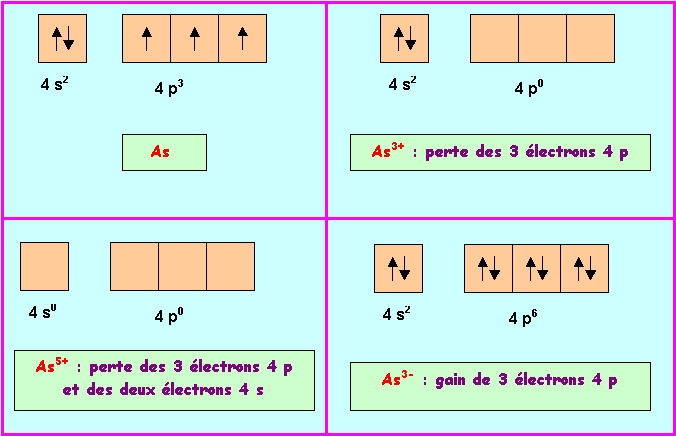
Exercice 9 :
Un composé ionique a pour formule A2B3
On sait que les éléments A et B sont
tous deux des éléments des deuxième ou troisième périodes de la classification.
On sait d’autre part que l’élément A est un METAL alors que B est un NON-METAL (ou
METALLOÏDE).
Quelles
sont les nature possibles pour ce composé ionique ?
A2B3 est un composé ionique, il contient donc des ions chargés électriquement.
Le Cation chargé positivement est obligatoirement A puisque A est un métal. Soit : An+
L'Anion chargé négativement est obligatoirement B puisque B est un non-métal. Soit : Bm-
Les charges de A et B doivent se compenser pour que A2B3 soit électriquement neutre.
2 n = 3 m
On admet que n et m sont des entiers, de plus, puisqu'il s'agit d'ions stables on sait que leur charge est inférieure à 4.
La seule solution possible est n = 3 et m = 2.
Les ions concernés sont donc : A3+ et B2-
Les possibilités sont : A = Bore (B) ou Aluminium (Al) ; B = Oxygène (O) ou Soufre (S)
Le Bore (B) de numéro atomique Z = 5 à pour configuration électronique 1s2 ; 2s2 2p1, il possède 3 électrons sur sa couche de n le plus élevé et il appartient à la deuxième période. D'après la règle de Sanderson il n'est donc pas un métal et doit donc être éliminé des hypothèses.
L'Aluminium (Al) de numéro atomique Z = 13 à pour configuration électronique 1s2 ; 2s2 2p6 ; 3s2 3p1, il possède 3 électrons sur sa couche de n le plus élevé et il appartient à la troisième période. D'après la règle de Sanderson il est donc bien un métal et peut donc être conservé dans nos hypothèses.
L'Oxygène (O) de numéro atomique Z = 8 à pour configuration électronique 1s2 ; 2s2 2p4, il possède 6 électrons sur sa couche de n le plus élevé et il appartient à la deuxième période. D'après la règle de Sanderson il n'est donc pas un métal. On peut donc le conserver dans nos hypothèses.
Le Soufre (S) de numéro atomique Z = 16 à pour configuration électronique 1s2 ; 2s2 2p6 ; 3s2 3p4, il possède 6 électrons sur sa couche de n le plus élevé et il appartient à la troisième période. D'après la règle de Sanderson il est donc bien un métal et peut donc être conservé dans nos hypothèses.
Les deux possibilités restantes sont donc finalement : Al2O3 ou Al2S3