TRAVAUX
DIRIGES : « ATOMES ET MOLECULES » - Cours de Thierry Briere
Tous les cours, sujets
d’examens et les corrigés des TD seront
accessibles sur le site : www.chimie-briere.com
Série 5 : Molécules - Modèle de Lewis - Mésomérie
- Géométrie moléculaire
L’atome dont le symbole est souligné est
l’atome central
Les rayons de covalence des atomes seront évalués par la formule
R (A°) =
0,215 (n*2/Z*) + 0,148 n* + 0,225
(avec
n*=n pour n=1 ou n=2 ; n*=3.6 pour n=4 et n*=4 pour n=5
Pour
H on prendra RH = 0,346 A°
Les
longueurs de liaisons (en A°) seront évaluées par la formule dA-B = 1,11 dCalc
- 0,203
(dCalc
= somme des rayons de covalence en A°)
ou
plus simplement, sans passer par l’intermédiaire des rayons de covalence
L (A°) =
0,239 (n*2/Z*) + 0,164 n* +
0,297
Liaison
double = 86 % de la simple - Liaison
triple = 78% de la simple
Exercice
1 :
Pour les molécules ou ions suivants :
a) Proposer une structure de Lewis.
b) Par application de la Méthode
V.S.E.P.R déterminer la géométrie.
BF3 ; COF2 ; SO32-
; POCl3 ; ClO3- ; PF5
; SF4 , SF5- ; ClF3
; ICl4- BrF5 , I3-
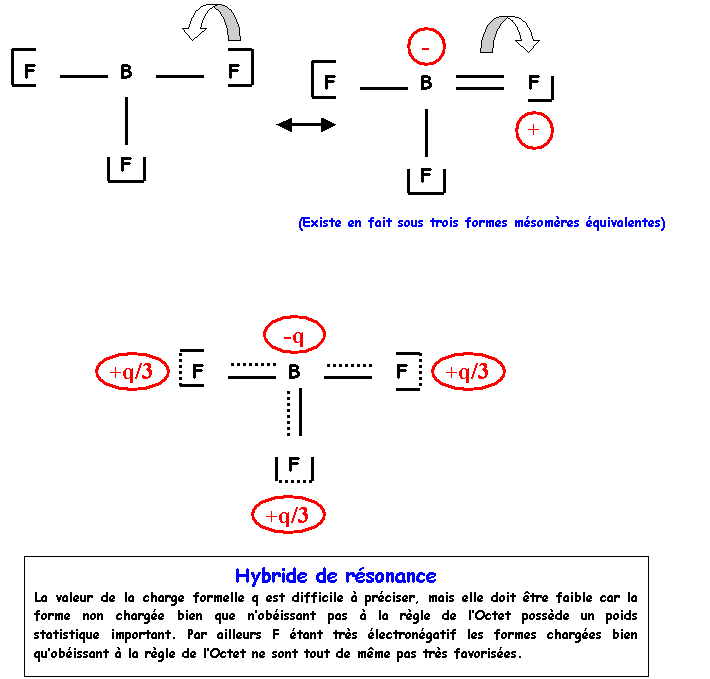
BF3
Atome
latéral : 1
liaison et trois doublets libres B fait 3 liaisons, il utilise donc ses
trois électrons et ne possède donc pas de doublets libres. Calcul des charges formelles : q = n – L
– 2 e qB
= 3 – 3 – 0 = 0 qF
= 7 – 1 – 6 = 0 Ce
schéma ne présentant aucun défauts apparents, on peu le garder tel quel. Il
correspond à une forme de poids statistique important. Atome central : 3
électrons (pas
de charges pour BF3)![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
F
F
B
![]()
![]()
![]()
![]()
F
Schéma de Lewis
hypothétique
![]() “Méthode rapide” :
“Méthode rapide” :
B : Z = 5 : 1s2 2s2
2p1
F : Z = 9 : 1s2 2s2
2p5
Remarque :
Nous
avons affaire ici a deux atomes de la deuxième période, la règle de l’Octet
peut donc jouer un rôle important. Cette forme n’obéit pas a cette règle pour l’atome
de Bore (3 doublets), on peut donc essayer de l’améliorer. Il suffit de
déplacer un doublet libre du Fluor pour faire une liaison supplémentaire, le
Bore sera alors entouré par 4 doublets et obéira donc à la règle de l’Octet.
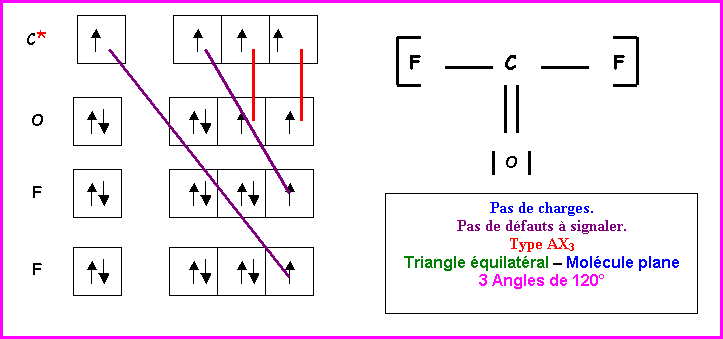
COF2
Méthode des cases quantiques :
C : Z = 6 : 1s2 2s2
2p2
O : Z = 8 : 1s2 2s2
2p4
F : Z = 9 : 1s2 2s2
2p5
SO32-
“Méthode rapide” :
S : Z = 16 : (Ne) 3s2 3p4
Atome central : 8
électrons (deux
charges pour SO32-)
![]()
![]()
O : Z = 8 : 1s2 2s2
2p4
Atome
latéral : 2
liaisons et deux doublets libres S fait 6 liaisons, il utilise donc six
électrons sur huit et il possède donc un doublet libre. Calcul des charges formelles : q = n – L
– 2 e qS
= 6 – 6 – 2 = -2 qO
= 6 – 2 – 4 = 0
![]()
![]()
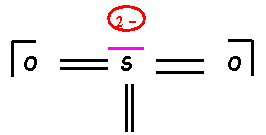
Schéma de Lewis
hypothétique
Amélioration
du schéma de Lewis obtenu :
Le schéma
obtenu présente le défaut d’avoir des charges trop localisées, de plus O étant
plus électronégatif que S devrait porter les charges négatives. Il convient donc
de rectifier ce premier schéma pour obtenir une forme mésomère de plus haut
poids statistique.
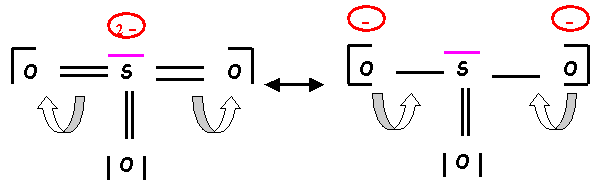
La forme obtenue existe en fait sous trois formes équivalentes.
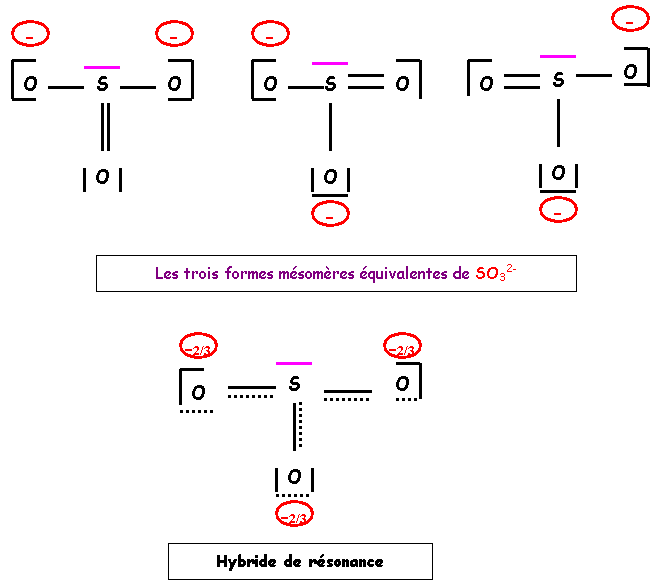
Géométrie moléculaire :
Type AX3E
Tétraèdre
avec un sommet inoccupé : angles OSO légèrement inférieurs à 109°
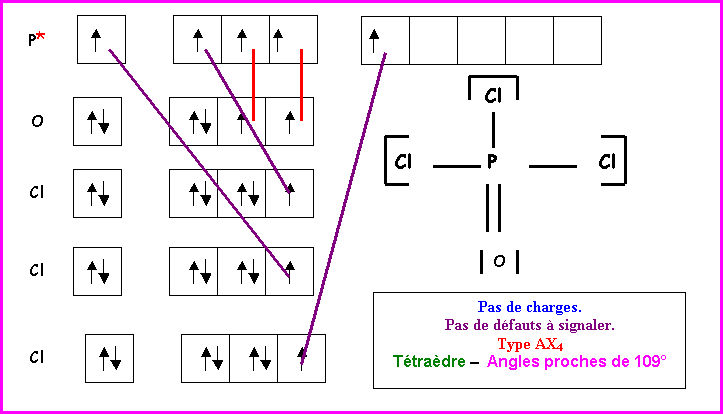
POCl3
Méthode des cases quantiques :
P : Z = 15 : (Ne) 3s2 3p3
O : Z = 8 : (He) 2s2 2p4
Cl : Z = 17 : (Ne) 3s2 3p5
ClO3-
“Méthode rapide” :
Cl : Z = 17
: (Ne) 3s2
3p5 Atome central : 8
électrons (1
charges pour ClO3-)
![]()
![]()
O
: Z = 8 : 1s2
2s2 2p4
Atome
latéral : 2
liaisons et deux doublets libres Cl fait 6 liaisons, il utilise donc six
électrons sur huit et il possède donc un doublet libre. Calcul des charges formelles : q = n – L
– 2 e qCl
= 7 – 6 – 2 = -1 qO
= 6 – 2 – 4 = 0
![]()
![]()
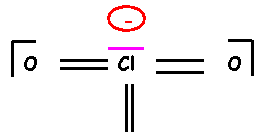
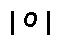
Schéma de Lewis
hypothétique
Amélioration
du schéma de Lewis obtenu :
Le schéma obtenu
présente le défaut d’avoir des charges trop localisées, de plus O plus
électronégatif que Cl, devrait porter les charges négatives. Il convient donc
de rectifier ce premier schéma pour obtenir une forme mésomère de plus haut
poids statistique.
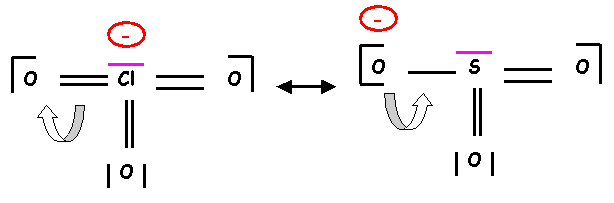
La forme obtenue existe en fait sous trois formes équivalentes.
Géométrie moléculaire :
Type AX3E
Tétraèdre
avec un sommet inoccupé : angles OClO légèrement inférieurs à 109°
Remarque : Si on compare les résultats obtenus avec ceux de SO32-,
on constate que ceux ci sont pratiquement identiques, même structure de Lewis,
même type de mésomérie et même géométrie. Cela n’est bien sur pas du au hasard,
si on compare le nombre d’électrons mis en jeu par les couches de valence des
atomes concernés on constate qu’ils sont identiques, on dit que ClO3-
et SO32- sont iso-électroniques.
ClO3- : Cl (7 e-) +
3 O (6 e-)
+ 1 charge (1 e-)
= 26 e-
SO32- : S (6 e-) +
3 O (6 e-)
+ 2 charges (2 e-)
= 26 e-
Les
atomes présentant un même nombre d’électrons sur leur couche de valence
présentent des propriétés similaires, la même chose est observée pour les molécules
iso-électroniques.
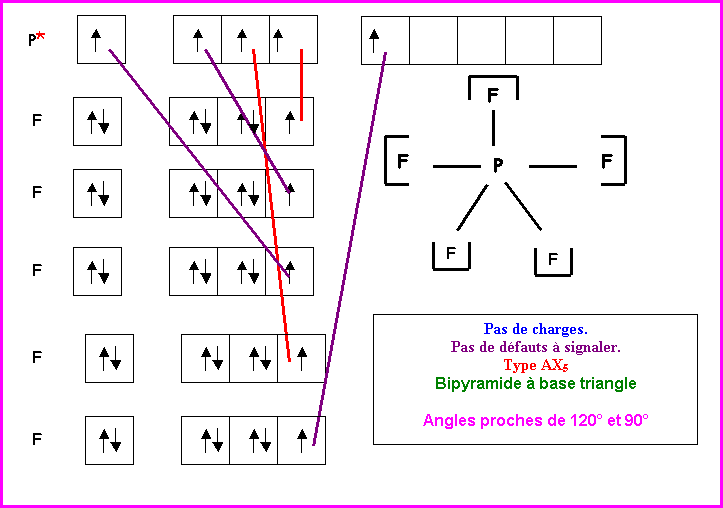
PF5
Méthode des cases quantiques :
P : Z = 15 : (Ne) 3s2 3p3
F : Z = 9 : (He) 3s2 3p5
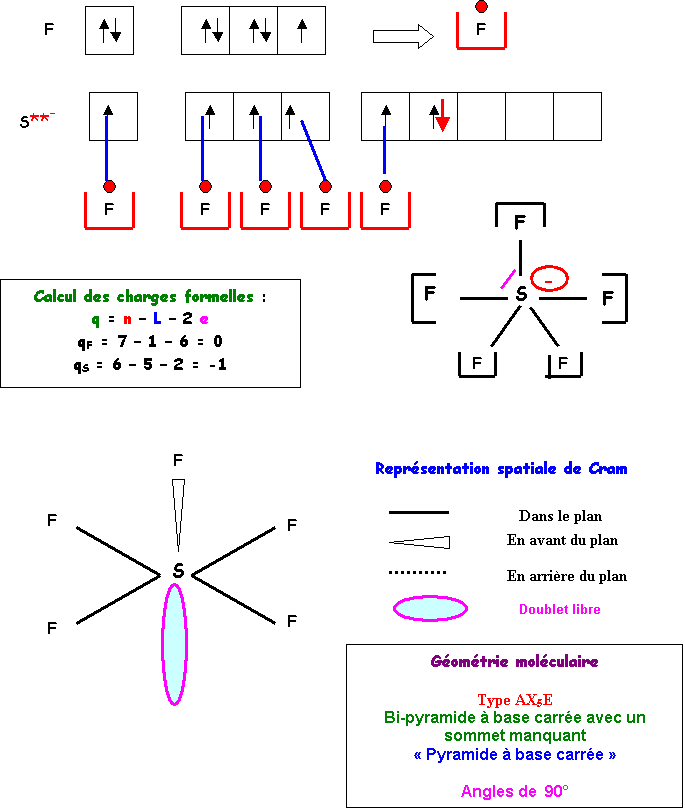
SF4
Méthode des cases quantiques :
S : Z = 16 : (Ne) 3s2 3p4
F : Z = 9 : (He) 2s2 2p5
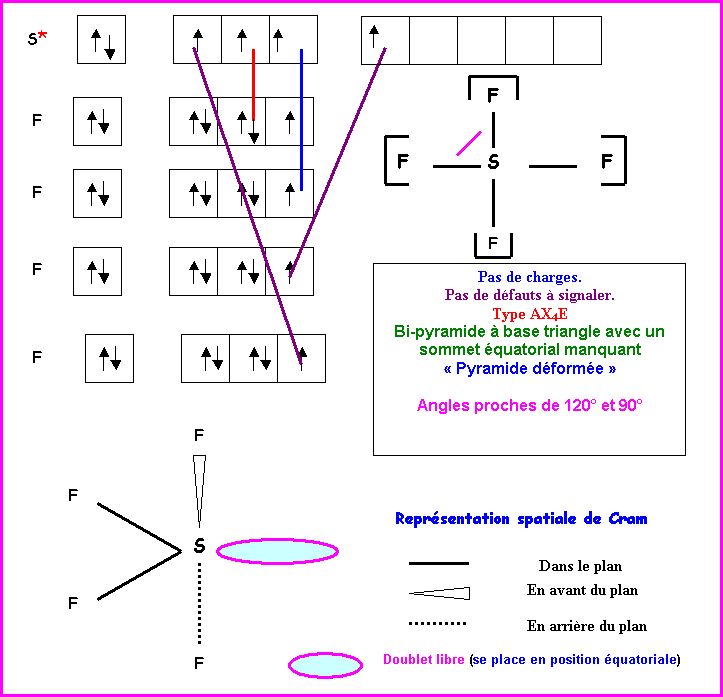
SF5-
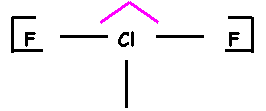
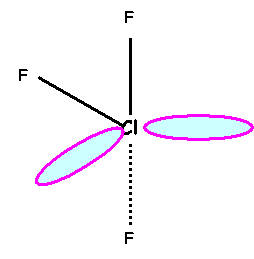
ClF3
“Méthode rapide” :
Cl : Z = 17
: (Ne) 2s2
2p5 Atome central : 7
électrons (pas
de charges pour ClF3) Atome
latéral : 1
liaisons et 3 doublets libres Cl fait 3 liaisons, il utilise donc 3
électrons sur 7 et il possède donc 2 doublets libres. Calcul des charges formelles : q = n – L
– 2 e qCl
= 7 – 3 – 4 = 0 qO
= 6 – 2 – 4 = 0 Représentation spatiale de
Cram Géométrie moléculaire Type AX3E2 Bi-pyramide à base triangle avec deux sommets
manquants « en forme de
T » Angles de 90°
![]()
![]()
![]()
![]()


![]()
![]()
![]()
![]()
F : Z = 9 : 1s2 2s2
2p5
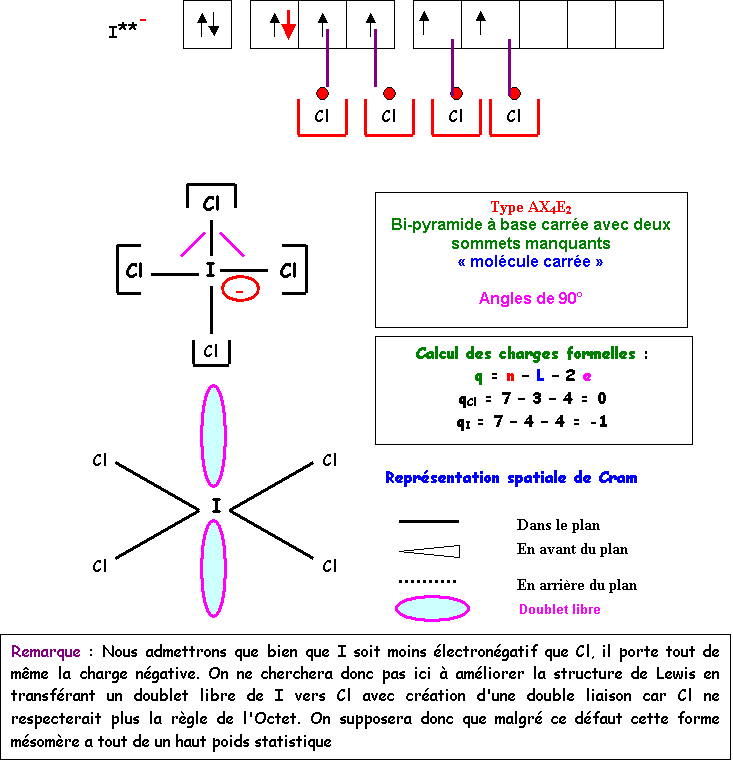
ICl4-
Méthode des cases quantiques :
I : s2 p5 Cl :
s2 p5
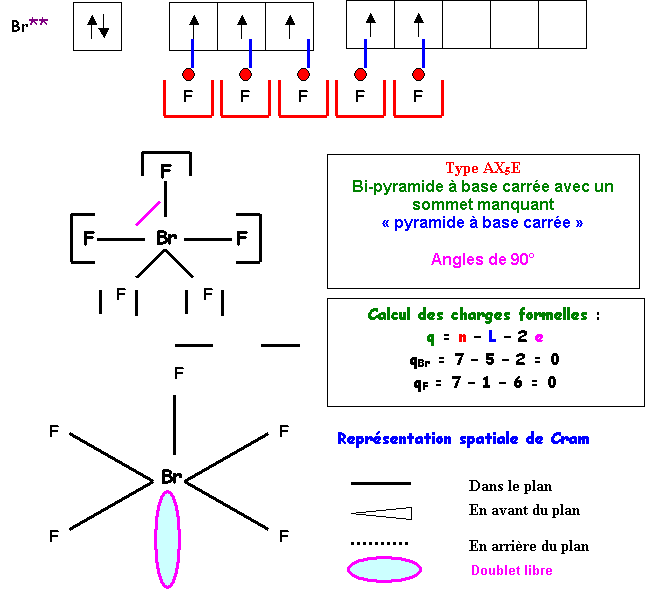
BrF5
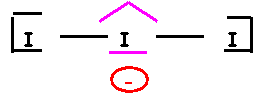
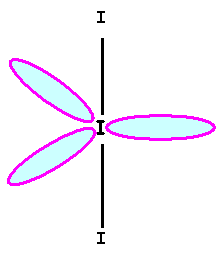
I3-
“Méthode rapide” :
![]()
I central : 8
électrons (une
charge pour I3-)
![]()
![]()
I
latéral : 1
liaisons et 3 doublets libres I central fait 2 liaisons, il utilise
donc 2 électrons sur 8 et il possède donc 3 doublets libres. Géométrie moléculaire Type AX2E3 Bi-pyramide à base triangle avec trois sommets
équatoriaux manquants « molécule
linéaire » Angle de 180° Calcul des charges formelles : q = n – L
– 2 e qI
central = 7 – 2 – 6 = -1 qI
latéral = 7 – 1 – 6 = 0 Représentation spatiale de
Cram
![]()
![]()

![]()
![]()
![]()
![]()
Exercice 2 : Oxygène et Azote
A) Molécule N2O
:
Molécule N2O : Azote central
Energie d'ionisation : 12,9 eV
|
Liaison |
N - N |
N - O |
|
Longueur (A°) |
1,128 |
1,184 |
|
Energie de dissociation (eV) |
4,9 |
1,7 |
Ion moléculaire N2O+ : Azote central
|
Liaison |
N - N |
N - O |
|
Longueur (A°) |
1,155 |
1,185 |
1) En utilisant
la formule empirique, évaluer les longueurs des liaisons N-O (simple,
double et triple) et N-N (simple, double et triple).
N : 1 s2 2s2 2p3
Z* = 7 - ( 4 * 0,35 ) - ( 2 * 0,85
) = 3,9 et n* = 2
n*2 / Z* = 4 / 3,9 = 1,026
O : 1 s2 2s2 2p4
Z* = 8 - ( 5 * 0,35 ) - ( 2 * 0,85
) = 4,55 et n* = 2
n*2
/ Z* = 4 / 4,55 = 0,879
Simple
liaison: L (A°) = 0,239 S ( n*2/Z*)
+ 0,164 S n* + 0,297
Double
liaison : 86 % de la simple - Triple liaison : 78% de la simple
Incertitude
sur la longueur de liaison : ± 0,03 A°
Liaison N - N :
L (A°) = 0,239 * ( 2 * 1,026 ) + 0,164 *
( 2 + 2 ) + 0,297 = 1,44 ± 0,03 A°
Double liaison N-N : L = 0,86 * 1,443 = 1,24 ± 0,03 A°
Triple liaison N-N : L = 0,78 * 1,443 = 1,13 ± 0,03 A°
Liaison N - O :
L (A°) = 0,239 * ( 0,879 + 1,026 ) + 0,164 *
( 2 + 2 ) + 0,297 = 1,41 ± 0,03 A°
Double liaison N-O : L = 0,86 * 1,41 = 1,21 ± 0,03 A°
Triple liaison N-O : L = 0,78 * 1,41 = 1,10 ± 0,03 A°
Résumé
:
|
Liaison |
simple |
double |
triple |
|
N-N |
1,41 < L < 1,47 |
1,21 < L < 1,27 |
1,10 < L < 1,16 |
|
N-O |
1,38 < L < 1,44 |
1,18 < L < 1,24 |
1,07 < L < 1,13 |
2) En tenant
compte de l'incertitude moyenne de ± 0,03 A° sur
les longueurs calculées, placer les "domaines" de chaque types de
liaison sur les schémas suivants:
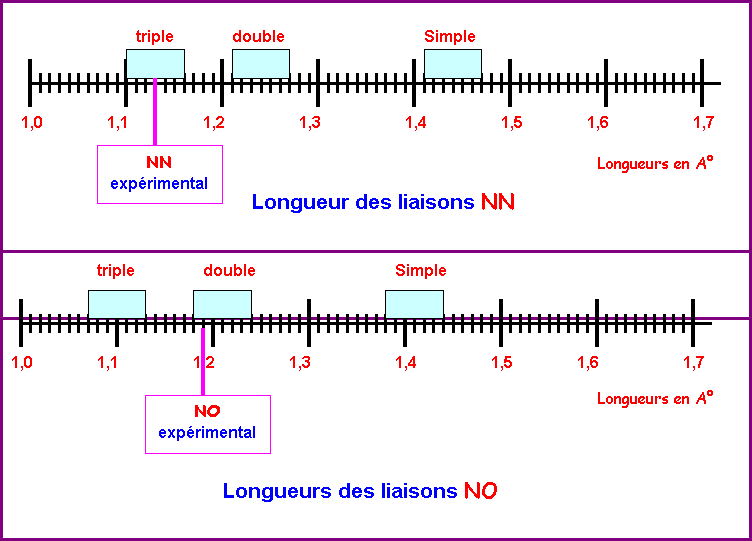
3) En se basant
uniquement sur leurs longueurs expérimentales, conclure sur la nature apparente
des liaisons NN et NO dans la
molécule N2O.
D'après les longueurs de liaisons observées, il semblerait que la
liaison N-N est triple et que la liaison N-O est double.
4) Donner le schéma de Lewis de N2O qu'on peut déduire des questions précédantes et expliquer
pourquoi ce schéma est en fait impossible.
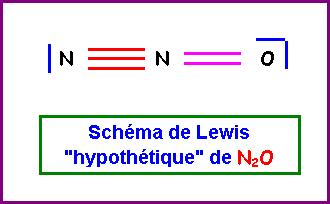
Dans ce schéma de Lewis hypothétique, l'atome d'Azote ferait 5
liaisons; cela est impossible car l'Azote appartient à la deuxième ligne de la classification
périodique et ne possède donc que 4 cases quantiques sur sa couche de valence. Il ne peut donc faire au maximum que 4 liaisons.
5) Montrer qu'en
réalité, on peut écrire deux formes mésomères différentes pour cette molécule.
Indiquer par des flèches courbées les déplacements électroniques qui permettent
de passer de l'une à l'autre.
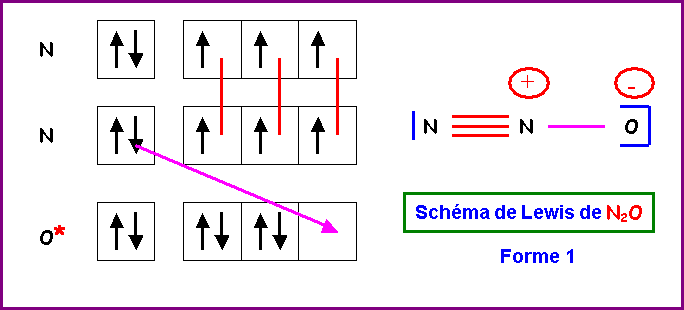
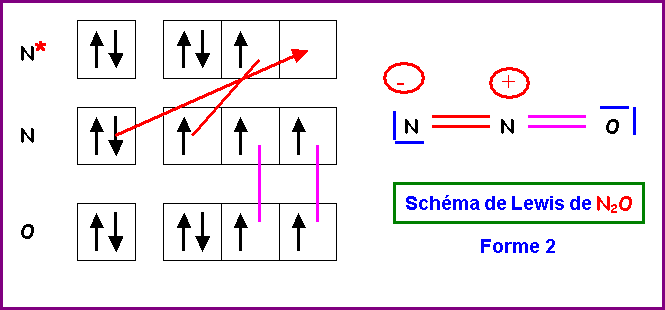
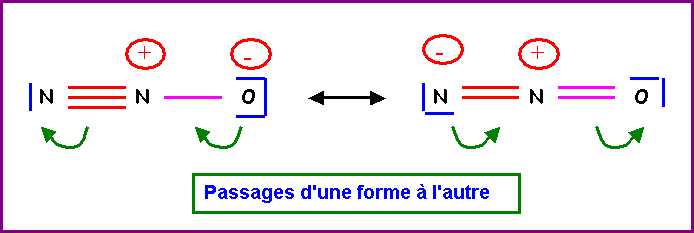
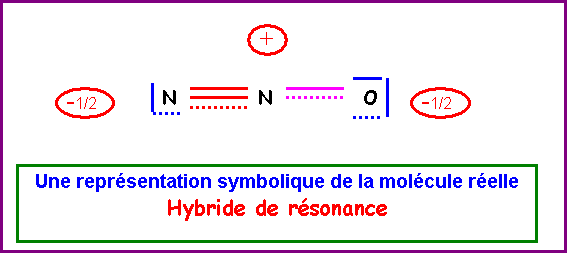
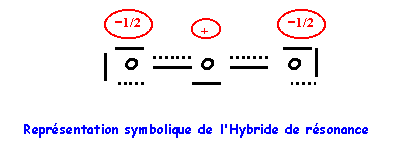
6) Donner une
représentation symbolique de l'hybride de résonance.
On
supposera pour simplifier qu'en raison des électronégativités relativement
proches de O et N les deux formes mésomères ont un poids statistique identique.
B)
N3 et O3
·
la molécule N3 possède un électron célibataire,
est linéaire et présente deux liaisons identiques de longueur 1,181 A°.
·
la molécule O3 est de forme coudée avec un angle
de 116,8° et présente deux liaisons identiques de longueur 1,278 A°.
Montrer que ces résultats expérimentaux
peuvent s'expliquer par l'intervention de formes mésomères qu'on précisera. On
donnera une représentation symbolique de l'hybride de résonance.
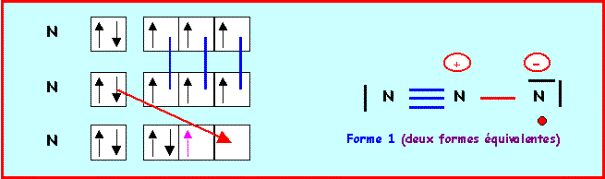
Molécule N3
Méthode rapide :
N : 2s2 2p3
N central : 5 électrons
N latéral : 1 doublet libre et trois liaisons
L'azote central devrait donc faire 6 liaisons, comme il ne possède que 5 électrons il ne peut en faire que 5, un des atomes latéraux devra donc garder un électron célibataire et ne faire que 2 liaisons. De plus l'azote faisant partie de la deuxième ligne ne peut faire au maximum que quatre liaisons on devra donc corriger le schéma en rabattant un doublet de liaison vers un azote latéral. Il y a deux manières de procéder qui conduiront a deux formes mésomères différentes.
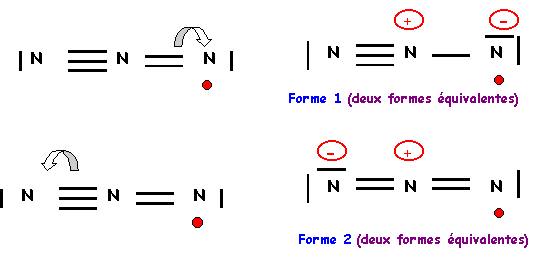
On a finalement quatre formes mésomères de "poids statistiques" équivalents, les liaisons NN seront identiques entre elles.
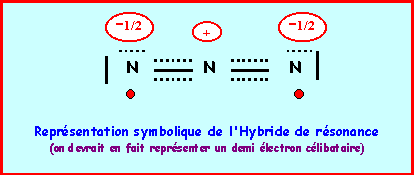
Nous avons calculé précédemment la longueur des liaisons NN (à 0,05 A° près) :
Simple : 1,44 A° - Double : 1,24 A° - Triple : 1,13 A°
La longueur de liaison réelle de 1,181 A° est intermédiaire entre celle de la double et de la triple liaison ce qui correspond bien à l'hybride de résonance. La géométrie autour de l'azote central est du type AX2 dans toutes les formes mésomères, la molécule est bien linéaire et paramagnétique.
On aurait pu aussi établir les schémas de Lewis par la méthode des cases quantiques :
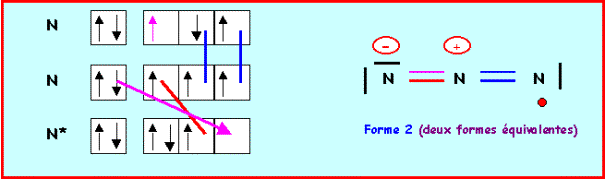
Molécule O3
Méthode rapide :
N : 2s2 2p4
O central : 6 électrons
O latéral : 2 doublets libres et deux liaisons
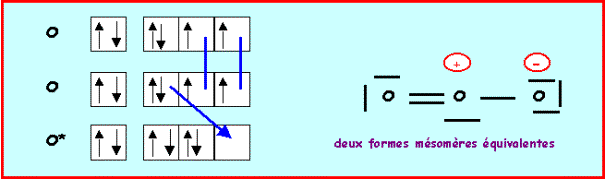
L'oxygène central devrait donc faire 4 liaisons, comme il possède 6 électrons il lui restera un doublet libre. L'oxygène faisant partie de la deuxième ligne ne peut faire au maximum que quatre liaisons en utilisant toutes ses cases quantiques de valence, s'il garde un doublet libre, il ne peut faire que trois liaisons. On devra donc corriger le schéma en rabattant un doublet de liaison vers un oxygène latéral.
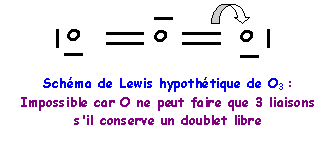
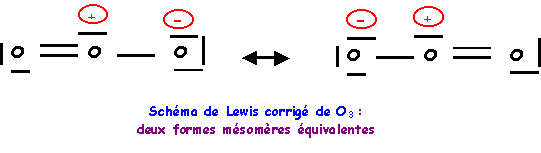
On à finalement deux formes mésomères de "poids statistiques" équivalents, les liaisons OO seront identiques entre elles.
Nous avons calculé précédemment la longueur des liaisons OO (à 0,05 A° près) :
Simple : 1,37 A° - Double : 1,18 A° - Triple : 1,07 A°
La longueur de liaison réelle de 1,278 A° est intermédiaire entre celle de la simple et de la double liaison ce qui correspond bien à l'hybride de résonance. La géométrie autour de l'oxygène central est du type AX2E, la molécule est bien coudée en forme de V avec un angle proche de 120° (116,8° à cause du doublet libre).
On aurait pu aussi établir le schéma de Lewis par la méthode
des cases quantiques :
Exercice 3
:
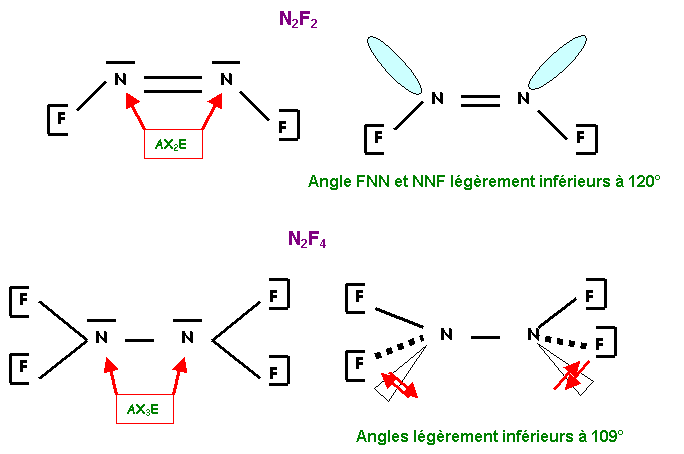
Soient les molécules N2F2
et N2F4 . Proposer une structure de Lewis pour chacune de
ces molécules. Déterminer leur géométrie.
F ne pouvant faire qu'une seule liaison
(ligne 2 et non excitable) il ne peut être l'atome central. C'est donc N qui
sera l'atome central dans ces structures.
Exercice 4 :
Le composé le plus simple entre l’azote
et le carbone est le composé de formule CN.
Ce composé est très instable mais a
néanmoins été détecté dans l’espace interstellaire et dans l’atmosphère de
certaines comètes. Les données expérimentales concernant ce composé montrent
que la longueur de la liaison CN est de 1,1718 A°.
1-1)
·
Quelle particularité électronique explique
l'instabilité du composé CN ?
·
Comment appelle-t-on ce type de composé ?
1-2)
Proposez pour ce
composé deux structures de Lewis différentes dans lesquelles on attribuera
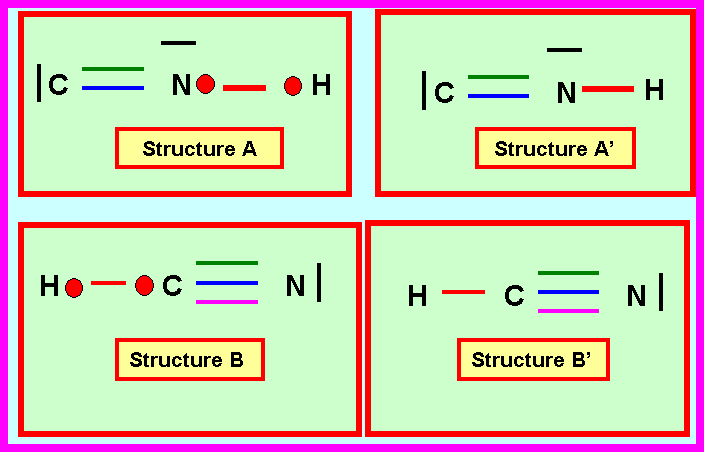
l’électron célibataire à l’atome d’Azote (structure A) ou à l’atome de Carbone
(structure B).
On se limitera aux seules formes
mésomères NON-CHARGEES
A partir du radical CN
on peut obtenir un composé hydrogéné de formule brute NCH (éléments classés
dans l'ordre alphabétique de leur nom).
1-3)Proposer deux
structures de Lewis A’ (dérivant directement de A) et B’ (dérivant directement
de B) pour ce composé hydrogéné.
1-4)Prévoir la
géométrie moléculaire, les angles et les longueurs des liaisons pour les deux
structures A’ et B’.
Il existe bien un composé stable de formule NCH. Ce composé
est nommé acide cyanhydrique et est un gaz extrêmement toxique et mortel même à
très faibles doses. La détermination expérimentale de la géométrie de ce
composé montre qu’il s’agit d’une molécule linéaire contenant deux liaisons
différentes de longueurs respectives : 1,0657 A° et 1,1530 A°.
1-5)
Quelle structure A’ ou B’ vous semble convenir pour ce composé ?
Attribuer
les deux longueurs de liaisons expérimentales.
1-6) En déduire la structure de Lewis
probable (structure A ou structure B) du radical CN.
1-1)
·
Quelle particularité électronique explique cette
instabilité ?
Le nombre total d’électron est impair et il y a donc un électron
célibataire dans cette molécule.
·
Comment appelle-t-on ce type de composé ?
Il s’agit d’un RADICAL.
1-2) Proposez pour ce composé deux structures de Lewis différentes dans lesquelles on attribuera l’électron célibataire à l’atome d’Azote (structure A) ou à l’atome de carbone (structure B).
On se limitera aux seules formes mésomères NON CHARGEES
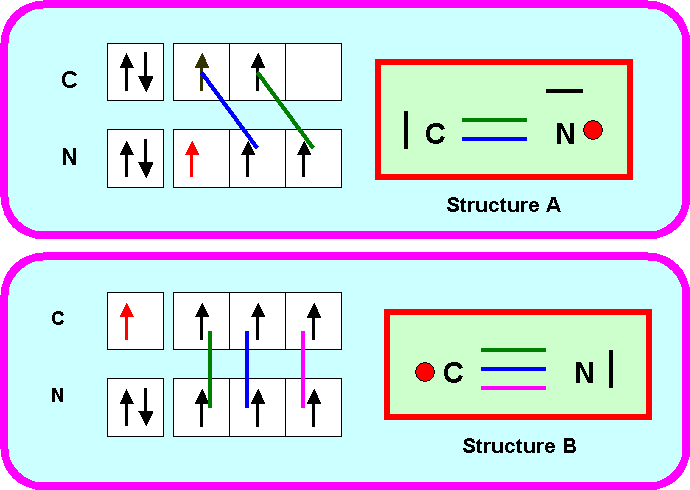
A partir du radical CN on peut
facilement obtenir un composé hydrogéné NCH (éléments classés dans l'ordre
alphabétique de leur nom)
1-3) Proposer deux structures de Lewis A’ (dérivant directement de A) et B’ (dérivant directement de B) pour ce composé hydrogéné.
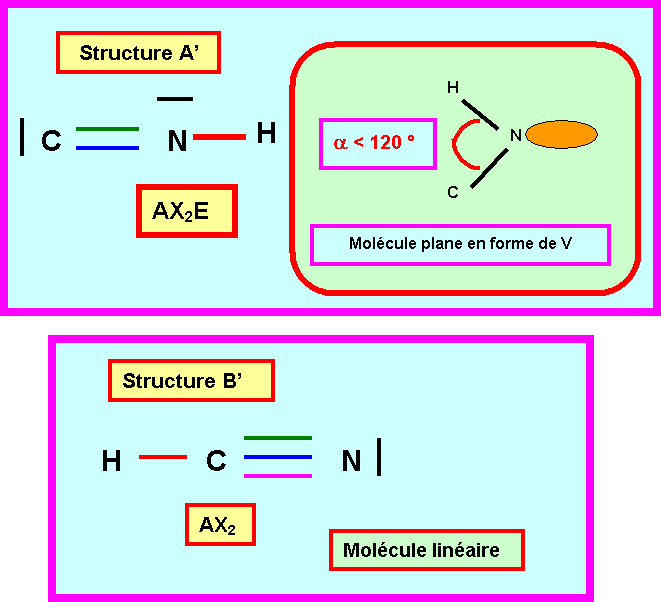
1-4) Prévoir la géométrie moléculaire, les angles et les longueurs des liaisons pour les deux structures A’ et B’.
Longueur
des liaisons :
Liaison
N – H :
LNH
= 1,11 ( 0,7415 + 0,346) - 0,203 = 1,004 A°
Liaison
C = N :
LC=N = 0,86 * [ 1,11 (0,7856+
0,7415) - 0,203 ] = 1,283 A°
Longueur
des liaisons :
Liaison
C – H :
LCH
= 1,11 ( 0,7856 + 0,346) - 0,203 = 1,053 A°
![]()
Liaison
LCN
= 0,78 * [ 1,11 (0,7856+ 0,7415) - 0,203 ] = 1,164 A°
Il existe bien un composé stable
de formule NCH. Ce composé est nommé acide cyanhydrique et est un gaz
extrêmement toxique et mortel même à très faibles doses. La détermination
expérimentale de la géométrie de ce composé montre qu’il s’agit d’une molécule linéaire
contenant deux liaisons différentes de longueurs respectives : 1,0657 A°
et 1,1530 A°.
1-4) Quelle
structure A’ ou B’ vous semble convenir pour ce composé ?
Attribuer les deux longueurs de liaisons expérimentales.
Seule
la structure B’ linéaire peut convenir pour le composé CNH.
L’attribution
des longueurs de liaison est la suivante :
|
Liaison |
Longueur
calculée |
Longueur
expérimentale |
Ecart
% |
|
H - C |
1,053 A° |
1,0657 A° |
1,2 % |
|
C - N |
1,164
A° |
1,1530
A° |
0,95
% |
1-5) En déduire la structure de Lewis
probable (structure A ou structure B) du radical CN.
La
structure du radical CN est donc probablement la structure B.
Exercice
5 :
Un peu
d’histoire :
La notion d'isomérie fut introduite par Berzélius, Wohler
et Liebig en 1823. Wohler travaillait sur l’acide cyanique qu’il obtint à
partir du cyanate d’argent et dans le même temps Liébig synthétisait l’acide
fulminique à partir du fulminate de mercure un explosif puissant. Ces deux
composés étaient bien différents l’un de l’autre de par leurs propriétés
chimiques et pourtant les deux chimistes arrivèrent à une formule brute
identique CHNO pour ces deux acides. Berzélius leur demanda de vérifier leurs
résultats car il paraissait à l’époque impossible que deux composés soient si
différents chimiquement et possèdent une même formule. Les deux savants
refirent leurs expériences et conclurent qu’il s’agissait bien de deux composés
différents ayant la même formule. Ce fut le premier cas d’isomérie qui fut
découvert et Berzélius émit l’hypothèse que c’était la manière dont les atomes
s’unissaient entre eux qui était différente et conduisait à des propriétés
chimiques différentes. Les chimistes furent alors amenés à s’intéresser à la
structure spatiale des molécules et non plus seulement à leur formule brute. Ce
fut un pas décisif dans l’histoire de la Chimie…
1)
Acide
fulminique :
L’enchaînement
des atomes est le suivant : C N O H
Donner
le schéma de Lewis d'une forme mésomère obéissant à la règle de l'octet mais faisant
apparaître des charges formelles . Préciser la géométrie.
Donner
le schéma de Lewis de l'ion fulminate. Justifier son instabilité (explosif).
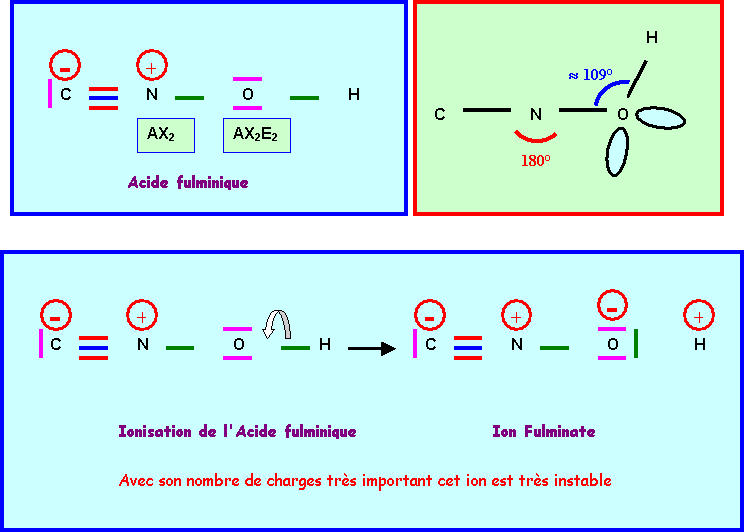
2)
Acide
Cyanique et ion cyanate :
L’enchaînement des atomes
est le suivant : N C O H
Donner le schéma de Lewis
correspondant . Préciser la géométrie.
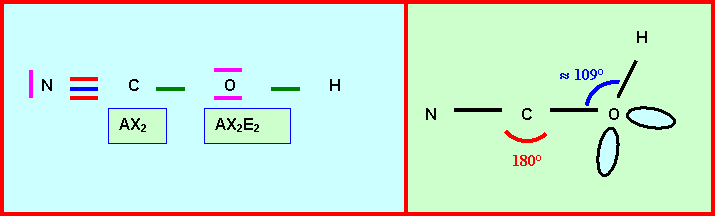
Donner le schéma de Lewis
de l’ion cyanate NCO-

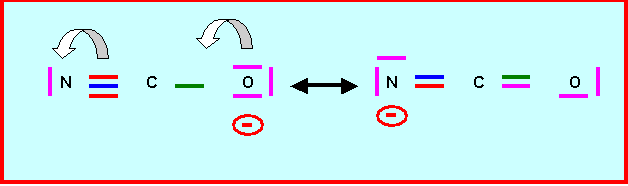
3) Mésomérie de l'ion cyanate
Pour cet ion montrer
qu’on peut écrire une forme mésomère pour laquelle la charge négative n’est pas
portée par l’atome d’oxygène mais par l’atome d’azote.
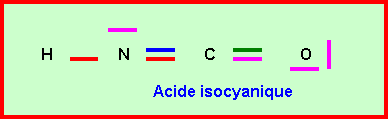
4) Acide isocyanique :
La deuxième forme
mésomère de l’ion cyanate est appelée ion isocyanate. Cet ion peut théoriquement
conduire à l’acide isocyanique isomère des acides cyanique et fulminique.
Donner le schémas de Lewis de cet acide isocyanique.
Exercice
6 :
La molécule ClO2 (dioxyde de chlore) possède un électron célibataire et est donc un radical peu stable. Elle donne facilement un cation ClO2+ et un anion ClO2- .
L’étude expérimentale de cette molécule montre que l’angle OClO est de 118,5 °
1)
Donner
un schéma de Lewis de la molécule ClO2
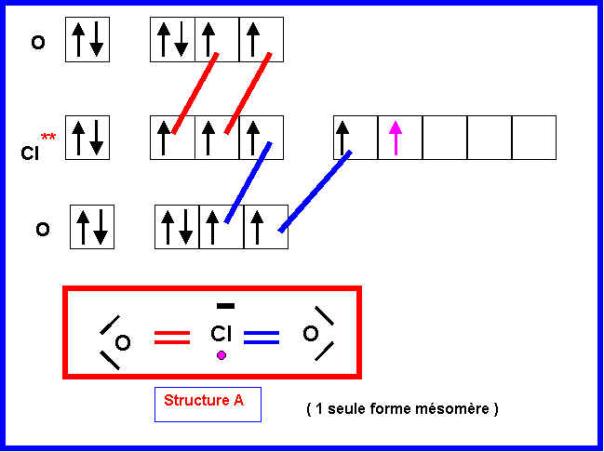
1-a) Pour lequel l’électron célibataire sera attribué à l’atome de Chlore (structure A).
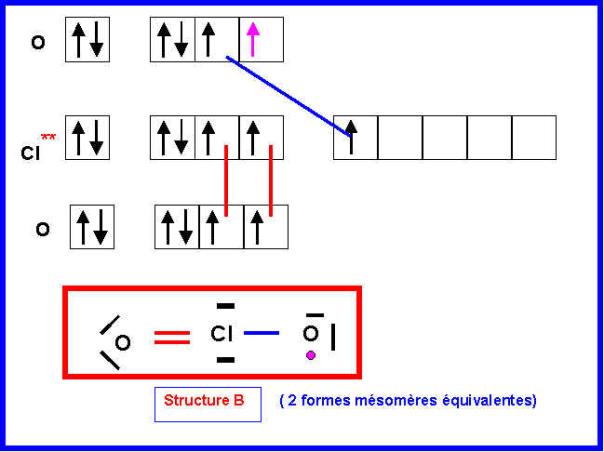
1-b) Pour lequel l’électron célibataire sera attribué à l’atome d’Oxygène (Structure B).
2) Montrer que la méthode de Gillespie permet de prévoir facilement la géométrie associée à une de ces deux structures alors qu’il est beaucoup plus difficile de prévoir la géométrie associée à l’autre.
Décrire la géométrie moléculaire pour la structure qui ne pose pas de problèmes.
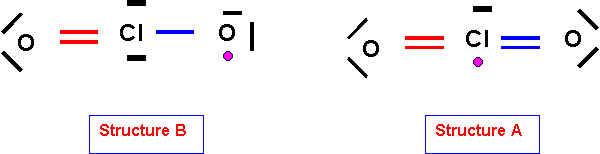
La méthode de Gillespie (V.S.E.P.R) permet de prévoir simplement la géométrie moléculaire à partir de la "disposition" des doublets électroniques autour de l'atome central. Pour que cette méthode puisse s'appliquer simplement il faut donc un nombre pair d'électrons autour de l'atome central.
La géométrie de la structure B est donc facilement prévisible (type AX2E2).
La structure A pour
lequel l'atome central possède un électron célibataire est plus difficile à
décrire.
Géométrie de la structure B :
Type moléculaire : AX2E2
4 doublets soit une figure de répulsion "tétraédrique" avec deux sommets inoccupés (doublet s libres).
La molécule est en
forme de V avec un angle OClO proche de 109,5°.
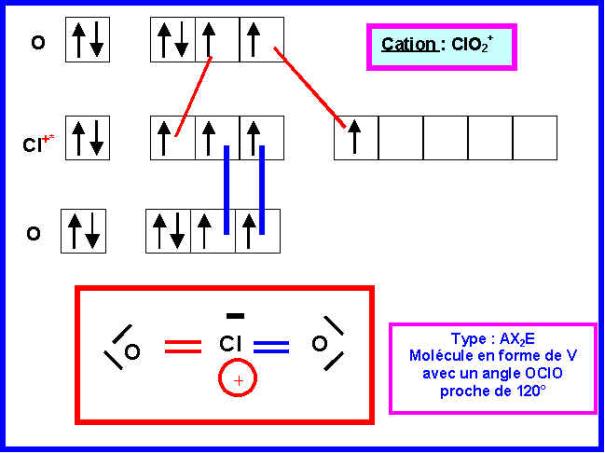
Donner les schémas de
Lewis des deux ions et prévoir leur géométrie moléculaire.
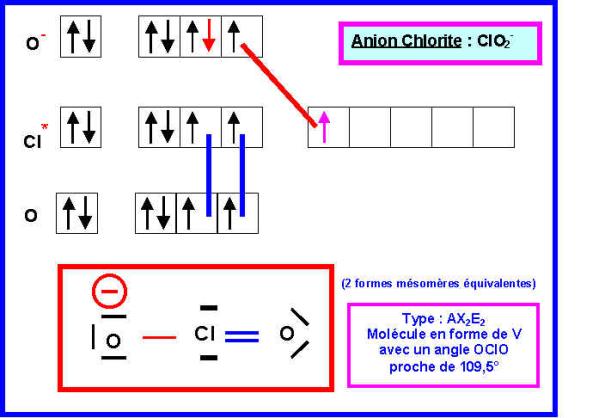
4) La géométrie de l’ion Chlorite ClO2- a été étudiée expérimentalement.
L’angle OClO trouvé expérimentalement est de 110 °, la longueur des liaisons Cl -O est de 1,55 A°
Justifier ces valeurs expérimentales.
On donne les valeurs calculées des liaisons Cl-O (en A°) :
Simple 1,67 – Double 1,44 – Triple 1,30
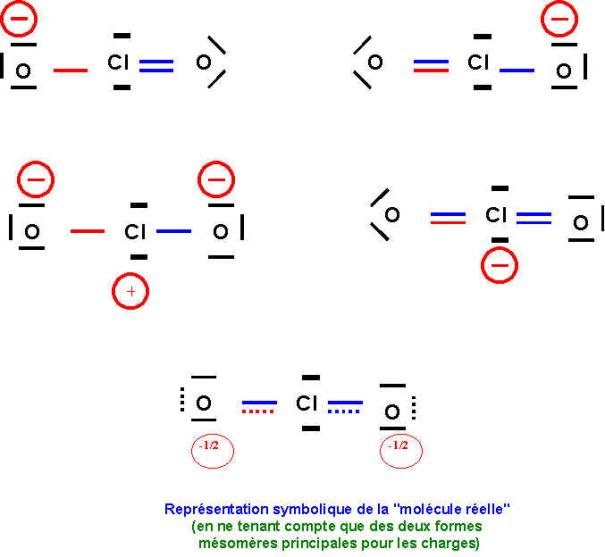
Il existe 4 formes mésomères au total puisque l'on peut écrire soit :
1 double liaison et une simple liaison (deux formes équivalentes)
2 double liaisons (une seule forme)
2 simples liaisons (une seule forme)
Les deux formes principales seront les deux formes équivalentes correspondant à une double et une simple liaison car elles présentent moins de charges et que l'oxygène est légèrement plus électronégatif que Cl (échelle de Pauling).
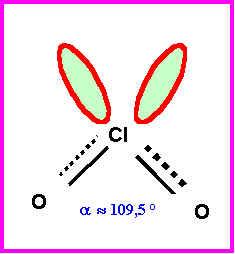
Géométrie de l'ion Chlorite :
Angle OClO
:
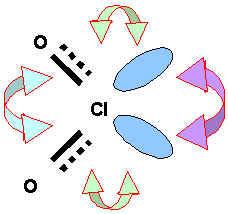
Toutes les formes mésomères sont du type AX2E2, la géométrie est donc celle d'un tétraèdre avec deux sommets en moins soit une forme de V avec un angle "théorique" de 109,5° comme dit plus haut. Il faut aussi tenir compte de la présence de doublets libres d'une part et de liaisons multiples d'autre part.. La géométrie observée expérimentalement observée est très proche de celle prévue avec un angle OClO de 110°. On peut penser que les fortes répulsions "double liaison"/"double liaison" sont responsables du très léger agrandissement de l'angle OClO observé. Mais cet effet est compensé par les fortes répulsions doublet libre/doublet libre et les répulsions doublet libre/"doubles liaisons". Globalement ces divers effets se compensent et la géométrie observée est remarquablement proche de la géométrie prévu par la méthode V.S.E.P.R.
Longueur des liaisons Cl-O
Les liaisons Cl-O sont intermédiaires entres des simples liaisons et des doubles liaisons.
La longueur observée expérimentalement (1,55) est bien comprise entre celle de la simple liaison (1,67) et celle de la double liaison (1,44).
5) Montrer que la valeur de l’angle OClO dans la molécule ClO2 (118,5°) est simplement justifiable a partir des résultats de la question 3).
ClO2 est "intermédiaire" entre ClO2+ et ClO2-
L'angle observé pour ClO2 (118,5°) est bien intermédiaire entre celui prévu pour ClO2+ (120°) et celui observé pour ClO2- (110°).
6) Montrer qu’une seule des deux structures A ou B permet d’obtenir l’angle réellement observé.
L'angle OClO observé expérimentalement est très proche de 120°.
Nous avons vu que la structure B de type AX2E2 devrait conduire à un angle proche de 109,5°. De plus, l'environnement de l'atome de Chlore est (au point de vue V.S.E.P.R) identique à celui de Cl dans ClO2-, on devrait donc avoir un angle très peu différent pour ces deux structures.
La structure B ne peut donc expliquer la valeur expérimentale de l'angle ClOCl et c'est donc la structure A qui doit être correcte.
Exercice 7
: Molécule BF3 et ion BF4-
La molécule BF3
présente trois liaisons B-F identiques dont
la longueur expérimentale est de 1,30 A°.
1)
Calculer les rayons de covalence de B et F
2)
Calculer la longueur d'une liaison B-F, simple, double et triple.
3)
Montrer que la longueur expérimentale s'explique par l'intervention de
plusieurs formes mésomères dont on écrira les schémas de Lewis.
4)
Donner une représentation symbolique de l'hybride de résonance
5)
Prévoir la géométrie de la molécule. La représenter dans l'espace et donner les
valeurs des angles FBF.
Indication
supplémentaire : une des
formes de Lewis n'est pas chargée mais ne suit pas la règle de l'octet, les
trois autres sont chargées mais suivent bien la règle de l'octet. B et F
appartenant tous deux à la deuxième période les formes chargées ont un
"poids statistique" important bien que chargées et ne respectant pas
l'ordre des électronégativités.
CORRIGE
On rappelle la formule empirique de calcul du rayon de covalence d'un atome :
R(A°) = 0,215 n2/Z* + 0,148 n + 0,225
Calculer les rayons de covalence de B et F
Z*B = 5 - 2*0,35
- 2*0,85 = 2,6
RB = 0,215 * 4
/ 2,6 + 0,148 * 2 + 0,225 = 0,852 A°
Z*F= 9 - 6*0,35
- 2*0,85 =5,2
RF = 0,215 * 4
/ 5,2 + 0,148 * 2 + 0,225 = 0,686 A°
2) On rappelle la formule empirique de calcul des longueurs de liaison simple A-B à partir des rayons de covalence (en A°).
LA-B = 1,11(RA + RB) - 0,203
double liaison 86% de la simple - triple liaison 78% de la simple
Calculer la longueur d'une liaison B-F, simple, double et triple.
B-F simple : 1,11 * ( 0,852 +
0,686 ) - 0,203 = 1,50 A°
B-F double : 0,86 * 1,50 = 1,29 A°
B-F triple : 0,78 * 1,67 = 1,17 A
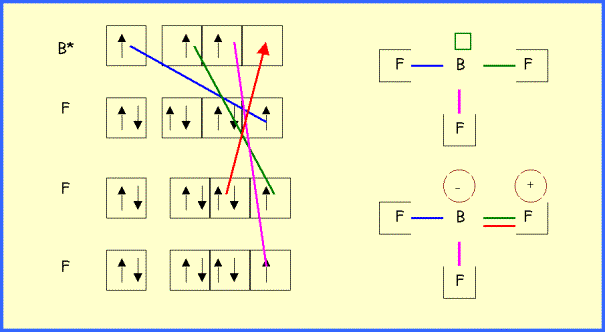
3) Montrer que la longueur expérimentale s'explique par l'intervention de plusieurs formes mésomères dont on écrira les schémas de Lewis.
La
longueur expérimentale qui mesure 1,30 A° s'accorde très bien avec la longueur
calculée pour une double liaison B = F (1,30 A°).
Construction
du schéma de Lewis de BF3
:
"Méthode
rapide" :
B central possède 3 électron de valence.
F
latéral possède un électron célibataire et fera donc une liaison avec trois
doublets libres. B faisant ainsi trois liaisons utilise ses trois électrons de
valence et ne possède donc pas de doublet libres. On a donc :
On peut vérifier qu'il n'y a pas de charges formelles dans cette structure :
Q = n - l - 2 e
QB = 3 - 3 - 0 = 0
QF = 7 - 1 - 6 = 0
Dans cette structure, la liaison B-F est simple, on peut faire apparaître une double liaison en déplaçant un doublet du Fluor. Il apparaît alors des charges formelles.
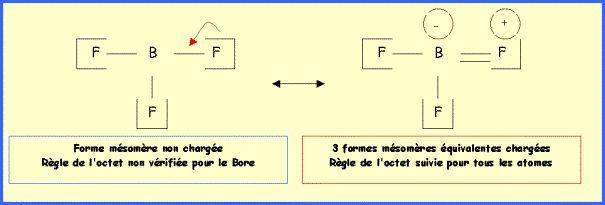
Méthode avec
utilisation des schémas de Lewis atomiques :
Cette méthode présente l'avantage de
montrer que B possède une case quantique vide (acide de Lewis) et qu'on peut
ajouter une liaison dative avec un des doublets libres du Fluor (base de
Lewis).
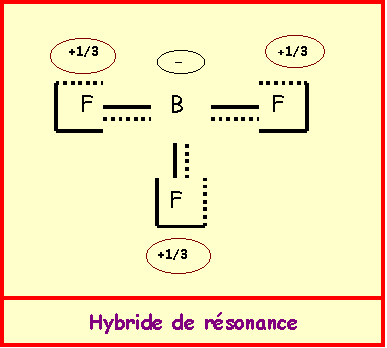
- Donner une représentation symbolique de l'hybride de résonance
2)
Prévoir la géométrie de la molécule. La représenter dans
l'espace et donner les valeurs des angles FBF.
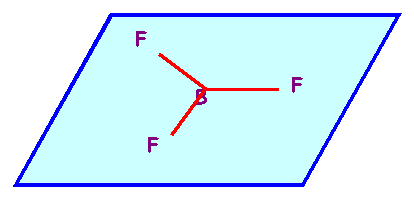
Molécule
de type AX3 totalement symétrique : Triangle équilatéral parfait
avec trois angles de 120°, molécule plane.
Ion BF4-
En
présence d'ion fluorure, BF3 donne l'ion moléculaire BF4-.
1)
Expliquer la formation de cet ion par un schéma décrivant la
formation de la liaison BF supplémentaire.
2)
Prévoir la géométrie de l'ion moléculaire. Le représenter dans l'espace et
donner les valeurs des angles FBF.
2)
De quel type de réaction s'agit-il ? Quel rôles jouent BF3
et F-.
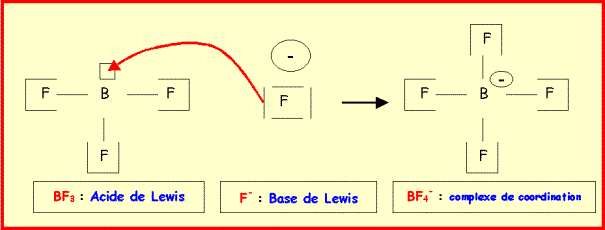
La base de Lewis F- forme une liaison dative (ou liaison de coordination) avec l'acide de Lewis BF3 en utilisant la case vide de B. Il s'agit donc d'une réaction acide base de Lewis.