TRAVAUX DIRIGES : « ATOMES
ET MOLECULES » - Cours de Thierry Briere
Tous
les cours, sujets d’examens et les corrigés
des TD seront accessibles sur le site : www.chimie-briere.com
SERIE 8 : MODELE
C.L.O.A –O.M - Hybridation et recouvrement des
Orbitales Atomiques
Exercice 1 :
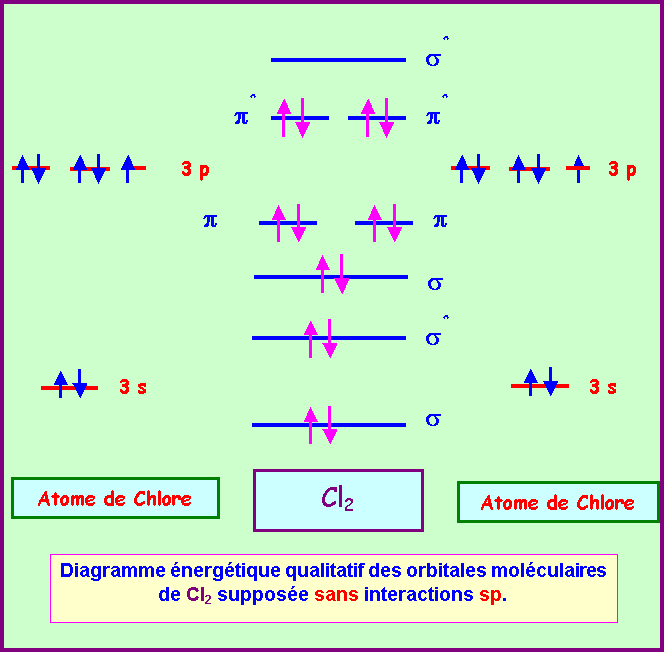
Décrire
la molécule de dichlore Cl2 dans le modèle C.L.O.A -O.M (combinaison
linéaire d'orbitales atomiques -orbitales moléculaires)
Le Chlore est un halogène, sa couche de valence est donc de type s2
p5. On suppose qu'il n'y a pas d'intéractions sp. Il y a au total 14
électrons à placer dans les orbitales moléculaires.
Le schéma C.L.O.A - O.M est donc le suivant (voir page suivante)
La
longueur de liaison mesurée expérimentalement pour la molécule Cl2
dans son état fondamental est de 199 pm. Pour l'ion moléculaire Cl2+
on trouve une distance de liaison de 189 pm seulement. Pour le premier état
excité de la molécule Cl2 la
distance de liaison est de 247 pm. Expliquer ces variations. (1 pm = 10-12
m)
Comparaison Cl2 / Cl2+
On arrache un électron de l'O.M la plus élevée en énergie, il
s'agit ici d'une orbitale anti-liante p*.
On stabilise donc la molécule, l'indice de liaison est augmenté et
la liaison est raccourcie.
nl(Cl2) = ( 8 -
6 ) / 2 = 1
nl(Cl2+) = ( 8 - 5 ) / 2 = 1,5
On passe ainsi de 199 pm pour Cl2 à 189 pm pour Cl2+.
Comparaison Cl2 / Cl2*
La seule possibilité d'excitation est le saut d'un électron p* en s*
L'énergie de la molécule est augmentée. On déstabilise donc la
molécule, et la liaison est rallongée.
On passe ainsi de 199 pm pour Cl2 à 247 pm pour Cl2*.
Exercice 2 :
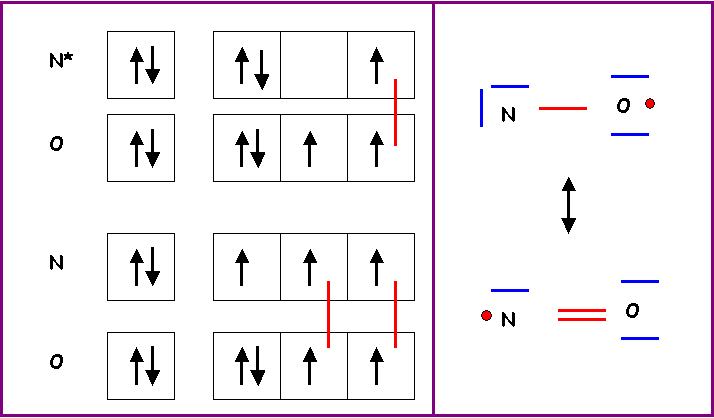
La
molécule de monoxyde d’azote NO
est
paramagnétique.
-
Essayez
de décrire cette molécule dans
le modèle de Lewis.
Cette
molécule possède un nombre impair d'électrons, il s'agit d'un Radical.
L'électron
célibataire est représenté par un
point.
-
Ce
modèle rend-il compte de son paramagnétisme ?
La
molécule possédant un électron célibataire est donc bien paramagnétique.
-
Décrire
cette molécule dans le modèle C.L.O.A - O.M.
(on supposera qu’il y a intéraction s-p)
L'atome
d'Oxygène étant plus électronégatif que l'atome d'Azote ces niveaux
énergétiques sont plus bas.
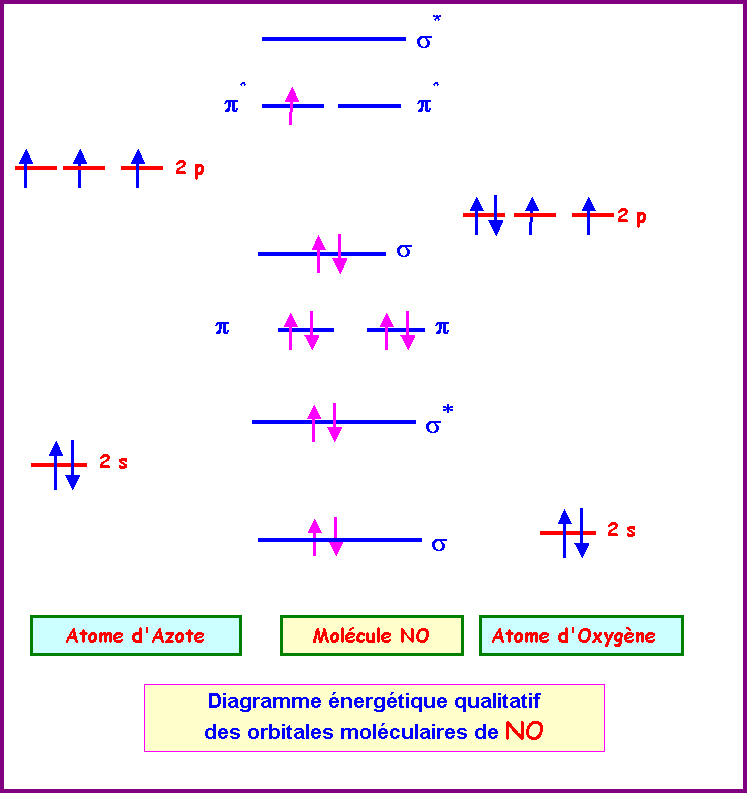
-
Ce
modèle rend-il compte du paramagnétisme de cette molécule ?
Il
y a bien un électron célibataire (sur un niveau p*),
la molécule est donc bien paramagnétique.
-
La
distance N -O dans la
molécule NO est 1,15 A°.
Justifier cette valeur expérimentale.
On
utilise la formule approchée de calcul des longueurs de liaisons.
R (A°) = 0,215 (n*2/Z*) +
0,148 n* + 0,225
dA-B = 1,11
dCalc - 0,203
Liaison double = 86 % de la simple - Liaison triple = 78% de la simple
On
obtient :
Z*N
= 3,9
n*N = 2
RN = 0,742 A°
Z*O = 4,55
n*O = 2
RO = 0,71 A°
LNO Simple : 1,41 A° - LNO
Double : 1,21 A° - LNO Triple : 1,10 A°
La
longueur expérimentale de 1,15 A° est intermédiaire entre la double et la
triple liaison.
Le
calcul de l'indice de liaison confirme ce calcul approché :
nl = 1/2 ( 8 - 3 ) = 2,5
-
L’ionisation
de NO en NO+ est assez
facile. Justifier ce fait expérimental.
L'ionisation
de NO en NO+ correspond à l'enlèvement d'un électron anti-liant et
stabilise donc la molécule.
L'ion
NO+ est donc facile à obtenir.
On
remarque que NO+ est iso-électronique de N2 (10 électrons)
sont indice de liaison est 3.
-
Comparer
les distances N - O dans NO
et NO+.
La liaison N-O sera plus courte dans NO+ que dans NO.
Exercice 3 : (suite de l’exercice 2 de la série 5 )
B)
Etude des liaisons N-N
et N-O :
1) En utilisant
l'approximation C.L.O.A - O.M décrire la liaison qui s'établit entre deux
atomes d'Azote. Etablir le diagramme énergétique des O.M et calculer l'indice
de liaison. On supposera qu'il y a
interaction sp.
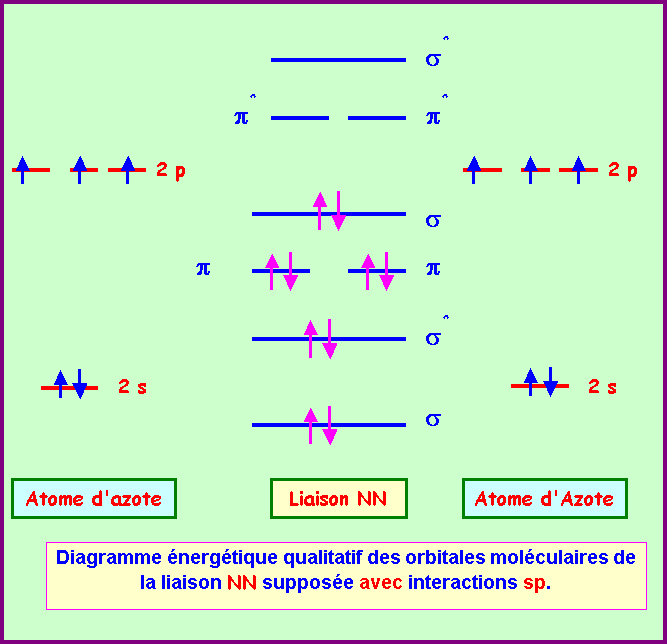
Calcul
de l'indice de liaison :
nl = 1/2 ( n - n* ) = 1/2 ( 8 - 2 ) = 3
2)
En utilisant l'approximation C.L.O.A - O.M décrire la
liaison qui s'établit entre un atome d'Azote et un atome d'Oxygène. Etablir le
diagramme énergétique des O.M et calculer l'indice de liaison. On supposera qu'il y a interaction sp.
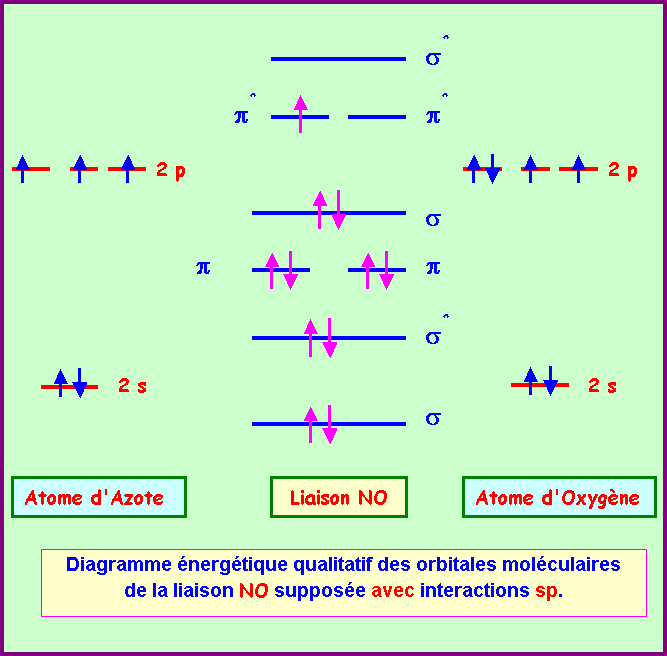
Calcul
de l'indice de liaison :
nl = 1/2 ( n - n* ) = 1/2 ( 8 - 3 ) = 2,5
3) Dans N2O,
l'énergie de dissociation de la liaison N-O (1,7 eV) est
nettement inférieure à celle de la liaison N-N (4,9 eV).
Justifier simplement.
La dissociation correspond à la rupture de la liaison.
L'indice de liaison est en première approximation une bonne
mesure de l'énergie de dissociation, plus l'indice de liaison est élevé et plus
la liaison est solide et donc difficile a casser.
Plus l'indice de liaison est élevé et plus l'énergie de dissociation
augmente.
La liaison NN présentant un indice de liaison plus élevé que celui
de la liaison NO il est normal que son énergie de dissociation soit plus élevé.
Remarque : En toute
rigueur l'énergie de liaison dépend aussi de la nature des atomes liés on ne
peut comparer directement deux liaisons très différentes entre elles. Dans le
cas qui nous intéresse ici, on peut considérer que N et O sont suffisamment proches pour que l'on puisse sans grands
risques comparer les liaisons NO et NN entre elles.
C)
Ionisation de N2O
En enlevant un électron à la molécule N2O on obtient
l'ion moléculaire N2O+.
Si on compare les longueurs des
liaisons dans N2O et
N2O+, on constate
que la longueur de la liaison NN augmente sensiblement alors que celle
de la liaison NO reste pratiquement constante.
1) A quelle
liaison appartient l'électron arraché ?
Puisque seule la liaison NN est modifiée c'est que l'électron
arraché appartient à cette liaison.
2) Justifier ce
résultat en utilisant les résultats des questions B -1 et B -2.
Pour cela on supposera qu'on arrache un
électron à une liaison N-N ou à une liaison N-O et on jugera
de l'effet de cette action sur la longueur de la liaison correspondante.
Liaison NN :
Le dernier niveau occupé est
un niveau liant. Si on arrache un électron, on déstabilise la molécule et l'indice de liaison diminue. La longueur de
la liaison augmente donc.
Liaison NO :
Le dernier niveau occupé est
un niveau anti-liant. Si on arrache un électron, on stabilise la molécule
et l'indice de liaison augmente. La
longueur de la liaison diminue donc.
L'augmentation observée de la longueur de liaison NN
confirme bien le fait que l'électron arraché appartient à cette liaison. (Si l'électron arraché appartenait à la liaison NO
on observerait une diminution de la longueur de celle-ci. )
3) A partir des
résultats précédents justifier le fait que l'énergie d'ionisation de N2O est
particulièrement élevée (12,9 eV).
Puisque l'électron arraché est un électron liant de la liaison NN
il est normal que l'énergie d'ionisation soit élevée. En effet l'ionisation
déstabilise la molécule et sera donc difficile. (Si l'électron
arraché appartenait à la liaison NO, il aurait s'agit d'un électron anti-liant,
le processus aurait stabilisé la molécule, il aurait été facile et on
observerait donc une énergie d'ionisation faible.)
Exercice 4 :
On s’intéresse
aux molécules O2 et S2.
a) Donner un
diagramme décrivant la molécule de dioxygène en utilisant l’approximation
C.L.O.A (Combinaison Linéaire d’Orbitales Atomiques)
Si on suppose que O2 est sans interactions sp.
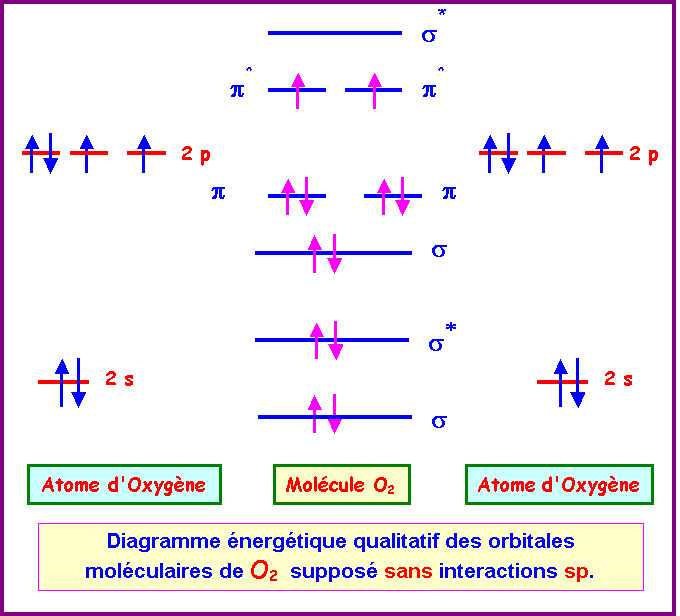
Si on suppose que O2 est avec interactions sp :
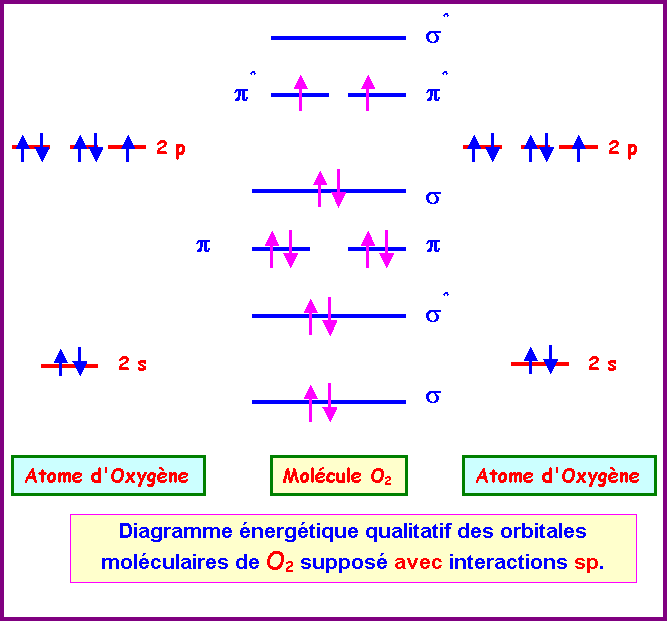
b) Cette molécule
est-elle Paramagnétique ou Diamagnétique ? Pourquoi ?
Les
deux diagrammes obtenus avec ou sans interactions sp montrent la présence de
deux électrons célibataires.
La molécule O2 est donc paramagnétique.
Remarque :
Les deux diagrammes (avec ou sans
interactions sp) sont en fait très peu différents.
Ordre des O.M :
Sans interactions : s
- s* - s -
p p - p* p*
- s*
Avec interactions : s
- s*
- p p - s - p* p*
- s*
Pour que les deux types de remplissage
conduisent à des différences notables il faut que le nombre d'électrons a
placer dans les O.M soit compris entre 5 et 9.
Parmi les molécules diatomiques
homonucléaires seules Be2 et C2 conduiront à des différences
marquées selon le type de remplissage utilisé.
c) Cela était-il
prévisible par la théorie de Lewis ? Pourquoi ?
Dans
le modèle de Lewis les électrons sont toujours associés par paires, sauf bien
entendu, s'ils sont en nombre impair.
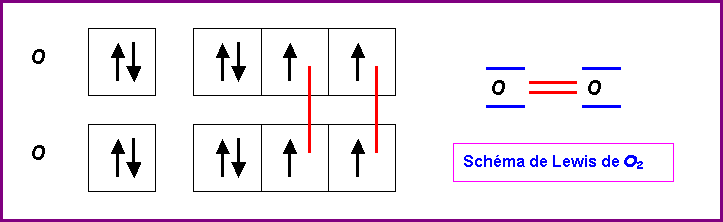
Il n'apparaît pas d'électrons célibataires dans le schéma de Lewis
de O2 qui semble donc être diamagnétique.
d) Pour la
molécule S2 et les ions moléculaires correspondants (S2+;
S22+ ; S2- ; S22-) on trouve les
résultats suivants pour les distances de liaisons S-S :
d S-S (A°)
1,72 1,79 1,88 2 2,20
Attribuer à
chaque espèce sa longueur de liaison.
S et
O appartiennent à la même colonne de la
classification périodique.
Nous supposerons que les orbitales atomiques 3 d de
S n'interviennent
pas dans la formation des liaisons dans S2.
Leurs orbitales atomiques sont donc similaires et le diagramme des
orbitales moléculaires de S2
est semblable à celui de O2
établi précédemment.
Nous avons vu plus haut que
les diagrammes avec ou sans interaction conduiront aux même conclusions puisque
seules les molécules Be2 et C2 conduisent à des différences notables. On
sait d'autre part que O2 est en fait sans interactions sp à cause de
l'écart énergétique important entre les niveaux 2s et 2p.
Nous supposerons qu'il en
est de même pour S2 et
nous utiliserons donc le diagramme sans interactions sp.
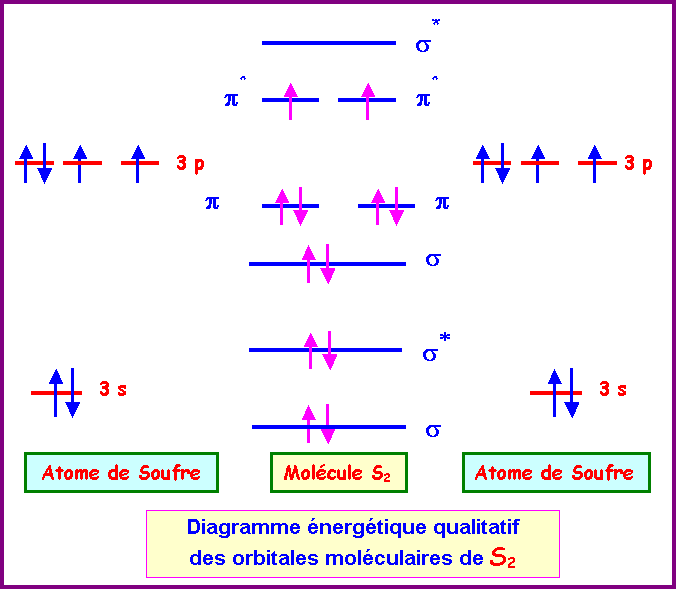
La
configuration électronique de S2 peut s'écrire
:
s12 - s1*2 - s22 - p12 - p22 - p1*1 - p2*1
- s2*0
Le dernier niveau occupé est un niveau anti-liant de type p*.
Il contient 2 électrons et peut encore en recevoir deux autres.
Si on ajoute 1 ou 2 électrons à la molécule S2 pour
former S2- et
S22-
les deux électrons ajoutés viendront finir de remplir ce niveau anti-liant.
Cela déstabilisera la molécule, l'indice de liaison diminuera et la
longueur de liaison S-S
augmentera.
nl = 1/2( n - n*)
Pour S2 : nl
=
1/2( n - n*) = 1/2 ( 8 - 4 ) = 2
Pour S2- : nl
=
1/2( n - n*) = 1/2 ( 8 - 5 ) = 1,5
Pour S22- : nl
=
1/2( n - n*) = 1/2 ( 8 - 6 ) = 1
Si on enlève 1 ou 2 électrons à la molécule S2 pour
former S2+ et
S22+
les deux électrons enlevés partiront de ce niveau anti-liant.
Cela stabilisera la molécule, l'indice de liaison augmentera et la
longueur de liaison S-S
diminuera.
nl = 1/2( n - n*)
Pour S2 : nl
=
1/2( n - n*) = 1/2 ( 8 - 4 ) = 2
Pour S2+ : nl
=
1/2( n - n*) = 1/2 ( 8 - 3 ) = 2,5
Pour S22+ : nl
=
1/2( n - n*) = 1/2 ( 8 - 2 ) = 3
Il est donc facile d'attribuer les diverses longueurs de liaisons
aux diverses espèces :
|
|
S22+ |
S2+ |
S2 |
S2- |
S22- |
|
Indice
de liaison |
3 |
2,5 |
2 |
1,5 |
1 |
|
d S-S (A°) |
1,72 |
1,79 |
1,88 |
2 |
2,20 |
Exercice 5:
Le Diazote N2
Décrire la molécule de
diazote N2 dans le modèle C.L.O.A - OM. On précisera l'indice de
liaison et on indiquera si ce composé est paramagnétique ou diamagnétique ?
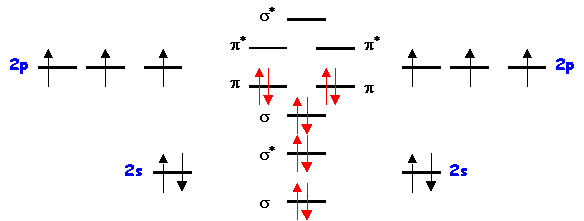
Pas
d'électrons célibataires : molécule diamagnétique
Indice de
liaison : nl = 1/2 ( 8 - 2 ) = 3
Exercice 6 :
On
donne les énergies des orbitales atomiques des atomes de carbone et d’oxygène
exprimées en eV.
Carbone : 1s (-307 eV) ; 2s
(-19 eV) ; 2p (-11,7 eV)
Oxygène : 1s (-560 eV) ; 2s (-33,7 eV) ; 2p (-17,1 eV)
1)
Molécules C2 et O2
a)
Construire sur un même graphique les diagrammes énergétiques de C et O.
b)
Pour une de ces molécules il y a une forte interaction sp. Laquelle ?
c)
L’interaction sp est négligeable pour l’autre. Laquelle ?
d)
Construire le diagramme des Orbitales moléculaires de C2 et de O2.
e)
Ces deux molécules peuvent donner chacune un cation et un anion. Quand on
observe les longueurs de liaisons on trouve :
dO2-
> dO2 > dO2+ et dC2+
> dC2 > dC2-
Justifier
ces résultats.
f)
Dans la série O2 , O2+ et O2-
quelle est la molécule dont l’énergie de dissociation est la plus élevée?
Pourquoi?
2) Molécule
CO
On donne les énergies des O.M de CO en eV :
-560 (1 s) ;
-307 (2 s) ; -40,5 (3 s) ; -19,9 ( 4 s) ; -15,8 (1 p)
; -13,5 (5 s) ; 7,1 (2 p) ; 25,3 (6 s)
a)
Construire le diagramme des O.M correspondant.
b)
Quand on passe de CO à CO+, la distance de liaison ne varie
pratiquement pas. Justifiez ce résultat expérimental.
Molécules C2
et O2
a) Diagramme énergétique des Orbitales
Atomiques :
Seules
les orbitales de valence sont prises en compte, les électrons de cœur
n'intervenant pas dans les propriétés chimiques.

b)
Les interactions sp seront importantes
pour C2 et
négligeables pour O2.
En effet, l'écart Dsp est faible dans le cas du Carbone ( Dsp = 19 -11,7 = 7,3 eV) et important dans le cas de
l'Oxygène ( Dsp = 33,7
-17,1 = 16,6 eV).
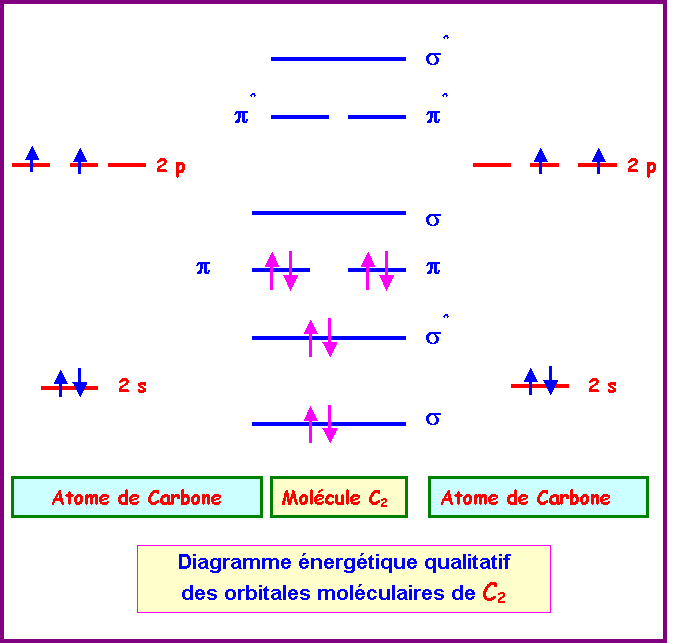
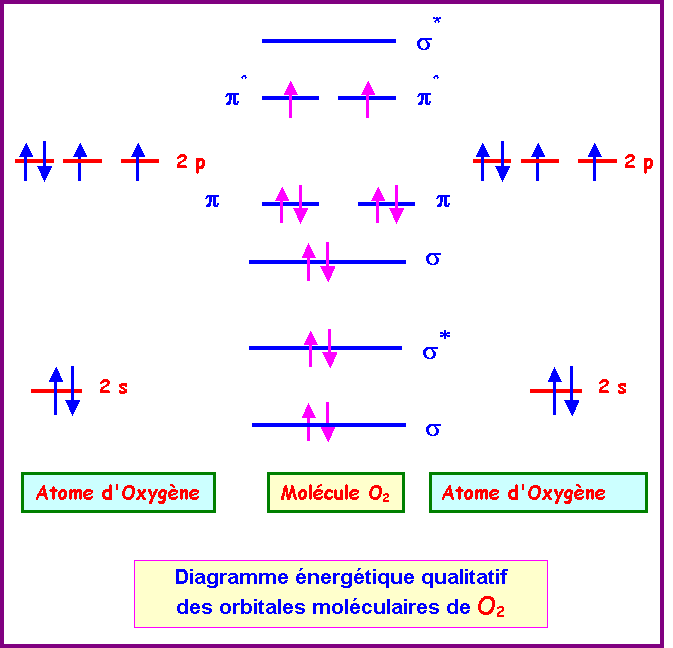
e)
Cas
de O2
La
configuration électronique de O2 peut s'écrire
:
s12 - s1*2 - s22 - p12 - p22 - p1*1 - p2*1
- s2*0
L'indice
de liaison dans O2 est de :
nl = 1/2( n - n*) = 1/2 ( 8 - 4 ) = 2
Si on ajoute un électron pour former O2- l'électron
supplémentaire se placera sur le premier niveau vacant (non complètement
occupé) c'est à dire ici p1*.
L'ajout d'un électron sur un niveau
anti liant déstabilise la molécule, cela se traduit par une diminution de l'énergie de dissociation et à une
augmentation de la longueur de la liaison. On peut vérifier cela en calculant
l'indice de liaison dans O2-.
nl = 1/2( n - n*) = 1/2 ( 8 - 5 ) = 1,5
Si on enlève un électron pour former O2+ l'électron
partant sera celui de plus haute
énergie c'est à dire situé sur le dernier niveau occupé, ici p1* ( ou p2* ) .
Le départ d'un électron sur un niveau anti
liant stabilise la, cela se traduit par une augmentation de l'énergie de
dissociation et à une diminution de la longueur de la liaison.
On peut vérifier cela en calculant
l'indice de liaison dans O2+.
nl = 1/2( n - n*) = 1/2 ( 8 - 3 ) = 2,5
Finalement on retrouve bien l'ordre des longueurs de liaison : d O2+ < dO2 < d O2-
Cas de C2
La configuration électronique de C2 peut s'écrire :
s12 - s1*2 - p12 - p22 - s20 - p1*0 - p2*0 - s2*0
L'indice de liaison dans C2 est de :
nl = 1/2 ( n - n* ) = 1/2 ( 6 - 2 ) = 2
Si on ajoute un électron pour former C2- l'électron
supplémentaire se placera sur le premier niveau vacant (non complètement
occupé) c'est à dire ici s2.
L'ajout d'un électron sur un niveau
liant stabilise la molécule, cela se traduit par une augmentation de l'énergie de dissociation et à une
diminution de la longueur de la liaison. On peut vérifier cela en calculant
l'indice de liaison dans C2-.
nl = 1/2( n - n*) = 1/2 ( 7 - 2 ) = 2,5
Si on enlève un électron pour former C2+ l'électron
partant sera celui de plus haute
énergie c'est à dire situé sur le dernier niveau occupé, ici p1( ou p2 ) .
Le départ d'un électron sur un niveau
liant déstabilise la molécule, cela se traduit par une diminution de l'énergie de dissociation et à une
augmentation de la longueur de la liaison. On peut vérifier cela en calculant
l'indice de liaison dans C2+.
nl = 1/2( n - n*) = 1/2 ( 5 - 2 ) = 1,5
Finalement on retrouve bien l'ordre des longueurs de liaison : d C2+ > d C2 > d C2-
e) Par le même
raisonnement on trouve que l'ordre croissant de stabilité est :
O2- < O2 < O2+
Plus une molécule est stable et plus
son énergie de dissociation D est élevée donc :
D O2-
< D O2 <
D O2+
2) Molécule CO
:
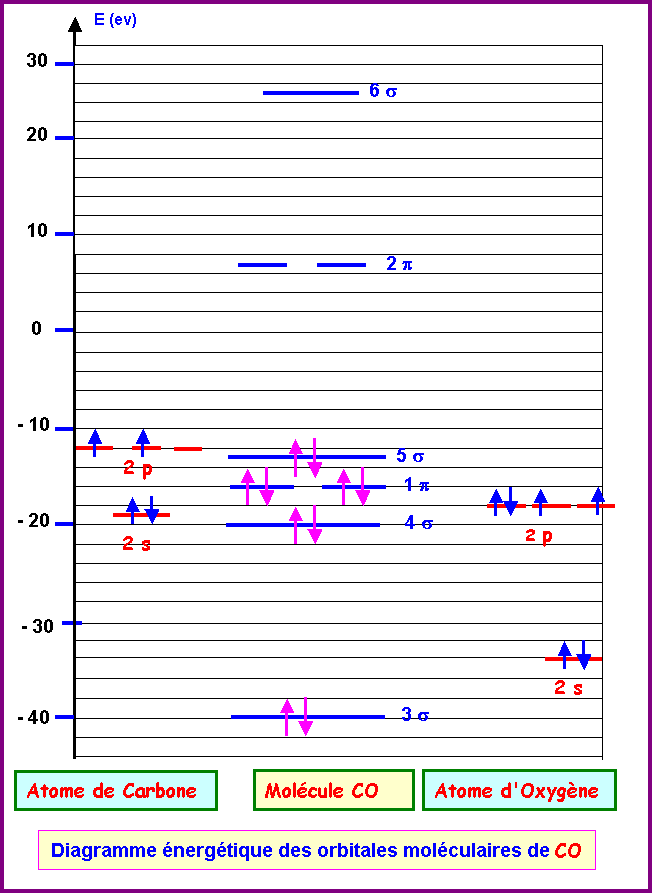
Attribution des
caractères liant ou anti-liant aux diverses orbitales moléculaires :
Le modèle qualitatif décrit dans le cours
pour les molécules homo-nucléaires est un peu trop simpliste pour pouvoir
décrire correctement toutes les molécules. Des calculs très complexes sont en
réalité nécessaires pour cela. Nous n'aborderons pas ici de tels calculs, nous
allons tout de même voir "qualitativement" dans ce cas les
modifications qu'on peut y apporter.
On reconnaît le schéma typique d'une
molécule avec interactions sp par l'ordre d'apparition des diverses orbitales
moléculaires:
3s - 4s - 1p - 5s
- 2p - 6s
A priori on doit donc avoir les
caractères suivants :
3 s: orbitale
liante (contient 2 électrons)
4s : orbitale
anti-liante (contient 2 électrons)
1p : orbitale
liante (contient 4 électrons)
5s : orbitale
liante (contient 2 électrons)
2p : orbitale
anti-liante (contient 0 électrons)
6s : orbitale
anti-liante (contient 0 électrons)
S'il en est ainsi l'indice de liaison
de CO est de :
nl = 1/2( n - n*) = 1/2 ( 8 - 2 ) = 3
Le dernier niveau occupé 5s est un niveau liant et si on arrache un électron pour former
CO+ on
déstabilise la molécule, l'indice de liaison diminue et la longueur de liaison
devrait donc augmenter.
Pour CO+ : nl = 1/2( n - n*) = 1/2 ( 7 - 2 ) = 2,5
En fait, la longueur de liaison reste
pratiquement inchangée. Cela s'explique par le fait que les orbitales
moléculaires ne sont pas toujours franchement liantes (ou anti-liantes). Si
leur énergie est très proche des énergies des orbitales atomiques, la
stabilisation (ou la déstabilisation) sont en pratique très faibles.
Ainsi, l'orbitale 5s n'est en réalité que très faiblement liante, le fait
d'enlever un électron de cette orbitale ne va donc que très peu déstabiliser la
molécule et la longueur de liaison ne va en fait que très faiblement varier.
Exercice 7 :
Décrire la géométrie, l'état d’hybridation
des atomes et les liaisons dans les molécules suivantes :
HCN, BeH2 , PCl3, H2O , CO2 , CO32- , acide
fulminique CNOH
HCN
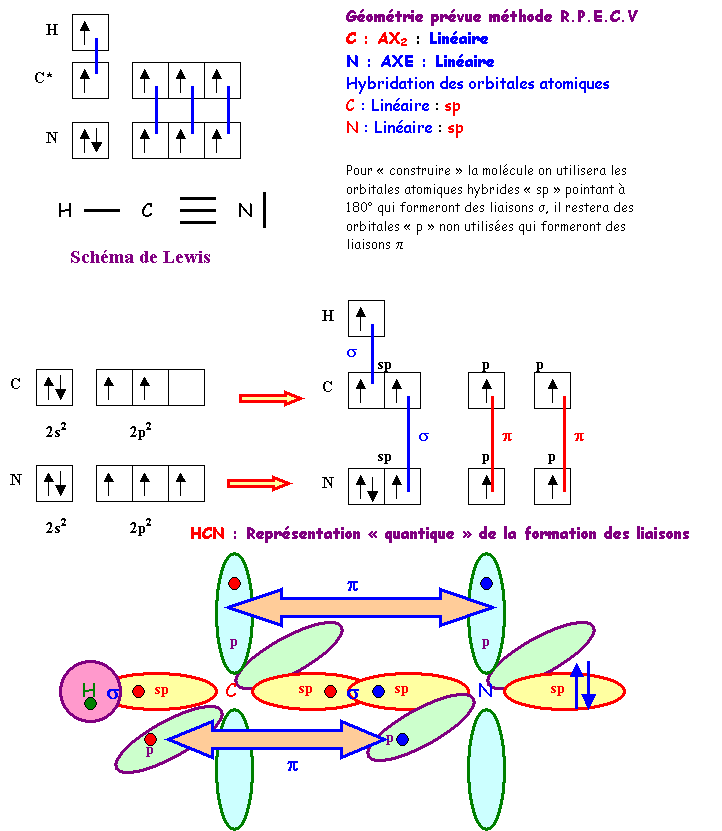
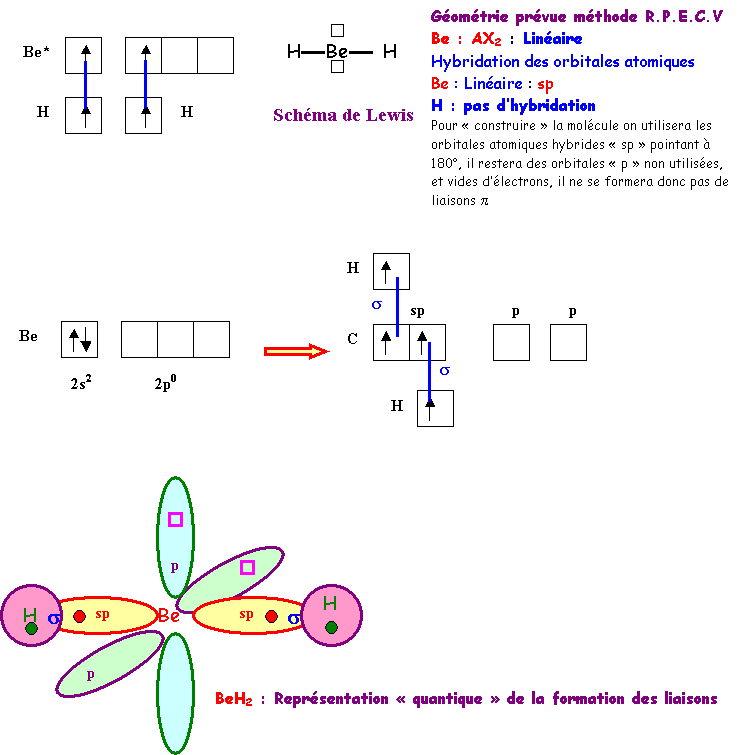 BeH2
BeH2
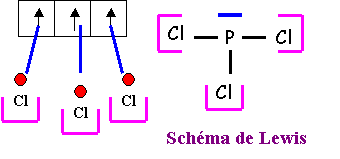
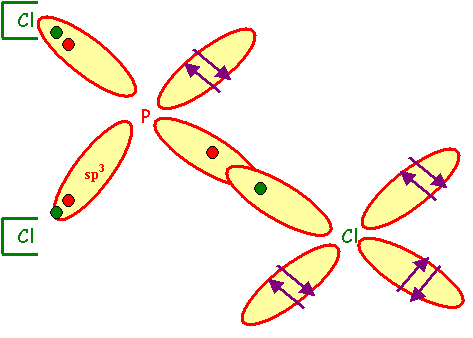
PCl3
Pour simplifier on ne va
représenter ici que l’atome central P et un seul Cl.
P :
AX3E :
tétraèdre Hybridation
des orbitales atomiques P : Tétraèdre : sp3 Cl :
AXE3 : Tétraèdre :
sp3 Pour « construire » la molécule on utilisera
les 4 orbitales atomiques hybrides « sp3 » pointant à
109°, il ne restera pas d’orbitales « p » non utilisées, il ne se
formera donc pas de liaisons p. P
Géométrie prévue méthode
R.P.E.C.V
![]()
![]()
![]()
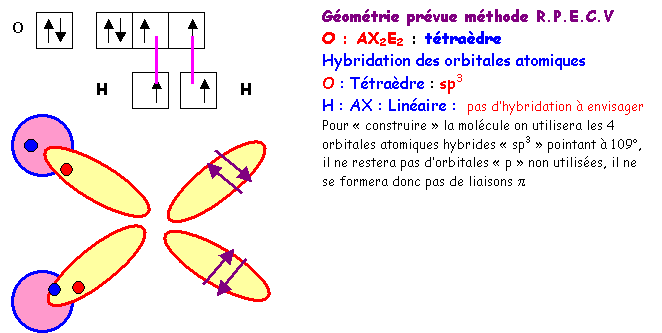 H2O
H2O
CO2
:
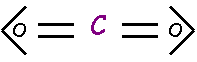
|
Atome |
O |
= C = |
O |
|
Géométrie |
AXE2 |
AX2 |
AXE2 |
|
Hybridation |
sp2 |
sp |
sp2 |
Les deux doubles liaisons sur le même
atome de Carbone imposent deux parties planes contenues dans deux plans
perpendiculaires entre eux.
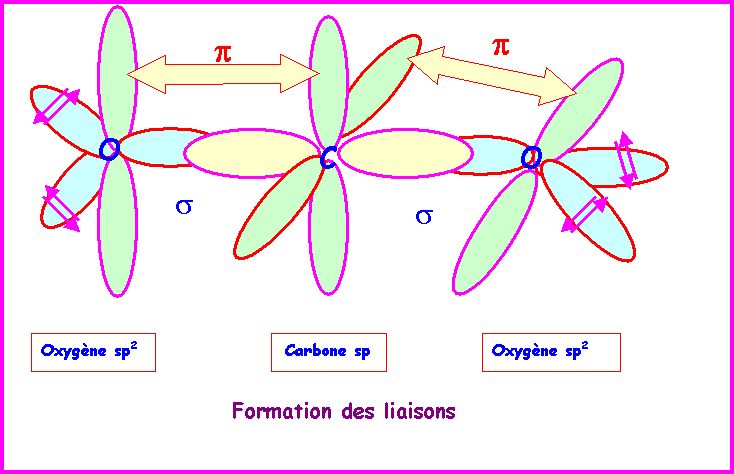
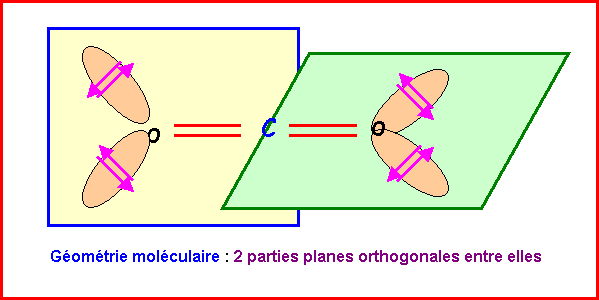
Remarque :
Ici, la molécule est simplement linéaire, les doublets libres de O
n’interviennent en fait pas dans sa géométrie. Mais il existe des composés
nommés Allènes de type CH2 =
C = CH2 qui présentent le même type de géométrie et d’hybridation sp2/sp/sp2
Ces composés présentent bien deux parties planes et dans des plans
perpendiculaires entre eux.
CO32-
Cet ion moléculaire présente le phénomène de mésomérie et le
modèle de Lewis ne permet pas de le décrire correctement. Si on s’en tient à la
forme mésomère principale, les trois oxygène jouent des rôles différents. Cela
n’est pas satisfaisant, les trois oxygènes doivent être équivalents entre eux.
On doit donc faire appel à l’hybride de résonance pour décrire correctement la
molécule.
Le problème est donc complexe. Nous considérerons que l’hybride
de résonance est très proches d’une forme pour laquelle les trois atomes
d’oxygène sont entourés de deux doublets et forment donc une double liaison
avec C. Leur état d’hybridation est alors sp2 correspondant à une
géométrie AXE2. Le Carbone faisant alors six liaisons, il est clair
que cette description n’est pas correcte. Mais elle permet néanmoins de
comprendre le phénomène de mésomérie et la délocalisation des électrons de la
molécules sur les quatre atomes conjugués. La description exacte de ce type de
molécule est inabordable à notre niveau élémentaire et nous nous contenteront
de cette description simpliste qui permet de comprendre simplement les choses.
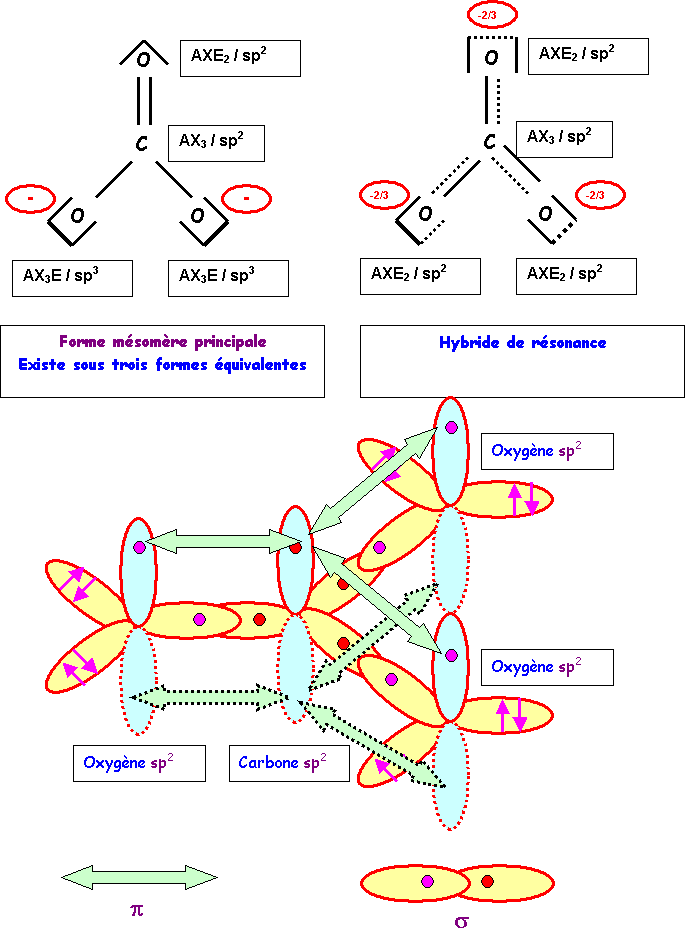
On voit que toutes les orbitales p peuvent se recouvrir pour
former des liaison p.
Il y a délocalisation des électrons p, c’est le phénomène de
mésomérie. Voir le cours.
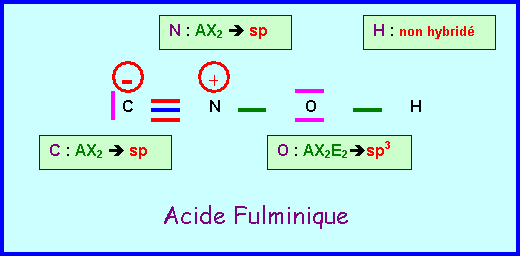
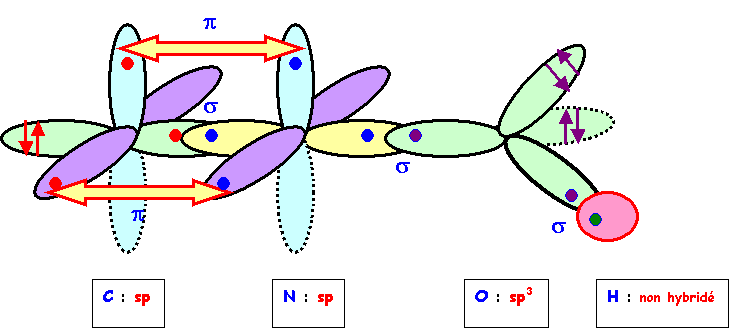
acide fulminique CNOH