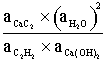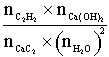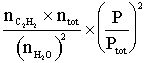http://www.chimie-briere.com
THERMODYNAMIQUE
DrH° et DrS°sont
indépendantes de la température.
R = 8,31 J.K-1.mol-1
On négligera le volume des solides et des
liquides devant celui des gaz.
On négligera la pression de vapeur saturante
de l'eau
|
|
CaC2 (s) |
H2O (l) |
CaO (s) |
C (s) |
CO (g) |
C2H2 (g) |
Ca(OH)2 (s) |
|
DfH°298
/ kJ.mol-1 |
-62,7 |
-187,8 |
-634,9 |
0 |
-110,4 |
? |
-986,1 |
|
S°/ J.K-1.mol-1 |
70,2 |
69,9 |
39,7 |
5,7 |
197,8 |
200,6 |
76,1 |
|
Elément |
Ca |
C |
O |
H |
|
Masse molaire |
40,1 |
12,0 |
16,0 |
1,0 |
|
Composé |
CO2 (g) |
H2O (g) |
|
Cp°/ J.K-1.mol-1 |
37,1 |
33,6 |
Le carbure de calcium est préparé par réaction du Coke sur la chaux vive suivant la réaction :
![]()
![]()
Question 1. Pour la réaction (1), ![]() (0,5 point)
(0,5 point)
|
réponse A |
réponse B |
réponse C |
réponse D |
réponse E |
|
+ 4 |
+1 |
0 |
–1 |
- 4 |
Question 2 Pour la réaction
(1), ![]() (1 point)
(1 point)
|
réponse.A |
réponse.B |
réponse.C |
réponse.D |
réponse.E |
|
211,2 J.mol-1.K-1 |
-128 ,2 J.mol1.K-1 |
–211,2 J.mol-1.K-1 |
101,2 J.mol-1.K-1 |
221,2 mol-1.K-1 |
Question 3. Pour la réaction (1), ![]() (1 point)
(1 point)
|
réponse.A |
réponse.B |
réponse.C |
réponse.D |
réponse.E |
|
+ 398,9 J.mol-1 |
+ 395,9 kJ.mol-1 |
+ 39,9 kJ.mol-1 |
+ 95,9 kJ.mol-1 |
+ 398,9 kJ.mol-1 |
Question 4. Choisir la bonne réponse. (1,0 points)
(A) Une augmentation de température, à pression constante, déplacerait l’équilibre (1) dans le sens indirect
(B) Une augmentation de pression, à température constante, déplacerait l’équilibre (1) dans le sens direct
(C) L’ajout d’un gaz inerte, à température et pression constantes, déplacerait l’équilibre (1) dans le sens direct.
(D) L’ajout d’un gaz inerte, à température et volume constants, déplacerait l’équilibre (1) dans le sens indirect.
(E) L’ajout d’un gaz inerte, à température et volume constants, déplacerait l’équilibre (1) dans le sens direct.
En spéléologie, le carbure de calcium sert à fabriquer l'acétylène C2H2 (g) par réaction totale avec l’eau (2).
![]()
Question 5. Pour la réaction (2), l’expression de ![]() est (0,5 point)
est (0,5 point)
|
réponse A |
réponse B |
réponse C |
réponse D |
réponse E |
|
|
|
|
|
|
Question 6. Pour la réaction (2), la variance vaut (0,5 point)
|
réponse A |
réponse B |
réponse C |
réponse D |
réponse E |
|
0 |
1 |
2 |
3 |
4 |
Le réservoir d’un spéléologue contient 320 g de carbure de calcium.
Question 7. Quelle est la masse d’eau (minimale) que le spéléologue doit utiliser pour que tout le carbure de calcium réagisse ? (1 point)
|
réponse A |
réponse B |
réponse C |
réponse D |
réponse E |
|
251,1 g |
325,6 g |
168,9 g |
179,8 g |
147,3 g |
Question 8 . Quel volume d’acétylène, mesuré dans les conditions normales de température et de pression (P = 1 atm ; T = 0°C) peut-on former à partir des 320 g de carbure de calcium ? (1 point)
|
réponse A |
réponse B |
réponse C |
réponse D |
réponse E |
|
112 L |
112 m3 |
212 L |
212 m3 |
56 m3 |
Question 9. Calculer l'enthalpie de référence de formation de C2H2
(g) : ![]() sachant que DrH°2,298 = –
321,3 kJ.mol-1 (1 point)
sachant que DrH°2,298 = –
321,3 kJ.mol-1 (1 point)
|
réponse A |
réponse B |
réponse C |
réponse D |
réponse E |
|
+ 226,5 kJ.mol-1 |
– 256,7 kJ.mol-1 |
+ 256,7 kJ.mol-1 |
- 226,5 kJ.mol-1 |
+ 56,3 kJ.mol-1 |
L’acétylène fabriqué par réaction du carbure de calcium avec l’eau est enflammé au niveau du casque du spéléologue par une étincelle.
![]()
![]()
Question 10 : Calculer la quantité de chaleur mise en jeu lors de la réaction de combustion de 1 mol d’acétylène avec 2,5 mol de dioxygène sous pression constante. (0,5 point)
|
réponse A |
réponse B |
réponse C |
réponse D |
réponse E |
|
– 230,9 kJ |
– 256,7 kJ.mol-1 |
+ 256,7 kJ.mol-1 |
+ 226,7 kJ.mol-1 |
+ 556,3 kJ.mol-1 |
Question 11 : L’énergie dégagée par la réaction de combustion sert à chauffer les produits formés par la réaction, d’une température TI = 298 K jusqu’à une température TF (température de flamme ou finale). Calculer TF. (on supposera que l’énergie dégagée par la réaction de combustion est entièrement transférée aux produits). (2,0 points)
|
réponse A |
réponse B |
réponse C |
réponse D |
réponse E |
|
2440 K |
244 K |
3450 K |
1580 K |
1220 K |
ATOMES ET MOLECULES
Effets d’écran de Slater
|
1s |
0,3 |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
2s 2p |
0,85 |
0,35 |
|
|
|
|
|
|
|
|
|
|||||||||
|
3s 3p |
1 |
0,85 |
0,35 |
|
|
|
|
|
|
|
|
|||||||||
|
3d |
1 |
1 |
1 |
0,35 |
|
|
|
|
|
|
|
|||||||||
|
4s 4p |
1 |
1 |
0,85 |
0,85 |
0,35 |
|
|
|
|
|
|
|||||||||
|
4d |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|
|
|
|
|||||||||
|
4f |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|
|
|
|||||||||
|
5s 5p |
1 |
1 |
1 |
1 |
0,85 |
0,85 |
0,85 |
0,35 |
|
|
|
|||||||||
|
5d |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|
|||||||||
|
5f |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|||||||||
|
6s 6p |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,85 |
0,85 |
0,85 |
0,35 |
|||||||||
|
|
1s |
2s 2p |
3s 3p |
3d |
4s 4p |
4d |
4f |
5s 5p |
5d |
5f |
6s 6p |
|||||||||
Question 12 : (0,5 point)
Soit la configuration électronique suivante : (Ar) 3d10 4s2 4p3
Quelle est l'affirmation exacte ?
Proposition A : Il s'agit d’un chalcogène.
Proposition B : Il s'agit de l'atome neutre de Germanium Ge
Proposition C : Il peut s'agir de l'ion Se2+
Proposition D : Il s'agit de l'ion Se-
Proposition E : Il s'agit de l'atome neutre d'arsenic As
Question 13 : La charge nucléaire effective Z* ressentie par un électron de la couche de valence de l'atome neutre de calcium Ca est de : (1 point)
Proposition A : Z*= 1,75
Proposition B : Z*= 2,85
Proposition C : Z*= 3,65
Proposition D : Z*= 4,3
Proposition E : Z*= 5,85
Question 14 : (0,5 point)
Quelle est l'affirmation exacte ?
Proposition A : Le rayon atomique et l'affinité électronique varient dans le même sens.
Proposition B : Le rayon atomique et l'électronégativité varient dans le même sens.
Proposition C : L'énergie de quatrième ionisation d'un élément A correspond à l'énergie de la réaction A2+ (g) = A3+ (g) + 1 e-(g)
Proposition D : La charge nucléaire effective Z* augmente de gauche à droite sur une ligne de la classification périodique.
Proposition E : Le rayon d'un cation A+ est toujours plus élevé que le rayon de covalence de son atome neutre d'origine A.
L'Aluminium Al a une
masse molaire atomique de 26,98 g.mol-1, cet élément ne possède
qu'un seul isotope stable.
Question 15 :
Quelle est l'affirmation exacte? (0,5 point)
Proposition A : L'isotope 28Al est un émetteur radioactif de type b+.
Proposition B : L'isotope 29Al est l'isotope stable de l'aluminium.
Proposition C : L'isotope 26Al est un émetteur en modulation de fréquence.
Proposition D : L'isotope stable de l'aluminium possède 15 protons dans son noyau.
Proposition E : L'isotope stable de l'aluminium possède 14 neutrons dans son noyau.
Question 16 :
L’énergie de troisième ionisation de
l’aluminium est de : (2 points)
Proposition A : 5 eV
Proposition B : 11 eV
Proposition C : 28 eV
Proposition D : 136 eV
Proposition E : 958 eV
Question 17 : Quelle est l’affirmation exacte ? (0,5 point)
Proposition A : L’aluminium est un alcalinoterreux
Proposition B : L’ion le plus stable de l’aluminium est Al2+.
Proposition C :
L’aluminium est un élément de transition.
Proposition D : Dans son état fondamental l’atome d’aluminium possède trois électrons célibataires.
Proposition E : L’ion Al3+ possède la structure électronique d’un gaz rare.
Question 18 :
Quelle est l’affirmation exacte ? (0,5 point)
Proposition A : L’aluminium est un atome plus électronégatif que le gallium Ga.
Proposition B : Le rayon atomique de l’aluminium est plus important que celui du soufre S.
Proposition C : Le rayon atomique de l’aluminium est plus important que celui du gallium Ga.
Proposition D : L’aluminium est un atome plus électronégatif que le bore B.
Proposition E : L’aluminium et le soufre forment un composé ionique de formule Al3S2
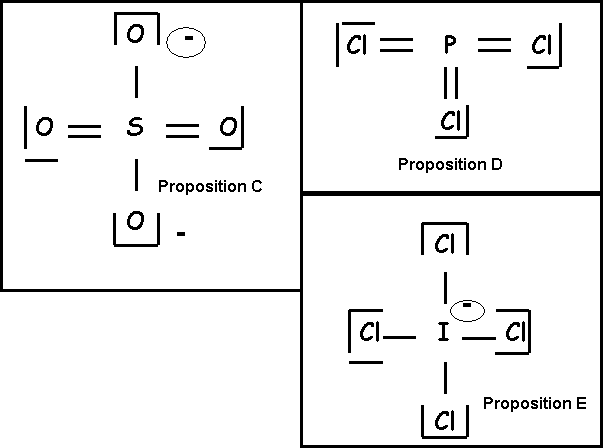
Soient les molécules ou ions suivants : AlCl3 SO42- ICl4- H3O+ PCl3
Question 19 : (1 point)
Parmi les schémas de Lewis suivants quel est le seul correctement écrit :
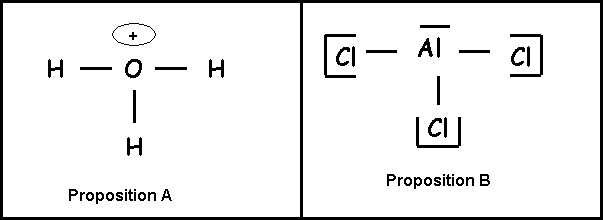
Question 20 : (0,5 point)
Quelle est l’affirmation exacte
Proposition A : PCl3 possède une géométrie de type AX3
Proposition B : H3O+ possède une géométrie de type AX3
Proposition C : AlCl3 possède une géométrie de type AX3
Proposition D : ICl4- possède une géométrie de type AX4
Proposition E : SO42- possède une géométrie de type AX4E2
Question 21 : (0,5 point)
Quelle est l’affirmation exacte
Proposition A : Dans PCl3 l’atome de phosphore porte une charge formelle positive
Proposition B : Dans H3O+ l’atome d’oxygène est hybridé sp2
Proposition C : Dans AlCl3 les angles ClAlCl valent approximativement 109°.
Proposition D : Dans ICl4- l’atome d’iode possède 2 doublets libres
Proposition E : Dans SO42- l’atome de soufre possède un doublet libre
Molécule
CN
Modèle de Lewis
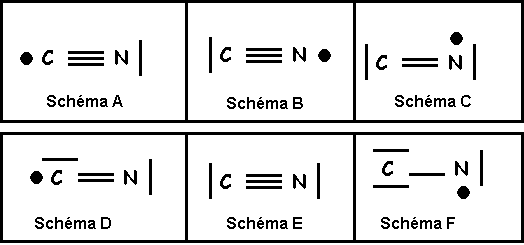
Question 22 : Quelle est l’affirmation exacte ? (0,5 point)
Proposition A : Le schéma E est une représentation possible de CN.
Proposition B : Le schéma F est une représentation possible de CN.
Proposition C : CN est intermédiaire entre les représentations B et C
Proposition D : CN est intermédiaire entre les représentations A et C
Proposition A : CN est intermédiaire entre les représentations D et E
Modèle C.L.O.A-O.M :
Combinaison Linéaire d’Orbitales Atomiques
- Orbitales Moléculaires
Question 23 : Dans le modèle C.L.O.A-O.M, l’indice de liaison pour CN est de : (1,5 point)
Proposition A : 1
Proposition B : 1,5
Proposition C : 2
Proposition D : 2,5
Proposition E : 3
Question 24 : Le modèle C.L.O.A-O.M, prévoit que : (0,5 point)
Proposition A : Dans l’anion CN- la longueur de liaison est plus élevée que dans CN.
Proposition B : Dans le cation CN+ la longueur de liaison est plus élevée que dans CN.
Proposition C : Le cation CN+ est plus stable que CN.
Proposition D : L’anion CN- est moins stable que CN.
Proposition E : Dans CN les électrons peuvent facilement se transformer en isotopes radioactifs.
http://www.chimie-briere.com