L1-S1 – CHIM 110 – Session
Décembre 2005
ATOMES
ET MOLECULES : CORRIGE
Quelques valeurs de
constantes :
Energie
d’ionisation de l’Hydrogène : E0 = 13,6 eV = 2,18 10-18
J
Constante de Planck : h =
6,62 10-34 J s
Charge de l’électron : e =
1,6 10-19 C
Masse de l'électron : me
= 9,1 10-31 kg
Nombre d’Avogadro : N =
6,022 1023 mol-1
Célérité de la lumière dans le
vide : C = 3 108 m s-1
Masse du proton : mp =
1,6725 10-27 kg = 1,00718 u.m.a
Masse du neutron : mn =
1,6747 10-27 kg = 1,00850 u.m.a
Constante de
Rydberg : RH = 1,096 107 m-1
Effets d’écran de Slater
|
1s |
0,3 |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
2s 2p |
0,85 |
0,35 |
|
|
|
|
|
|
|
|
|
|||||||||
|
3s 3p |
1 |
0,85 |
0,35 |
|
|
|
|
|
|
|
|
|||||||||
|
3d |
1 |
1 |
1 |
0,35 |
|
|
|
|
|
|
|
|||||||||
|
4s 4p |
1 |
1 |
0,85 |
0,85 |
0,35 |
|
|
|
|
|
|
|||||||||
|
4d |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|
|
|
|
|||||||||
|
4f |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|
|
|
|||||||||
|
5s 5p |
1 |
1 |
1 |
1 |
0,85 |
0,85 |
0,85 |
0,35 |
|
|
|
|||||||||
|
5d |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|
|||||||||
|
5f |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|||||||||
|
6s 6p |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,85 |
0,85 |
0,85 |
0,35 |
|||||||||
|
|
1s |
2s 2p |
3s 3p |
3d |
4s 4p |
4d |
4f |
5s 5p |
5d |
5f |
6s 6p |
|||||||||
Question 12 : (0,5 point)
Soit la configuration électronique suivante : (Ar) 3d10 4s2 4p3
Quelle est l'affirmation exacte ?
Proposition A : Il s'agit d’un chalcogène.
Proposition B : Il s'agit de l'atome neutre de Germanium Ge
Proposition C : Il peut s'agir de l'ion Se2+
Proposition D : Il s'agit de l'ion Se-
Proposition E : Il s'agit de l'atome neutre d'arsenic As
(Ar) 3d10 4s2 4p3 è Colonne 15
Les chalcogènes sont en colonne 16: s2 p4
Le Germanium est en colonne 14 : 4s2 4p2
Le Sélénium Se est en colonne 16 s2 p4 et Se2+ est en 4s2 4p2
Le Sélénium Se est en colonne 16 s2 p4 et Se- est en 4s2 4p5
L’arsenic As est en colonne 14 : 4s2 4p3
Proposition E : Il s'agit de l'atome neutre d'arsenic As
Question 13 : La charge nucléaire effective Z* ressentie par un électron de la couche de valence de l'atome neutre de calcium Ca est de : (1 point)
Proposition A : Z*= 1,75
Proposition B : Z*= 2,85
Proposition C : Z*= 3,65
Proposition D : Z*= 4,3
Proposition E : Z*= 5,85
Z* = Z - S s
Ca : Z = 20 : 1s2 2s2 2p6 3s2
3p6 4s2
Z* = 20 – 0,35 – 8 * 0,85 – 10 * 1 = 2,85
Proposition B : Z*= 2,85
Question 14 : (0,5 point)
Quelle est l'affirmation exacte ?
Proposition A : Le rayon atomique et l'affinité électronique varient dans le même sens.
Proposition B : Le rayon atomique et l'électronégativité varient dans le même sens.
Proposition C : L'énergie de quatrième ionisation d'un élément A correspond à l'énergie de la réaction A2+ (g) = A3+ (g) + 1 e-(g)
Proposition
D : La charge nucléaire
effective Z* augmente de gauche à droite sur une ligne de la classification
périodique.
Proposition E : Le rayon d'un cation A+ est toujours plus élevé que le rayon de covalence de son atome neutre d'origine A.
Z* = Z - S s
Quand on passe d’un élément au suivant, on ajoute un proton et un électron (généralement dans le même groupe de Slater).
Quand on passe d’un élément au suivant, Z augmente d’une unité et s augmente de 0,35.
Z* augmente donc de 1 – 0,35 = 0,65.
Proposition
D : La charge
nucléaire effective Z* augmente de gauche à droite sur une ligne de la
classification périodique.
Un atome « gros » à ses électrons « loin » du noyau, il les attire donc « peu » et est « peu électronégatif ». Son affinité électronique est faible.
Un atome « petit » à ses électrons « près » du noyau, il les attire donc « fortement » et est « fortement électronégatif». Son affinité électronique est forte.
Le rayon atomique et l’affinité électronique varient donc en sens inverse.
Le rayon atomique et l’électronégativité varient donc en sens inverse.
L’énergie de quatrième ionisation est l'énergie de la réaction A3+ (g) = A4+ (g) + 1 e-(g)
Quand on passe de l’atome neutre a un cation on enlève un électron de valence, l’effet d’écran diminue et Z* augmente.
R varie comme n2/Z*, si n est constant comme Z* augmente, n2/Z* diminue et le rayon diminue. Si n varie il ne peut que diminuer et R diminue aussi
Le rayon d'un cation A+ est donc toujours plus petit que le rayon de covalence de son atome neutre d'origine A
L'Aluminium Al a une
masse molaire atomique de 26,98 g.mol-1, cet élément ne possède
qu'un seul isotope stable.
Question 15 :
Quelle est l'affirmation exacte? (0,5 point)
Proposition A : L'isotope 28Al est un émetteur radioactif de type b+.
Proposition B : L'isotope 29Al est l'isotope stable de l'aluminium.
Proposition C : L'isotope 26Al est un émetteur en modulation de fréquence.
Proposition D : L'isotope stable de l'aluminium possède 15 protons dans son noyau.
Proposition
E : L'isotope stable
de l'aluminium possède 14 neutrons dans son noyau.
La masse molaire d’un élément est sensiblement égale au nombre de masse de son isotope le plus stable si celui-ci est nettement majoritaire (cas général, sauf rares exceptions). Ici il n’ y a qu’un seul isotope stable et on ne peut donc pas hésiter.
A = Z + N
Ici M = 26,98 soit A = 27 , l’isotope stable est donc 27Al
Pour Al : Z=13 et donc N = 14.
28Al possède 15 neutrons, par rapport à l’isotope
stable il possède un excès de neutrons,
un neutron va donc se transformer en proton, il y aura éjection
d’électricité négative : b-
La proposition C est là pour amuser la galerie…
Proposition
E : L'isotope
stable de l'aluminium possède 14 neutrons dans son noyau.
Question 16 :
L’énergie de troisième ionisation de
l’aluminium est de : (2 points)
Proposition A : 5 eV
Proposition B : 11 eV
Proposition
C : 28 eV
Proposition D : 136 eV
Proposition E : 958 eV
Al : Z
= 13 : 1s2 2s2 2p6 3s2 3p1
Al+ :
Z = 13 : 1s2 2s2 2p6 3s2
Al2+ :
Z = 13 : 1s2 2s2 2p6 3s1
Al3+ :
Z = 13 : 1s2 2s2 2p6
Troisième ionisation : Al2+ =
Al3+ + e-
E.I.3 = E Al3+ - E Al2+
Al2+ : 1s2 2s2 2p6 3s1
Al3+ : 1s2 2s2 2p6
E Al2+ = 2
E1 + 8 E2
+ E3
E Al3+ = 2
E1 + 8 E2
E.I.3 = E Al3+ - E Al2+ = - E3
Calcul de E3 :
E = -E0
Z*2 / n2
Z* = 13 – 8*0.85 – 2 = 4,2
E3 =
-13,6 * 4,22 / 32 = -26,7 eV
E.I.3
= 26,7 eV
La valeur expérimentale est donc 28 eV avec un écart de 5% ce qui est très correct.
Proposition C : 28 eV
Question 17 : Quelle est l’affirmation exacte ? (0,5 point)
Proposition A : L’aluminium est un alcalinoterreux
Proposition B : L’ion le plus stable de l’aluminium est Al2+.
Proposition C :
L’aluminium est un élément de transition.
Proposition D : Dans son état fondamental l’atome d’aluminium possède trois électrons célibataires.
Proposition E : L’ion Al3+ possède la structure électronique d’un gaz
rare.
Situé
en colonne 13 l’aluminium n’est pas un alcalinoterreux (colonne 2).
L’ion
le plus stable de Al est Al3+ : 1s2
2s2 2p6 qui possède comme
les gaz rares une structure électronique à 8 électrons très stable.
Les éléments de transition
sont les élément des blocs d ou f. Al faisant partie du bloc p n’est donc pas
un élément de transition.
Al : Z = 13 : 1s2
2s2 2p6 3s2 3p1
possède un seul électron célibataire à l’état fondamental.
Proposition E : L’ion Al3+ possède la structure électronique d’un gaz
rare.
Question 18 :
Quelle est l’affirmation exacte ? (0,5 point)
Proposition
A : L’aluminium est un atome
plus électronégatif que le gallium Ga.
Proposition
B : Le rayon atomique de
l’aluminium est plus important que celui du soufre S.
Proposition C : Le rayon atomique de l’aluminium est plus important que celui du gallium Ga.
Proposition D : L’aluminium est un atome plus électronégatif que le bore B.
Proposition E : L’aluminium et le soufre forment un composé ionique de formule Al3S2
L’électronégativité varie en sens inverse du rayon atomique.
Le rayon atomique varie comme n2/Z*.
Sur une même ligne n est constant et Z* augmente de gauche à droite, n2/Z* diminue donc de gauche à droite, R diminue donc de gauche à droite et l’électronégativité augmente donc de gauche à droite.
Sur une colonne n2 augmente de haut en bas, Z* diminue très légèrement de haut en bas, l’effet de n2 l’emporte sur celui de Z* et le rayon atomique augmente donc de haut en bas alors que l’électronégativité diminue de haut en bas.
Al et Ga
sont dans la même colonne et Al est situé plus haut que Ga : XAl >
XGa et RAl < RGa
Al et S
sont dans la même ligne et S est situé plus à droite que Al : XS >
XAl et RAl > RS
D’après leur positions dans la classification pour obéir à la règle de l’octet on prévoit les ions stables de Al et S :
Al donne l’ion Al3+ ; S donne l’ion S2- : le composé ionique a pour formule Al2S3.
Remarque :
Ici, il y avait deux propositions exactes, cette question à donc été annulée
pour ne pas pénaliser ceux qui ne s’en seraient pas aperçu.
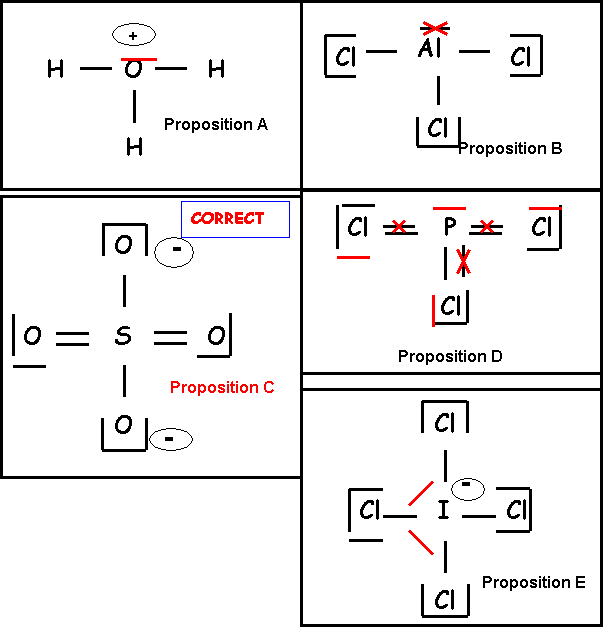
Soient les molécules ou ions suivants : AlCl3 SO42- ICl4- H3O+ PCl3
Question 19 : (1 point)
Parmi les schémas de Lewis suivants quel est le seul correctement écrit :
Question 20 : (0,5 point)
Quelle est l’affirmation exacte
Proposition A : PCl3 possède une géométrie de type AX3
Proposition B : H3O+ possède une géométrie de type AX3
Proposition C : AlCl3 possède une géométrie de type AX3
Proposition D : ICl4- possède une géométrie de type AX4
Proposition E : SO42- possède une géométrie de type AX4E2
PCl3 possède
une géométrie de type AX3E
H3O+ possède une géométrie de type AX3E
AlCl3 possède
une géométrie de type AX3
ICl4- possède une géométrie de type AX4E2
SO42- possède une géométrie de type AX4
Question 21 : (0,5 point)
Quelle est l’affirmation exacte
Proposition A : Dans PCl3 l’atome de phosphore porte une charge formelle positive
Proposition B : Dans H3O+ l’atome d’oxygène est hybridé sp2
Proposition C : Dans AlCl3 les angles ClAlCl valent approximativement 109°.
Proposition D : Dans ICl4-
l’atome d’iode possède 2 doublets libres
Proposition E : Dans SO42- l’atome de soufre possède un doublet libre
Dans PCl3 l’atome
de phosphore ne porte aucune charge formelle.
Dans H3O+ l’atome d’oxygène est hybridé sp3
Dans AlCl3 les
angles ClAlCl valent approximativement 120°.
Dans ICl4- l’atome d’iode possède 2 doublets libres
Dans SO42-
l’atome de soufre ne possède pas de doublet libre.
Molécule CN
Modèle de Lewis
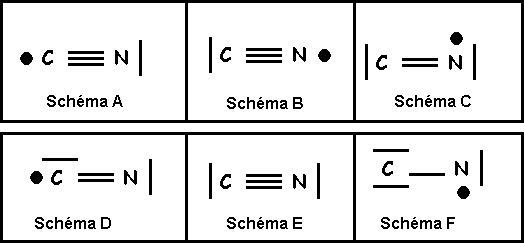
Question 22 : Quelle est l’affirmation exacte ? (0,5 point)
Proposition A : Le schéma E est une représentation possible de CN.
Proposition B : Le schéma F est une représentation possible de CN.
Proposition C : CN est intermédiaire entre les représentations B et C
Proposition D : CN est intermédiaire entre les représentations A et C
Proposition A : CN est intermédiaire entre les représentations D et E
C N
![]()
![]()
![]()
![]()
Méthode rapide :
1)
Si on considère C comme atome
central :
C = 4 electrons
N est supposé faire sont nombre
de liaison « normal », il fait donc trois liaisons et possède un
doublet libre.
C utilise donc trois électrons et
lui reste donc 1 électron célibataire.
Il n’apparaît aucune charges
formelles C et N possédant leur nombre « normal » d’électrons. On
obtient finalement le schéma A.

![]()
2)
Si on considère N comme atome
central :
N = 5 électrons
C est supposé faire sont nombre
de liaison « normal », il fait donc deux liaisons et possède un
doublet libre.
N utilise donc deux électrons et
lui reste donc 3 électrons, soit un doublet libre et un électron célibataire.
Il n’apparaît aucune charges
formelles C et N possédant leur nombre « normal » d’électrons. On
obtient finalement le schéma C.
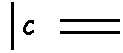

Tous les autres schémas proposés sont
de toute manière incorrects puisque les charges formelles portées par les
atomes n’y figurent pas.
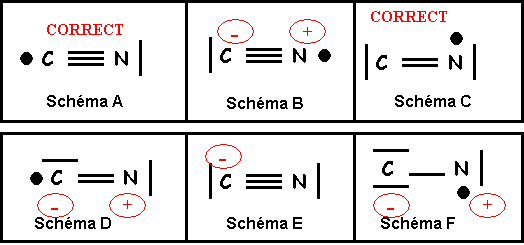
Proposition D : CN est intermédiaire entre les représentations A et C
Modèle C.L.O.A-O.M :
Combinaison Linéaire d’Orbitales Atomiques -
Orbitales Moléculaires
Question 23 : Dans le modèle C.L.O.A-O.M, l’indice de liaison pour CN est de : (1,5 point)
Proposition A : 1
Proposition B : 1,5
Proposition C : 2
Proposition D : 2,5
Proposition E : 3
nl =1/2 ( n – n*) = ( 7 – 2 ) / 2 = 2,5
Remarque : que CN soit ou non avec interaction sp ne change rien à l’indice de liaison.
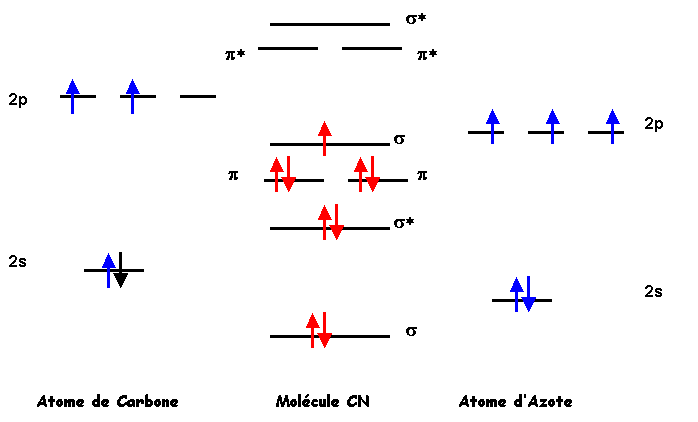
Question 24 : Le modèle C.L.O.A-O.M, prévoit que : (0,5 point)
Proposition A : Dans l’anion CN- la longueur de liaison est plus élevée que dans CN.
Proposition B : Dans le cation CN+ la longueur de liaison est plus élevée que dans CN.
Proposition C : Le cation CN+ est plus stable que CN.
Proposition D : L’anion CN- est moins stable que CN.
Proposition E : Dans CN les électrons peuvent facilement se transformer en isotopes radioactifs.
CN- : On ajoute un électron liant :
- L’indice de liaison augmente d’une ½ liaison.
- La longueur de liaison diminue.
- La molécule est stabilisée
Proposition A : Dans l’anion CN- la longueur de liaison est plus
élevée que dans CN. FAUSSE
Proposition D : L’anion CN- est moins stable que CN. FAUSSE
CN+ : On enlève un électron liant :
- L’indice de liaison diminue d’une ½ liaison.
- La longueur de liaison augmente.
- La molécule est déstabilisée
Proposition B : Dans le cation CN+ la longueur de liaison est plus
élevée que dans CN. VRAIE
Proposition C : Le cation CN+ est plus stable que CN. FAUSSE
Proposition
E : Dans CN les électrons
peuvent facilement se transformer en isotopes radioactifs. Evidemment FAUSSE