« ATOMES ET MOLECULES »
Numéros atomiques de quelques éléments
Carbone (C) : Z=6 Chlore (Cl) : Z=17 Fluor F : Z=9 Oxygène
(O) : Z=8 Phosphore (P) : Z=15
Silicium (Si) : Z=14
Soufre (S) : Z=16 Xénon (Xe) :
Z=86
Effets d’écran de Slater
|
1s |
0,3 |
|
|
|
|
|
|
|
|
|
|
||||||||
|
2s 2p |
0,85 |
0,35 |
|
|
|
|
|
|
|
|
|
||||||||
|
3s 3p |
1 |
0,85 |
0,35 |
|
|
|
|
|
|
|
|
||||||||
|
3d |
1 |
1 |
1 |
0,35 |
|
|
|
|
|
|
|
||||||||
|
4s 4p |
1 |
1 |
0,85 |
0,85 |
0,35 |
|
|
|
|
|
|
||||||||
|
4d |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|
|
|
|
||||||||
|
|
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|
|
|
||||||||
|
5s 5p |
1 |
1 |
1 |
1 |
0,85 |
0,85 |
0,85 |
0,35 |
|
|
|
||||||||
|
5d |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|
||||||||
|
|
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
||||||||
|
6s 6p |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,85 |
0,85 |
0,85 |
0,35 |
||||||||
|
|
1s |
2s 2p |
3s 3p |
3d |
4s 4p |
4d |
|
5s 5p |
5d |
|
6s 6p |
||||||||
Quelques valeurs de constantes :
Energie d’ionisation de l’Hydrogène : E0 = 13,6 eV = 2,18 10-18 J
Constante de Planck : h = 6,62 10-34 J.s
Charge de l’électron : e = 1,6 10-
Masse de l'électron : me = 9,1 10-
Nombre d’Avogadro : N = 6,022 1023 mol-1
Célérité de la lumière dans le vide : C =
Masse du proton : mp = 1,6725 10-
Masse du neutron : mn = 1,6747 10-
Constante de Rydberg : RH = 1,096 107 m-1
Soient les quatre
représentations spatiales de molécules suivantes
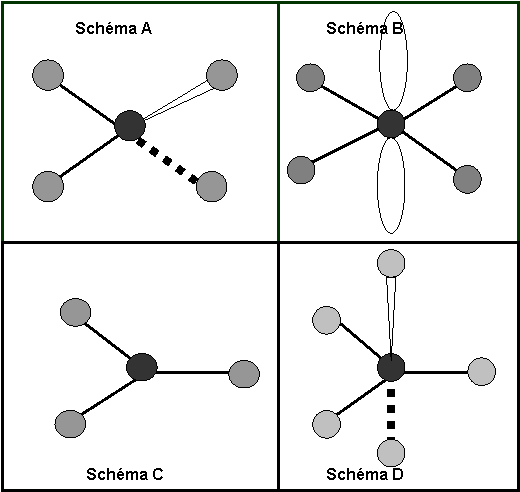

Question 1 : Quelle est l’affirmation fausse ? (1,5 point)
L’atome central est l’atome souligné.
Proposition A : Le schéma A correspond à la molécule SiF4
Proposition B : Le schéma B correspond à la molécule XeF4
Proposition C : Le schéma C correspond à l’ion moléculaire CO32-
Proposition D : Le schéma D correspond à la molécule PCl5
Proposition E : Le schéma B correspond à la molécule XeO4
Question 2 : Pour l’ion moléculaire CO32-,
quelle est l’affirmation exacte ? (1,5 point)
Proposition A : Il existe
deux sortes de liaisons CO, deux sont des simples liaisons et une est une double liaison.
Proposition B : Il
existe deux sortes de liaisons CO, deux sont des doubles liaisons et une est une simple liaison.
Proposition C : Les
trois liaisons CO sont toutes des
liaisons identiques, intermédiaires entre simples liaisons et doubles liaisons
Proposition D
: Les trois liaisons CO sont
toutes des liaisons identiques intermédiaires
entre doubles liaisons et triples liaisons
Proposition E : Les
trois liaisons CO sont toutes des doubles liaisons identiques
Question 3 : Quelle est l’affirmation exacte : (1,5 point)
Proposition A : Le
Phosphore P est plus électronégatif que le Chlore Cl.
Proposition B : Le Chlore
Cl est un atome plus gros que l’atome de Phosphore P.
Proposition C :
L’énergie de première ionisation du Chlore Cl est plus importante que celle du
Fluor F.
Proposition D
: L’atome de Silicium Si est un
atome plus gros que l’atome de Phosphore P.
Proposition E : Le
Silicium Si appartient à la colonne 16 de la classification périodique.
MOLECULE C2 :
Question 4 : (1 point)
On rappelle la formule qui
permet le calcul approché des rayons de covalence des atomes en A° (1 A°=10-
R(A°) = 0,215 n2/Z*
+ 0,148 n + 0,225
En appliquant cette formule
a l’atome de Carbone on trouve :
Proposition A : RC = 0,473 A°
Proposition B : RC = 0,573 A°
Proposition C : RC = 0,786 A°
Proposition D : RC = 0,873 A°
Proposition E : RC = 0,936 A°
Question 5 : (1 point)
On rappelle les formules qui
permettent le calcul approché à 0,05 A° près des longueurs de liaisons en A°
(On choisira celle que l’on préfère pour faire le calcul)
LAB(A°) = 1,11 (RA + RB) – 0,203
LAB(A°) = 0,239 (n2A /Z*A +
n2B /Z*B) + 0, 164*(nA + nB)
+ 0,297
Double = 0,86 * simple et
Triple = 0,78 * simple
En appliquant cette formule
aux liaisons Carbone/Carbone on trouve :
Proposition A : LCC simple = 1,33 A° LCC
double = 1,40 A° LCC triple = 1,55 A°
Proposition B : LCC simple = 1,62 A° LCC
double = 1,58 A° LCC triple = 1,32 A°
Proposition C : LCC simple = 1,88 A° LCC
double = 1,38 A° LCC triple = 1,25 A°
Proposition D : LCC simple = 1,54 A° LCC
double = 1,32 A° LCC triple = 1,20 A°
Proposition E : LCC simple = 1,92 A° LCC double
= 1,65 A° LCC triple = 1,50 A°
Molécule C2 : Cette molécule est diamagnétique et la longueur expérimentale de
la liaison CC est de 1,31 A° (1 A°=10-
Question 6 : D’après les résultats de la question
précédente la liaison CC dans la molécule C2 paraît être : (1 point)
Proposition A : Très proche de la simple liaison .
Proposition B : Intermédiaire entre CC simple et CC double.
Proposition C : Très proche de la double liaison.
Proposition D : Intermédiaire entre CC double et CC triple.
Proposition E : Très proche de la triple liaison.
Question 7 : Parmi les diagrammes
énergétiques des orbitales moléculaires proposés, lequel décrit correctement
l’état fondamental de la molécule C2 ? (1,5 point)
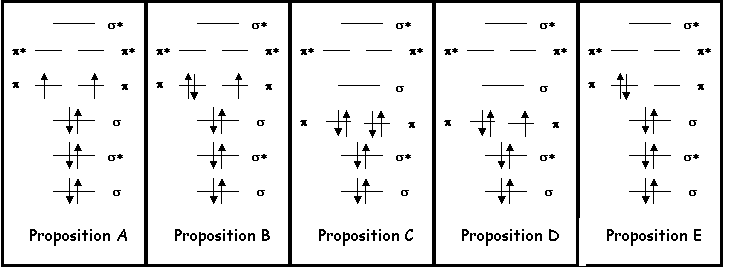
Voici quatre
autres représentations spatiales
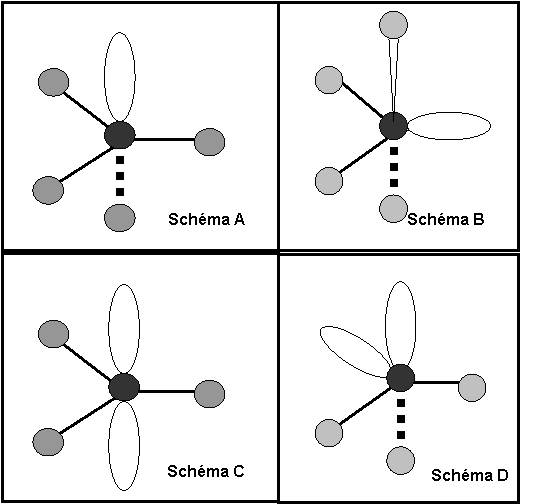

Question 8 :
Quelle est l’affirmation exacte ? (0,5
point)
Proposition A : Le schéma A correspond au type moléculaire AX4E
Proposition B : Le schéma B correspond au type moléculaire
AX4E
Proposition C : Le schéma C correspond au type moléculaire AX3E2
Proposition D : Le schéma C correspond au type moléculaire
AX2E3
Proposition E : Le schéma D correspond au type moléculaire AX3E2