L’ATOME DE CARBONE – Quelques rappels fondamentaux
L’atome de
carbone est l’atome fondamental des structures vivantes.
L’étude des
molécules complexes à base de carbone est l’objet de la chimie organique dont
nous allons étudier ici les bases fondamentales.
Historiquement le mot chimie
organique signifie chimie de la vie, on croyait en effet que seul les êtres
vivants pouvaient synthétiser de tels composés.
Les propriétés remarquables
du carbone qui en font la particularité sont directement liées à sa position
« centrale » dans la classification périodique.
Rappels sur le carbone :
Numéro
atomique : Z = 6
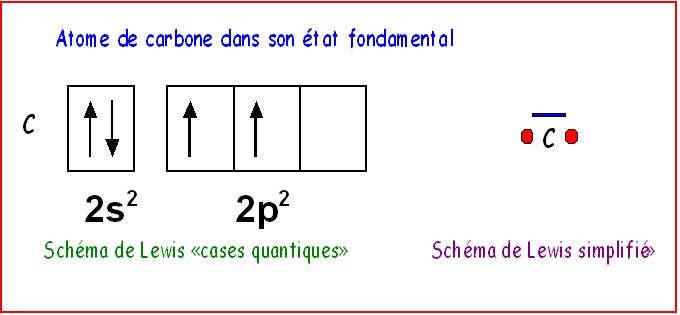
Configuration électronique :
1s2 2s2 2p2
Position dans la
classification périodique : Ligne 2 – Colonne 14
Schémas de Lewis :
Dans son état
fondamental, le carbone possède deux électrons célibataires et sa valence est
donc de deux.

Mais il est très généralement dans son état excité 2s1 2p3, il possède alors quatre électrons célibataires et sa valence est de quatre.
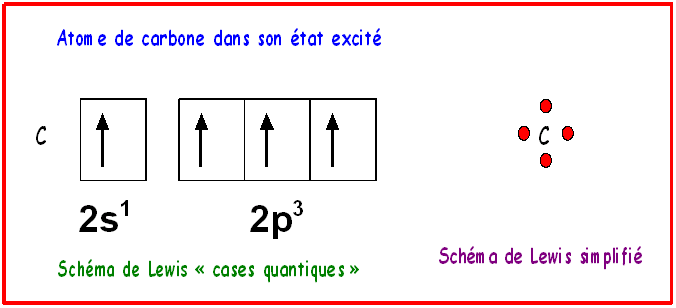
Dans la très grande majorité des cas qui vont nous intéresser ici, l’atome de carbone utilisera son état excité de valence 4.
Charge nucléaire effective de Slatter :
C : 1s2 2s2 2p2
Z*C = 6 – 3 * 0,35 – 2 * 0,85 = 3,25
Rayon atomique :
Le rayon atomique se calcule dans le modèle de Slatter par R = a0 n2/Z*
RC = 0,529 * 4 / 3,25 = 0,65 A°
Rayon de covalence :
Par
définition c’est moitié de la longueur de la simple liaison C-C. c’est une
grandeur expérimentale. Les tables donnent RC = 0,77
A°
On peut calculer approximativement sa valeur par la formule
empirique
R = 0,215 n2/Z* + 0,148 n + 0,225 = 0,215 * 4 / 3,25 +
0,148 * 2 + 0,225 = 0,786 A°
Soit un écart de 2% avec la valeur
tabulée.
De par sa position centrale, l’atome de carbone ne peut facilement
atteindre la structure d’un gaz rare par ionisation. Il lui faudrait pour cela
capter ou perdre 4 électrons pour donner les ions C4- ou
C4+. Un tel processus n’est pas très facile d’un point de vue
énergétique et ne se produit donc que très rarement.
Energies d’ionisation successives en eV :
|
E.I.1 |
E.I.2 |
E.I.3 |
E.I.4 |
E.I.5 |
E.I.6 |
|
11,3 |
24,4 |
47,9 |
64,5 |
392 |
489 |
Molécules organiques :
Une autre possibilité pour le carbone d’obéir à la règle de l’octet est
de former des liaisons de covalence avec d’autre atomes. La chimie du carbone
sera une chimie de covalence, les composés du carbone seront essentiellement des
composés moléculaires.
Le carbone va donc donner facilement des liaisons de
covalence avec énormément d’éléments différents.
En particulier, le carbone
peut très facilement se lier à lui même pour donner une liaison covalente C-C.
Il pourra ainsi se former de très longues chaînes très stables.
Cette
facilité et cette diversité des liaisons de covalence que peut donner le carbone
avec lui même et avec un grand nombre d’éléments chimiques différent est à
l’origine de l’infinie variété des molécules de la chimie
organique.
Longueur des liaisons
Les
diverses longueurs moyennes de liaisons sont données dans des tables.
On peut
aussi les estimer par la formule empirique :
LAB (A°) = 1,11
(RA + RB) – 0,203
RA et RB sont les rayons de covalence de A et B exprimés en A° et calculé par la formule précédente.
Pour les liaisons multiples on prendra 86 % pour la liaison double et 78% pour la liaison triple.
Valeurs estimées par la formule : (très proches des valeurs moyennes tabulées)
|
|
CC |
CH |
CO |
CN |
|
Simple |
1,56 |
1,05 |
1,43 |
1,48 |
|
Double |
1,34 |
|
1,23 |
1,30 |
|
Triple |
1,22 |
|
1,13 |
1,16 |
Valeurs moyennes des énergie des liaisons CX en kJ.mol-1
|
CH |
CC simple |
CC double |
CC triple |
CF simple |
|
415 |
347 |
611 |
837 |
490 |
|
CO simple |
CO double |
CN simple |
CN double |
CN triple |
|
350 |
728 |
290 |
615 |
891 |