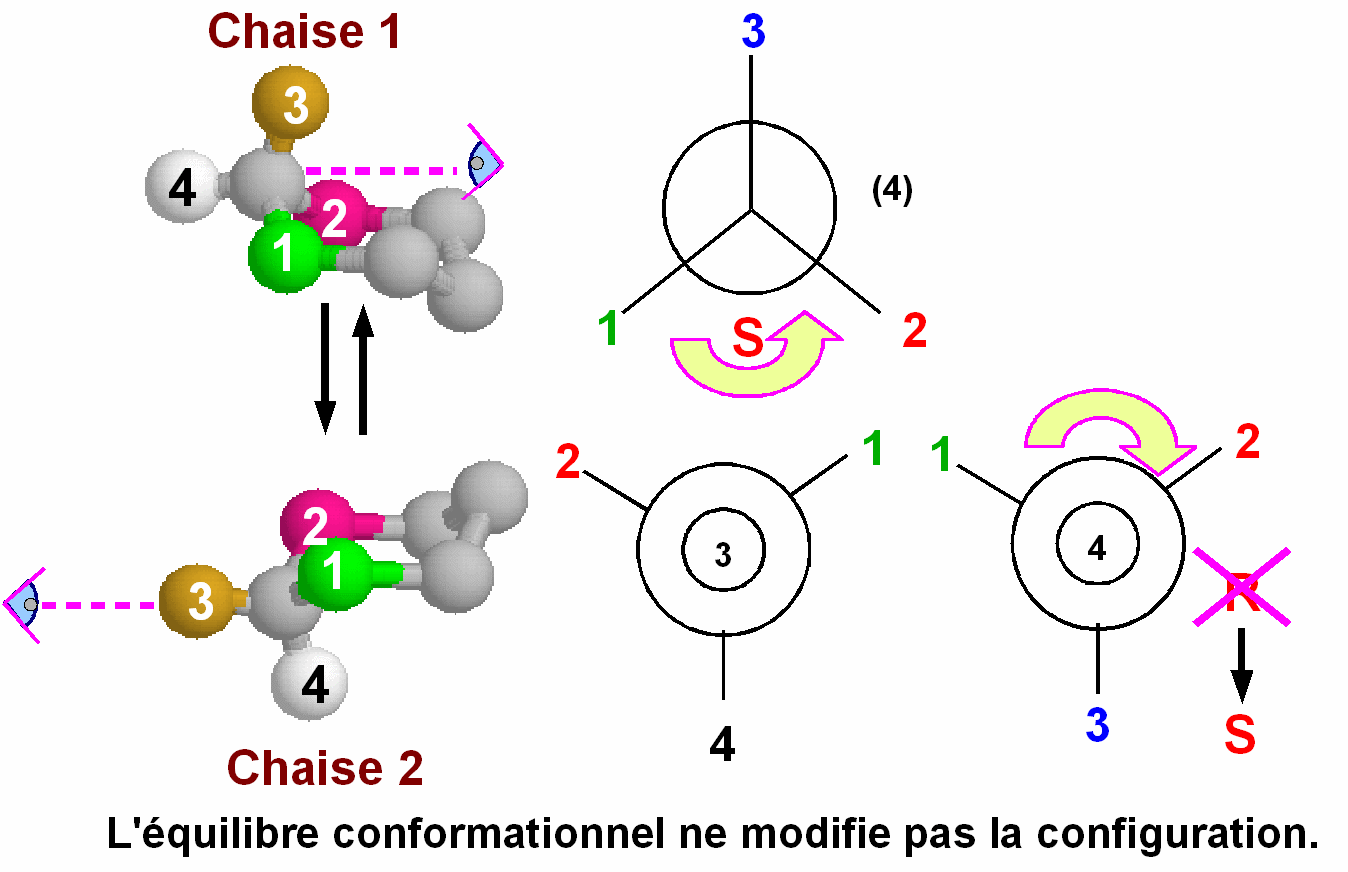
Lors
de l'étude des conformations du cyclohexane nous avions
signalé que l'inter conversion chaise / chaise ne modifiait
pas les configurations.
Nous allons maintenant le vérifier.
Voyons
ce qui se produit pour un carbone asymétrique :

Pour déterminer facilement
la configuration d'un carbone asymétrique à l'intérieur
d'un cycle, la méthode la plus simple consiste à se
placer à l'intérieur de celui-ci et à utiliser
la projection de Fischer.
Avec cette méthode, la
représentation simplifiée plane est suffisante pour
déterminer la configuration sans ambiguïté.
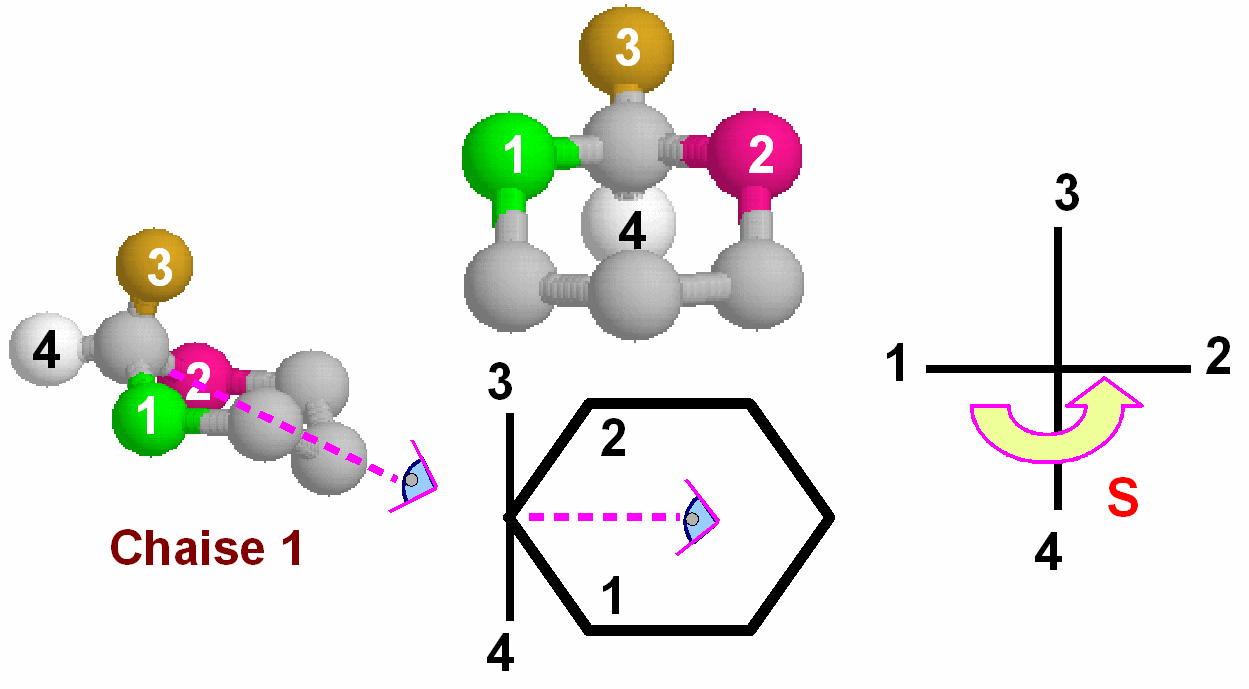
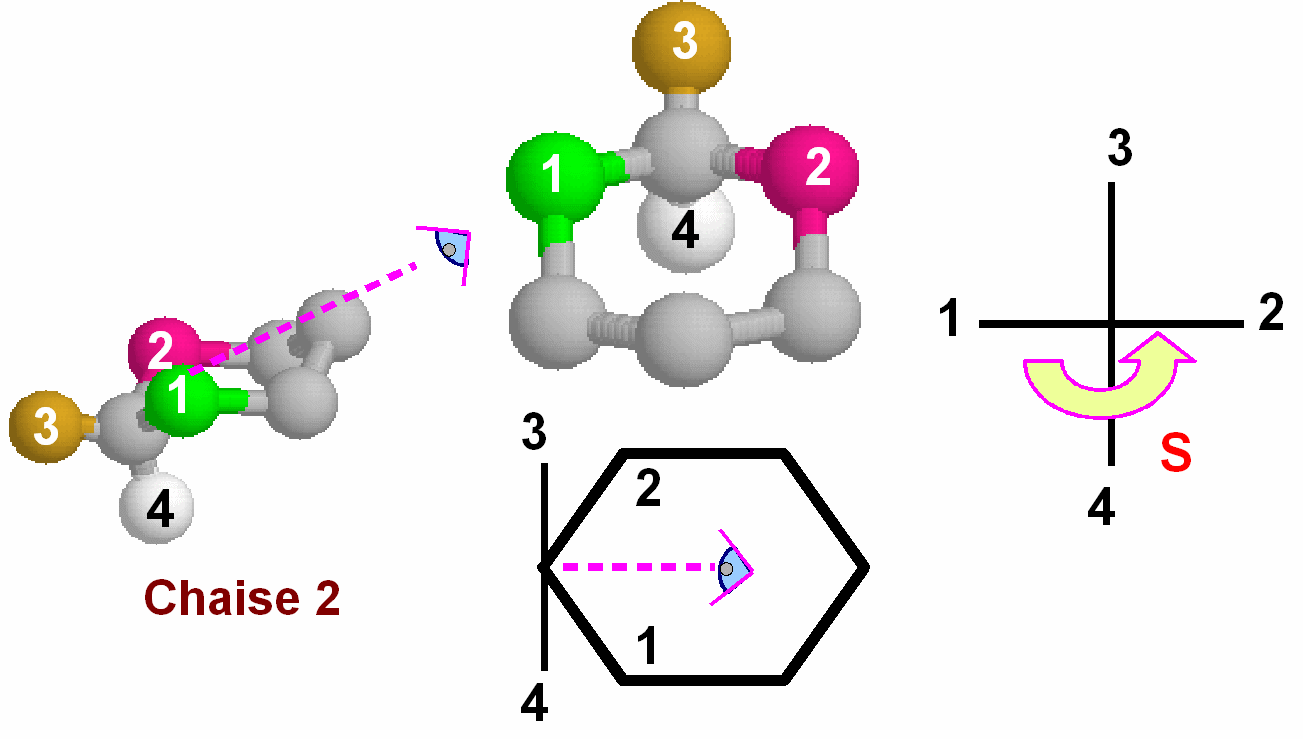
On
peut voir les choses d'une autre manière.
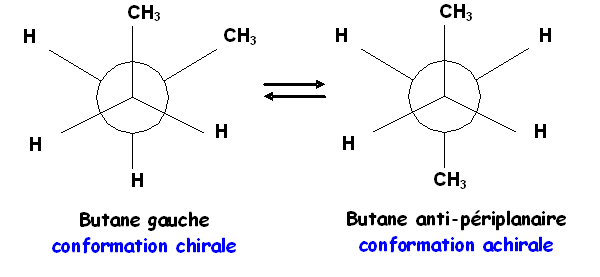
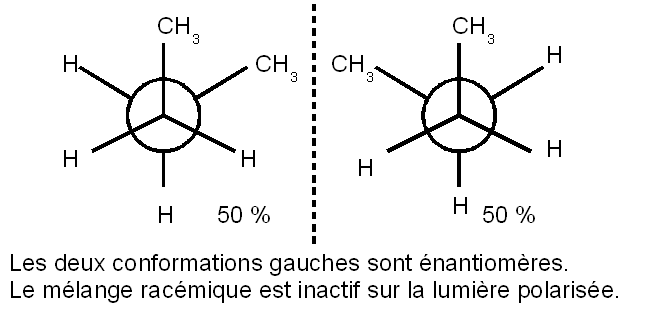
Imaginons qu'il
n'existe que les conformations gauches du butane, la molécule
serait-elle chirale dans ces conditions ?
La réponse est
non car il existe deux conformations gauches totalement équivalentes
et images spéculaires l'une de l'autre.
S'il n'existait que
la conformation gauche, 50 % des molécules adopteraient une
forme et 50 % l'autre.
Ce type de mélange
est appelé mélange racémique et est globalement
optiquement inactif. La lumière polarisée étant
déviée à la fois et dans les mêmes
proportions vers la droite et vers la gauche, statistiquement il ne
se passe rien et elle n’est donc pas déviée.
Un autre exemple est celui des composés cycliques que nous allons maintenant traiter par l’exemple 1-2 di fluoro cyclohexane.
Aspect configurationnel :
Cette molécule possède deux carbones asymétriques, il y aura donc 22 = 4 isomères possibles au maximum.
C1 = R ; C2 = R
C1 = S ; C2 = S
C1 = R ; C2 = S
C1 = S ; C2 = R
Aspect conformationnel :
Il y a 4 possibilités pour placer les fluors sur le cycle cyclohexane :
C1 équatorial et C2 équatorial
C1 équatorial et C2 axial
C1 axial et C2 équatorial
C1 axial et C2 axial
Exemple
:
Etablissons les configurations des carbones asymétriques
C1 et C2 pour le conformère chaise 1, C1
axial et C2 équatorial
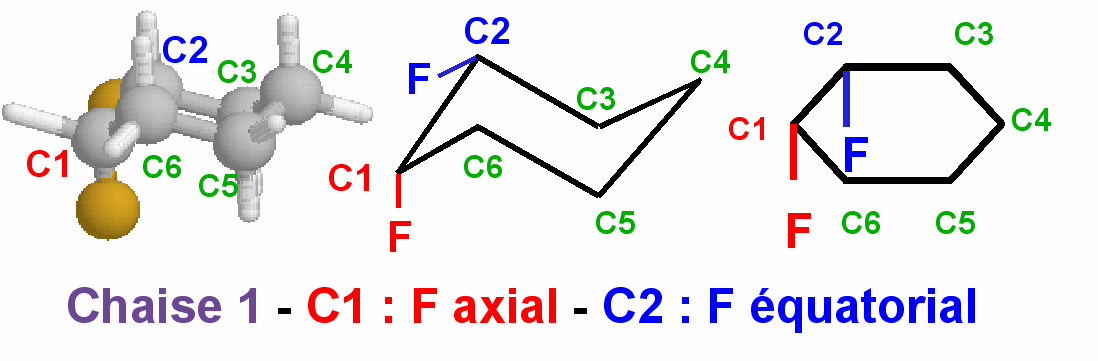
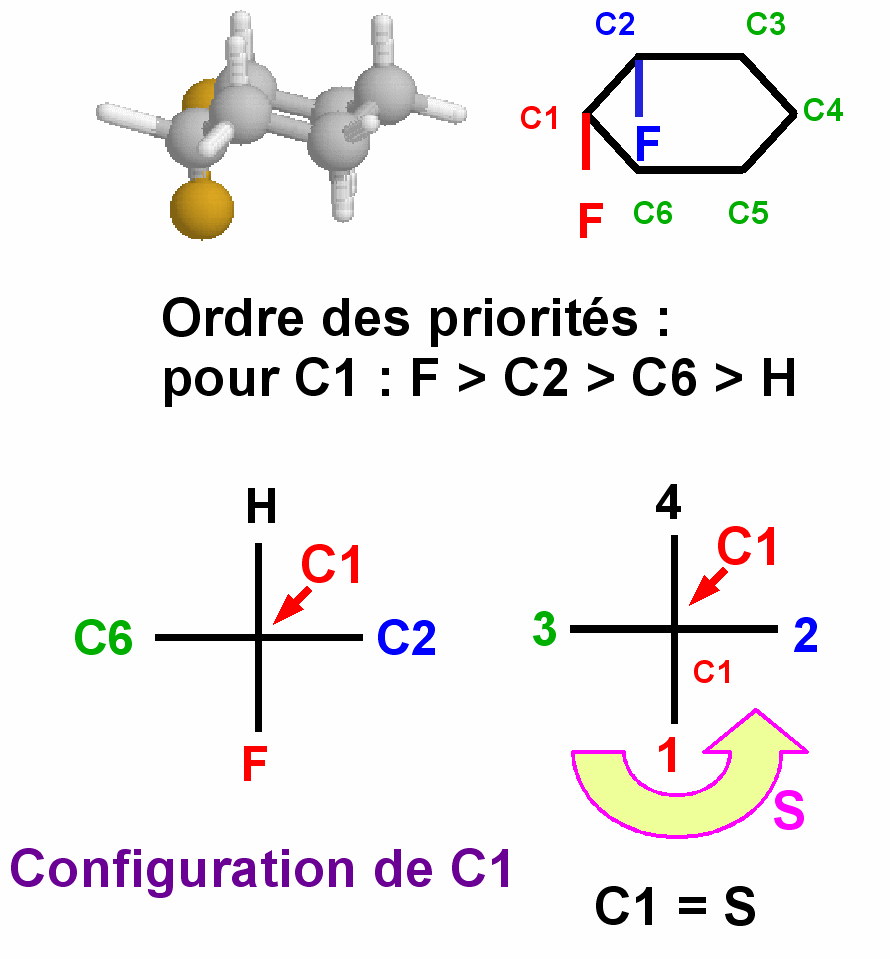
Configuration du carbone 1 :
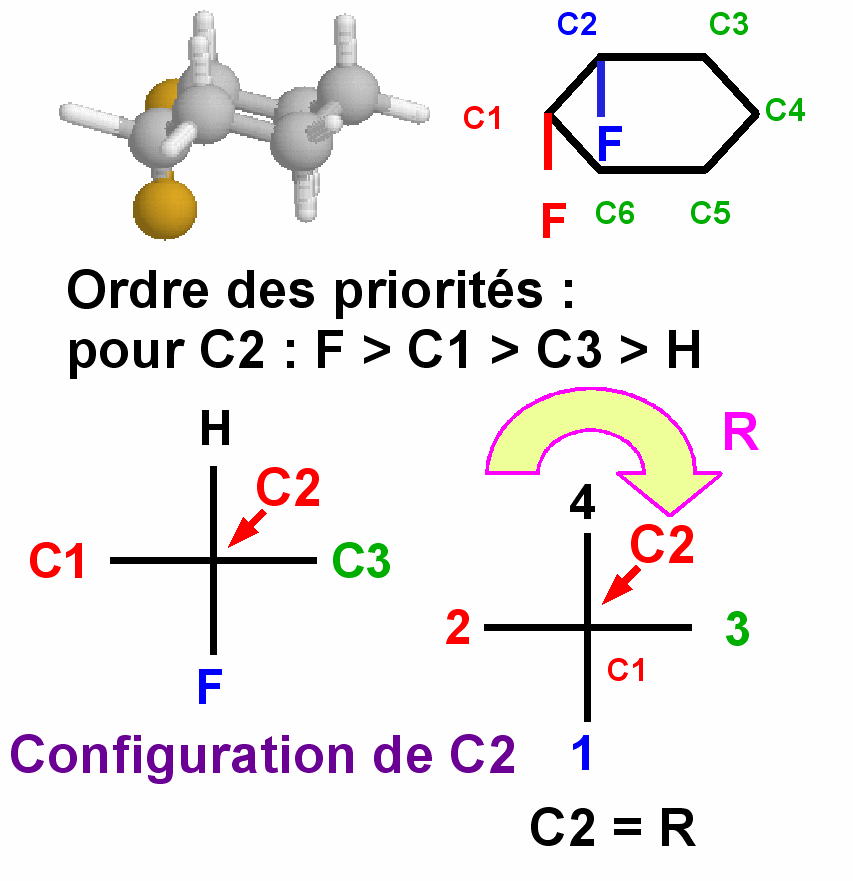
Configuration du carbone 2 :
Vous êtes invités a vérifier par vous même les configurations des autres composés.
|
|
|
|
|---|---|---|
|
|
|
|
|
|
|
|
|
|
|
|
Relations entre les diverses structures :
La
visualisation des relations entre les diverses structures est
difficile, on peut utiliser des modèles moléculaires ce
qui permet de tourner les structures pour se rendre compte
visuellement des relations entre elles.
L'utilisation de la
représentation plane simplifie grandement les choses.
Composés chiraux (R,R) et (S,S)
Remarquons tout d'abord que les composés chiraux (R,R) et (S,S) sont tous deux des composés de type TRANS.
Les structure A et B sont deux conformères en équilibre rapide entre elles.
Les structures C et D sont deux conformères en équilibre rapide.entre elles.
Les structures diéquatoriales (A et D) sont très largement majoritaires.
Les structures A et D sont énantiomères l'une de l'autre.
Les structures B et C sont énantiomères l'une de l'autre.
Les
structures A et C ne sont pas au sens strict des énantiomères
car elles ne sont pas images spéculaires l'une de l'autre,
elles ne sont pas non plus superposables, il s'agit donc de
diastéréoisomères.
Il en va de même
pour les structures B et D.
|
|
|
|---|---|
|
|
|
|
|
|
|
|
|
Composés méso (R,S) et (S,R)
Remarquons tout d'abord que les composés achiraux (R,S) et (S,R) sont tous deux des composés de type CIS.
Les structures E et F sont deux conformères en équilibre rapide entre elles.
Les structures G et H sont deux conformères en équilibre rapide.entre elles.
Les structures diéquatoriales (F et G) sont très largement majoritaires.
Les structures E et H sont énantiomères l'une de l'autre.
Les structures F et G sont énantiomères l'une de l'autre.
Les
structures E et G sont superposables et sont donc en fait
identiques.
Il en va de même pour les structures F et
H.
Finalement le composé CIS est un composé méso,
non chiral.
L'utilisation de la représentation simplifiée
plane permet de visualiser facilement le plan de symétrie.
|
|
|
|
|
|
|
|
|
|
|
|