Le Carbone tétragonal ou carbone sp3 :
Quand un atome de
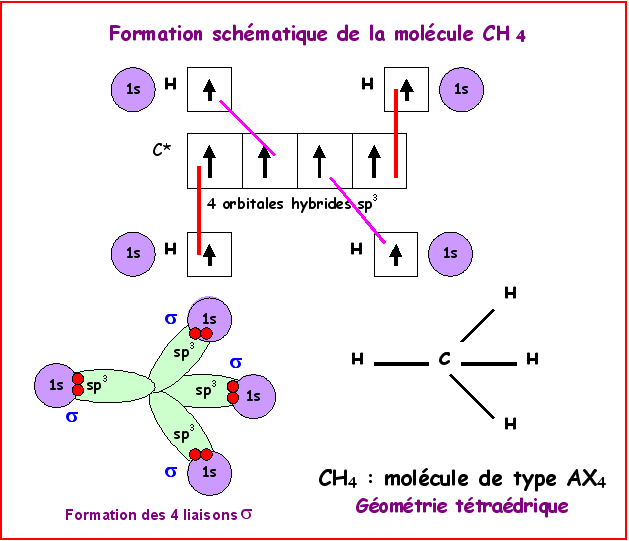
carbone est lié à quatre autres atomes on dit qu’il est tétragonal.
Il est
alors lié par 4 liaisons simples à ses 4 voisins.
Il utilise ses quatre
électrons de valence pour former les quatre liaisons et ne possède donc pas de
doublet libre.
Le type moléculaire est AX4 et la méthode R.P.E.C.V
(ou V.S.E.P.R) prévoit une géométrie tétraédrique avec des angles entre liaisons
de 109 °.
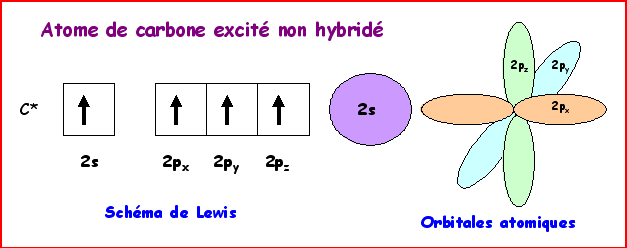
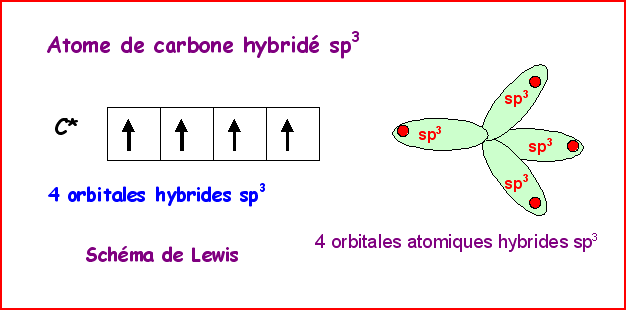
Dans le modèle quantique on utilise une combinaison linéaire des 4
orbitales de valence 2s , 2px, 2py et 2pz qui
vont donner 4 orbitales hybrides notées sp3 pointant dans les 4
directions du tétraèdre. Ces 4 orbitales hybrides vont ensuite former les 4
liaisons s par recouvrement axial avec les orbitales atomiques des
4 atomes voisins.

La molécule type de ce cas de figure est le méthane CH4
|
|
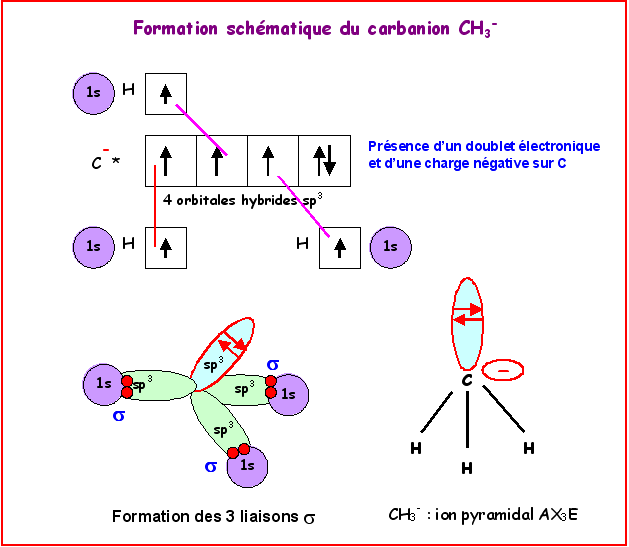
Cas des carbanions
Un carbanion est un ion moléculaire dans
lequel l’atome de carbone porte une charge négative. L’exemple le plus simple
est l’ion CH3-.
Dans ce type d’ion le carbone est lié a
trois atomes et possède un doublet libre.
Le type moléculaire est
AX3E et la géométrie est dérivée du tétraèdre, un sommet étant occupé
par le doublet libre. On a une structure pyramidale avec des angles proches de
109°. Il y a donc 4 directions autour du carbone et bien que seulement lié à 3
atomes et non 4, ce type moléculaire correspond tout de même à un carbone
tétragonal hybridé sp3.
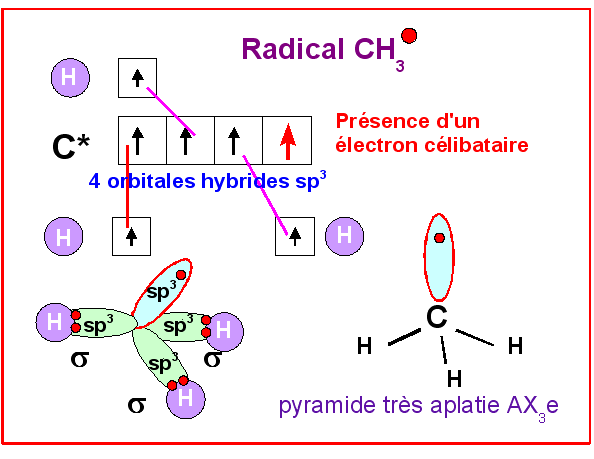
Cas des radicaux
Un radical est un édifice moléculaire dans lequel
l’atome de carbone possède un électron célibataire. L’exemple le plus simple est
le radical CH3..
Dans ce type d’édifice, le carbone est lié a
trois atomes et possède un électron célibataire.
Le type moléculaire est
intermédiaire entre AX3 plane et AX3E tétraédrique.
On
peut le noter AX3e, le e minuscule correspondant à l’électron
célibataire considéré comme un « ½ doublet libre ».
Sa géométrie
est difficile à prévoir, car la VSEPR ne prévoit pas de tel cas.
Elle doit être intermédiaire entre le
triangle équilatéral AX3 et la forme pyramidale AX3E. On
aura donc une structure pyramidale très aplatie.
On peut néanmoins supposer
qu’elle est dérivée du tétraèdre, un sommet étant occupé par l’électron
célibataire.
Il y a donc tout de même 4 directions autour du carbone et bien
que seulement lié à 3 atomes et non 4, on peut assimiler ce type moléculaire à
un carbone tétragonal hybridé sp3.