CHIM 121- Bases de chimie organique – Cours de Thierry Brière – Le carbone sp2
Quand
un atome de carbone est lié à 3 autres atomes on dit
qu’il est trigonal.
Il est alors lié par 3 liaisons à
ses 3 voisins.
Puisque le carbone avec ses 4 électrons est
tétravalent, une des liaisons est une liaison double.
Il
utilise ses quatre électrons de valence pour former les quatre
liaisons et ne possède donc pas de doublet libre.
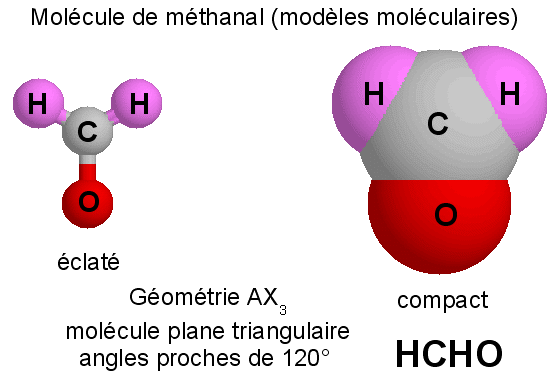
Le type
moléculaire est AX3
et la méthode R.P.E.C.V (ou V.S.E.P.R) prévoit une
géométrie triangulaire plane avec des angles entre
liaisons de 120 °.
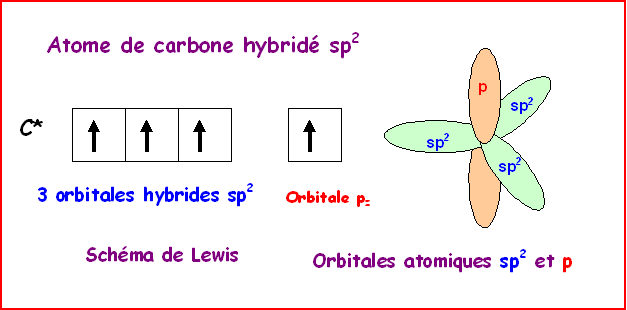
Dans le modèle quantique on utilise
une combinaison linéaire des 3 orbitales de valence 2s , 2px
et 2py
qui vont donner 3 orbitales hybrides notées sp2
pointant dans les 3 directions du triangle équilatéral.
Ces 3 orbitales hybrides vont ensuite former les 3 liaisons
par recouvrement axial avec les orbitales atomiques des 3 atomes
voisins.
L’orbitale 2pz
non utilisée pour former les orbitales sp2
est toujours présente et assurera la formation de la liaison
supplémentaire.
Cette orbitales p restante est
perpendiculaire au plan des trois orbitales sp2.

Nous supposerons que l’atome d’oxygène utilise lui aussi un état d’hybridation sp2.
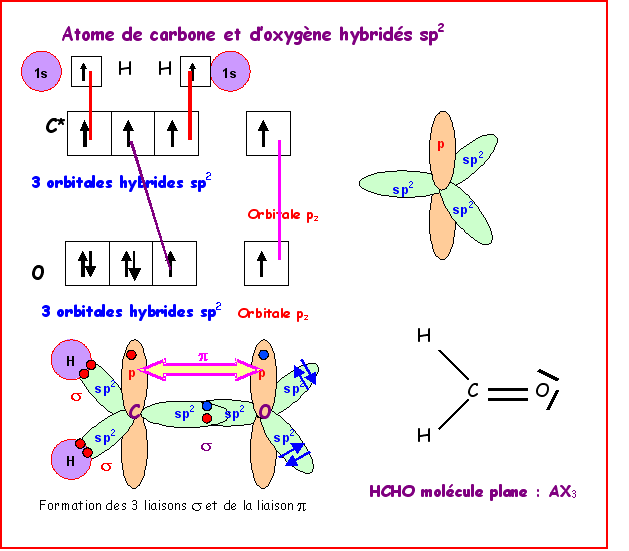
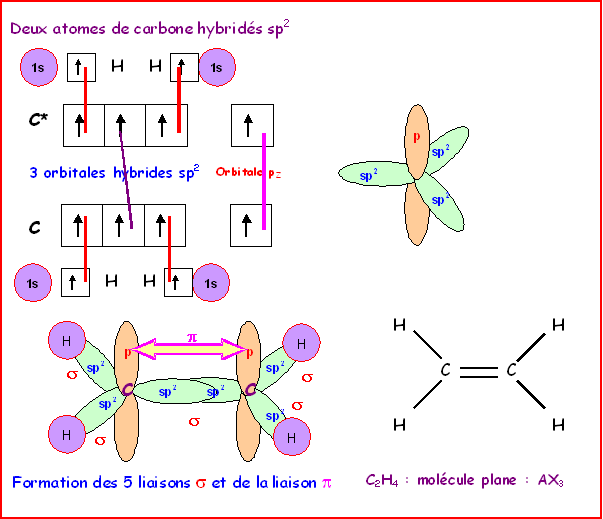
Deux
atomes de carbone en état d’hybridation sp2
sont unis par une double liaison, chacun est ensuite relié à
deux hydrogènes.
La molécule est constituée
de deux « morceaux » de géométrie
triangulaire plane reliés entre eux. La théorie
V.S.E.P.R n’indique pas si les deux triangles sont ou non dans
un même plan, a priori leur orientation peut être
quelconque.
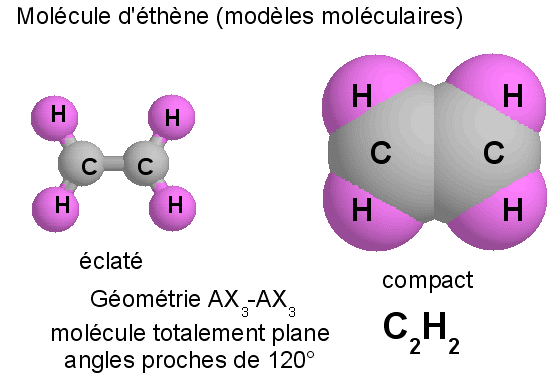
En réalité la molécule est
totalement plane et les deux triangles sont coplanaires.
Cela
s’explique aisément dans le cadre du modèle
quantique, en effet la liaison
ne peut se faire que par recouvrement latéral des orbitales p
« non utilisées », pour que ce
recouvrement puisse se faire, il faut obligatoirement que ces deux
orbitales soient parallèles entre elles. Puisque ces deux
orbitales sont perpendiculaires au plan des orbitales sp2,
ces deux derniers sont obligatoirement co-planaires.
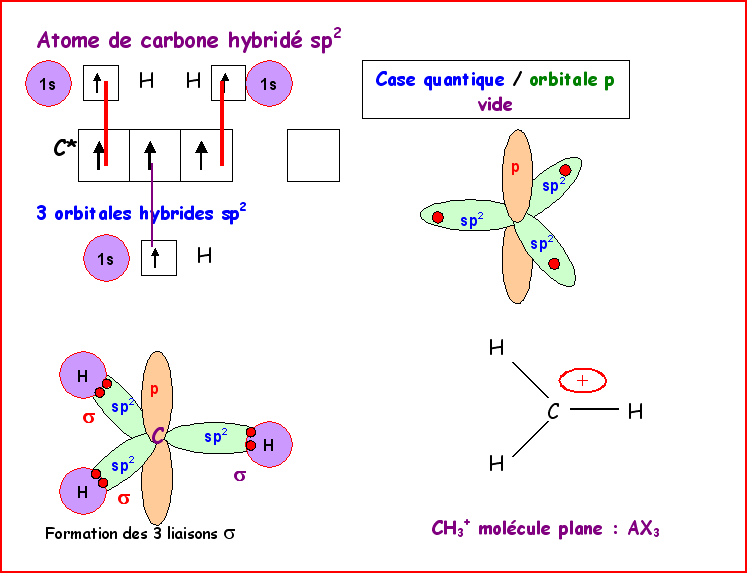
Un carbocation est un ion moléculaire
pour lequel le carbone porte une charge positive et possède
une case quantique vide.
Le carbone est relié par trois
simples liaisons à 3 voisins et est en hybridation de type sp2
avec une géométrie plane de type AX3.