ISOMERIE E,Z DES ALCENES
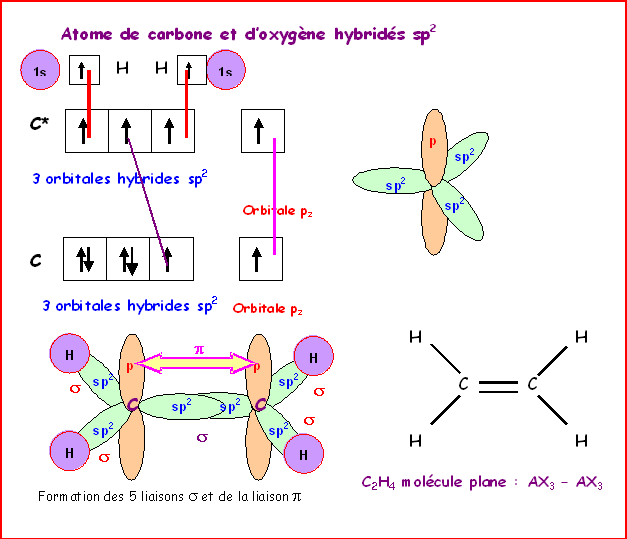
Nous avons vu que dans la molécule d’éthylène, l’orientation des plans correspondant au deux parties planes de la molécule, n’était pas quelconque mais que pour que la liaison p puisse se former il fallait obligatoirement qu’ils soient coplanaires. Cela est tout a fait général et il en sera toujours ainsi quand deux carbones sp2 sont liés entre eux..

Cette planéité a pour conséquence pratique que la rotation autour de la double liaison C=C est impossible sans rompre la liaison .
Si l’on substitue les hydrogènes par d’autre groupements d’atomes il en sera de même.
Exemple : La molécule de but-2-ène CH3-CH=CH-CH3
Cette molécule est constituée d’un fragment éthylène sur lequel un hydrogène de chacun des carbones sp2 a été simplement remplacé par un groupe méthyle CH3.
La molécule présente donc une géométrie très semblable à celle de l’éthylène.
Mais on a ici une dissymétrie qui fait que deux arrangements spatiaux différents sont possibles.
Dans l’un de ces arrangements qu’on nommera par la suite Cis ou Z les deux méthyles CH3 se font face.
Dans l’autre arrangement qu’on nommera par la suite Trans ou E les deux méthyles CH3 sont opposés l’un à l’autre.
On peut passer d’un arrangement à l’autre par une
simple rotation autour de la double liaison, mais cette rotation n’est possible
qu’a condition de rompre la liaison , il
s’agit donc de deux composés différents.
On dira qu’il s’agit de deux
isomères et plus précisément de deux diastéréo-isomères. Nous reviendrons plus
tard sur cette notion.
Leurs propriétés physiques sont différentes, par
exemple le composé Z à un point d’ébullition de 4°C alors que celui du composé E
est de 1°C.
|
Isomère Z |
Isomère E |
|
|
|
|
|
|
Pour que ce type d’isomèrie E,Z puisse exister il faut
que les deux carbones sp2 portent chacun deux substituants
différents.
Si un des carbone sp2 porte deux substituants
identiques cette isomèrie n’existe pas.
Exemple : le propène CH2 = CH – CH3
|
|
.Nomenclature - Stéréo descripteurs E et Z
Les substituants des deux carbones sp2 sont classés par ordre d'importance en suivant un ensemble de règles arbitraires appelées règles de Khan, Ingold et Prelog que nous préciserons par la suite.
L'isomère pour lequel les deux substituants prioritaires sont situés en face l'un de l'autre est nommé isomère Z.
L'isomère pour lequel les deux substituants prioritaires sont à l'opposé l'un de l'autre est nommé isomère E.
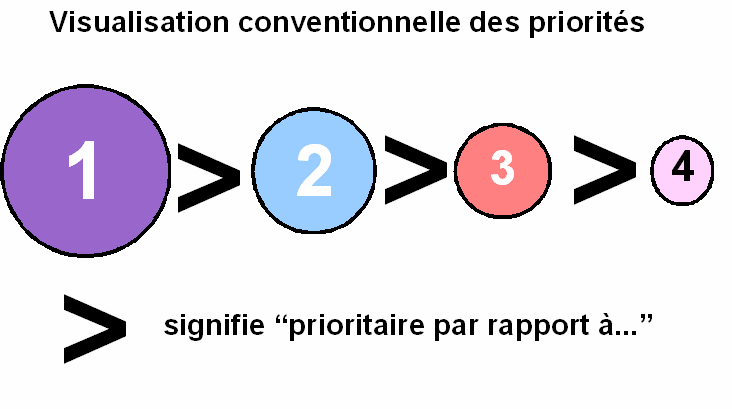
Remarque : Dans ce cours pour visualiser plus facilement les priorités nous adopterons les conventions suivantes :
Les substituants prioritaires seront représentés par des sphères de rayon important et porteront un numéro d'ordre petit.
Les substituants les moins prioritaires seront représentés par des sphères de faible rayon et porteront un numéro d'ordre important.
|
Isomère Z : |
Isomère E |
|
|
|
|
|
|