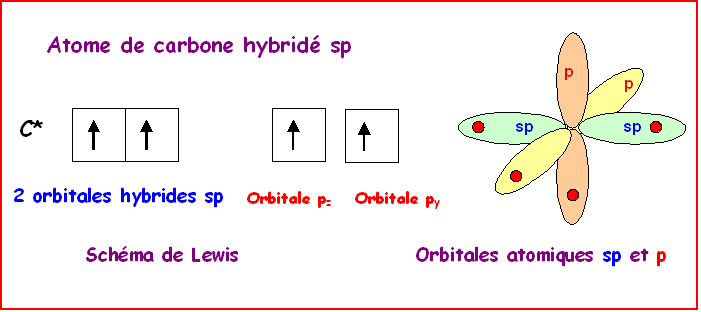
Quand un atome de carbone est lié à 2 autres atomes on
dit qu’il est digonal.
Il est alors lié par 2 liaisons à ses 2
voisins.
Puisque le carbone avec ses 4 électrons est tétravalent, il manque
deux liaisons.
Il y a deux possibilités pour faire les 4
liaisons :
Une liaison simple et une liaison triple : c’est le cas le plus courant
Deux liaisons doubles : Ce cas est très rare
Le carbone ses quatre électrons de valence pour former
les quatre liaisons et ne possède donc pas de doublet libre.
Le type
moléculaire est AX2 et la méthode R.P.E.C.V (ou V.S.E.P.R) prévoit
une géométrie linéaire des angles entre liaisons de 180 °.
Dans le modèle
quantique on utilise une combinaison linéaire des 2 orbitales de valence 2s et
2px qui vont donner 2 orbitales hybrides notées sp pointant à 180°
l’une de l’autre. Ces 2 orbitales hybrides vont ensuite former les 2 liaisons
p par
recouvrement axial avec les orbitales atomiques des 2 atomes voisins.
Les
orbitales 2pz et 2py non utilisées pour former les
orbitales sp sont toujours présentes et assureront la formation des liaisons
supplémentaires.
Ces orbitales p
restantes sont perpendiculaires entre elles et perpendiculaires aux orbitales
sp.

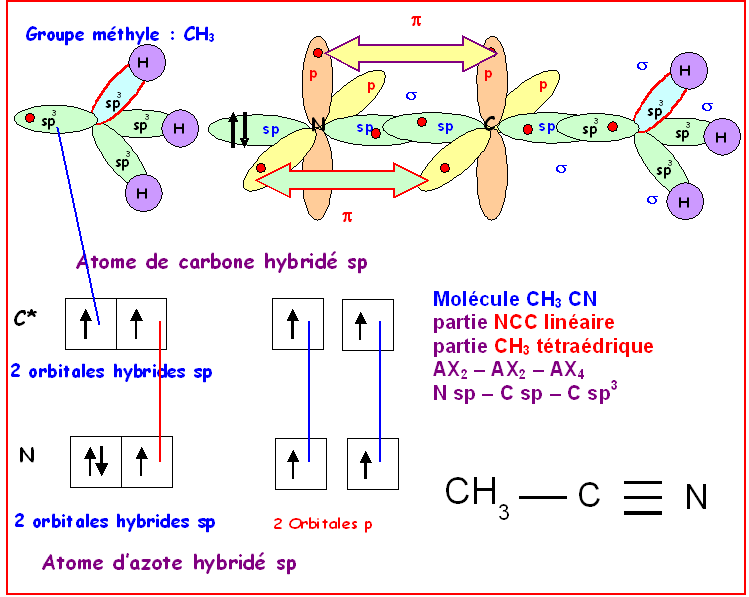
Premier exemple :Acétonitrile CH3CN
|
|
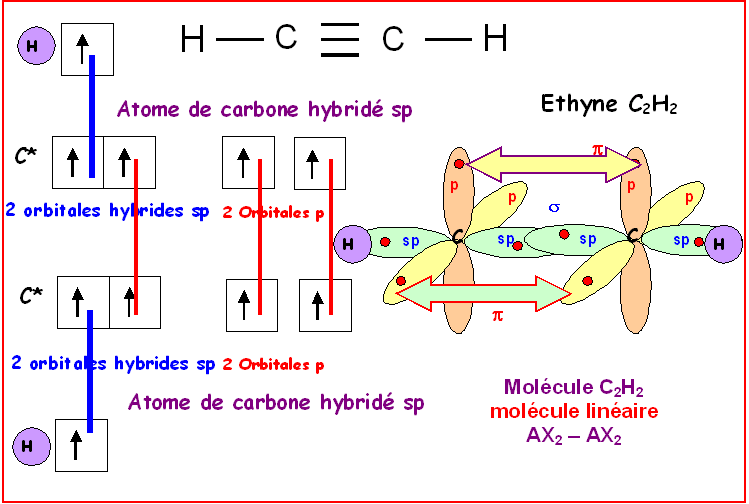
Exemple 2 : Un alcyne : L’éthyne ou acétylène : C2H2
|
|
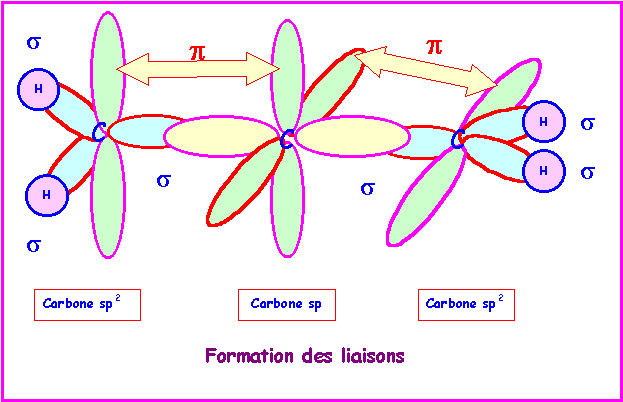
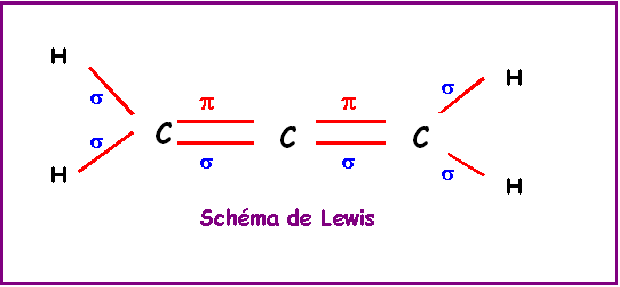
Troisième exemple : l’allène CH2=C= CH2
Cette molécule est un peu particulière,
elle comporte une atome de carbone central hybridé sp relié par des doubles
liaisons à deux carbone hybridé sp2 (groupements
CH2).
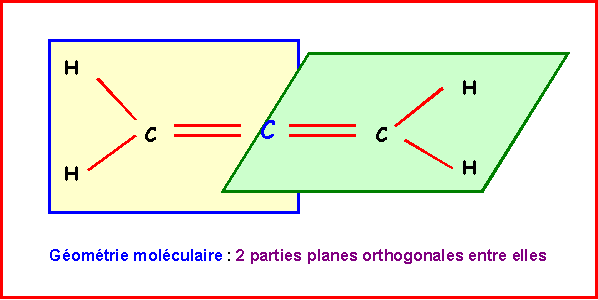
D’un point de vue géométrique la molécule est constituée de
deux « morceaux » triangulaires plan accolés l’un à l’autre.
La
théorie VSEPR ne permet pas de prévoir si ces deux partie planes sont ou non
dans un même plan.
Le modèle quantique permet lui de prévoir que ces deux
plans doivent obligatoirement être perpendiculaires entre eux.
En effet les
liaisons p ne peuvent se
former que par recouvrement latéral des orbitales p qui doivent donc être
parallèles entre elles.
Comme ces orbitales p sont perpendiculaires au plan
des orbitales sp2 des CH2, ces deux plans doivent
obligatoirement être perpendiculaires entre eux.
Mais des figures parleront
beaucoup mieux que ce discours !
|
|