groupement
Remplacé par
![]()
![]()
![]()
REGLES DE KHAN, INGOLD ET PRELOG
Ces règles servent à classer les substituants par ordre de
priorité.
Elles sont utilisées pour la détermination des stéréo descripteurs
E, Z, R, S, érythro, thréo etc.
Il est donc indispensable de bien les
connaître quand on aborde toutes les notions de
stéréochimie.
Règles de priorité :
- Les groupes sont placés dans l'ordre décroissant en fonction du numéro atomique Z du premier atome de la substitution lié au carbone asymétrique ou au carbone sp2 pour l’isomérie E,Z des alcènes.
Br > Cl > O > N > C > H
car : Br =
35, Cl = 17, O = 8, N = 7, C = 6, H = 1
Attention il s'agit du N° atomique et non de la masse atomique. Par exemple l'iode et le tellure ont des masses molaires moyennes qui ne correspondent pas à l'ordre de leur N° atomique
I : Z = 53 et M = 126,9 ; Te: Z = 52 et M = 127,6
- Si deux N° atomiques sont identiques on se réfère alors à la masse atomique.
Par exemple : 2H (deutérium =D) > 1H et 13C > 12C
- Si 2 ou plusieurs atomes immédiatement liés au carbone concerné sont identiques, on les départagera en appliquant la règle précédente aux atomes séparés par deux liaisons du carbone concerné.
Exemples :
-CH2-OH > -CH3
car O > H
-CH2-Br > -CH2-OH car Br >
O
-CH2-CH3> -CH3 car C >
H
-CH2-OH > -CH2-CH3 car O >
C
Si c'est nécessaire, on considérera les atomes en 3ème, 4ème, etc. position.
Exemples :
-CH2-CH2-CH2-Cl < -CH2-CHOH-CH3 < -CH2-CH2Cl
-CH2-CH2-CH2-Cl < -CH2-CH2-CHOH-CH3 < -CH2-CH2-Cl
-CH2-CHCl-CBr2CH2-Cl < -CH2-CHCl-CBr2-CHNH2-CH3 < -CH2-CHCl-CBr2-Cl
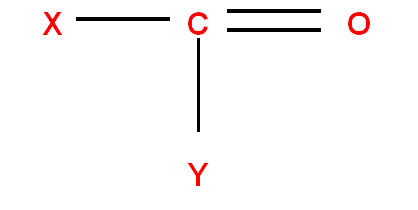
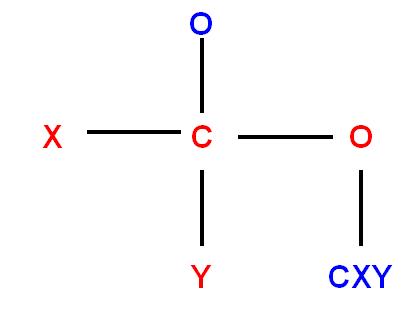
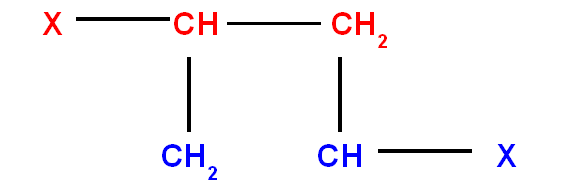
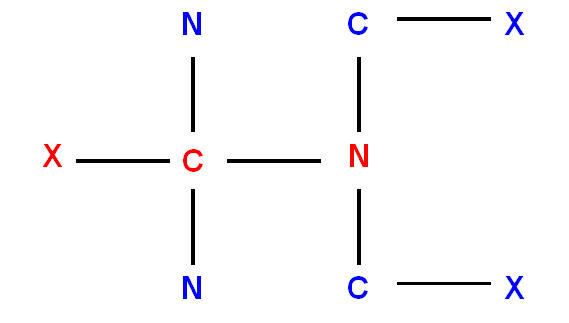
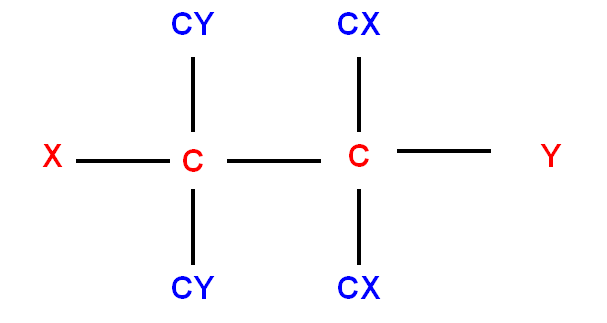
- Si un atome est rattaché à un autre par une double liaison ou par une triple liaison.
Il sera compté 2 fois ou 3 fois sur chacun des atomes participant à la liaison multiple.
Exemples :
|
groupement |
Remplacé par |
|
|
|
|
|
|
|
|
|
|
|
|
On peut ainsi justifier le classement de quelques groupes fréquemment rencontrés : liste non exhaustive.
-I > -Br > -Cl > -SO3H > -SH > -F > -O-COR > -OR > -OH > -NO2 > -NR2 > -NHR > -NH2 > -COOR > -COOH > -CONH2 > -CHO > -CH2OH > -CN > -C6H5 > -C-(CH3)3 > -CH R2 > -CH2R > -CH3 > -D > -H > doublet > électron célibataire