EFFET INDUCTIF
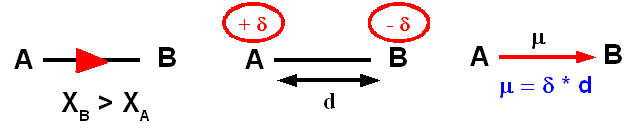
Polarisation des liaisons s :
Quand
deux atomes d'électronégativité différentes
sont liés entre eux, il apparait une disymétrie dans la
densité électronique.
L'atome le plus électronégatif
attire les électrons vers lui et des charges électriques
partielles d apparaissent.
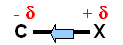
Un
dipole électrique est crée, caractérisé
par son moment dipolaire m.

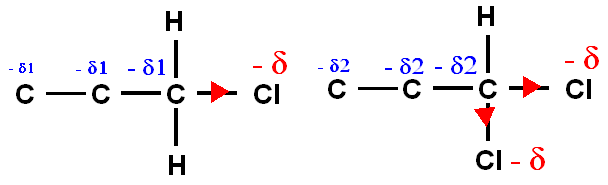
Dans les molécules polyatomiques organiques, la polarisation d'une liaison s comportant par exemple un atome très électronégatif X crée une polarisation induite sur les liaisons Carbone-Carbone environnantes et des charges partielles vont apparaitrent sur des
atomes de
carbone éloignés.
Ces charges seront de plus en plus
faibles au fur et à mesure de l'éloignement de l'atome
électronégatif à l'origine du phénomène.
On
considère que cet effet devient négligeable à
une distance supérieure à trois liaisons. Ce phénomène
de polarisation à distance est appelé EFFET
INDUCTIF.
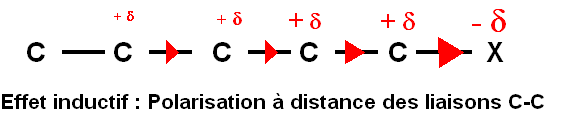
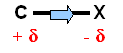
On classe les atomes ou les groupements d'atomes qui provoquent ce phénomène de polarisation à distance en deux catégories :
Groupement d'atomes à effet inductif attracteur : Effet – I

Il s'agit généralement de groupements contenant des atomes plus électronégatifs que le carbone.
Halogènes
: F, Cl, Br, I
Oxygène O
Azote N
On peut classer qualitativement ces groupements :
H < NH2 < OH < COOR < COR < CHO < Br < Cl < CN < NO2 < F
Groupements d'atomes à effet inductif donneur : Effet + I
Il s'agit généralement de groupements contenant des atomes moins électronégatif que le carbone.
Bore
B..
Sodium Na
Lithium
Li
Magnésium Mg
Ce cas est beaucoup plus rare que le cas précédant.
Remarque : nous verrons plus loin que même des groupements d'atomes ne comportant pas d'atome plus électronégatif que le carbone présentent néanmoins cet effet inductif donneur (Effet -I). C'est le cas des substituants alkyles : CH3 , CH2-CH3, CH(CH3)2 etc
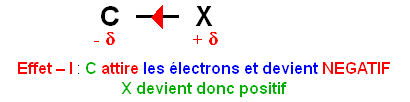
On peut classer qualitativement ces groupements :
H < CH3 < CH2-CH3 < CH(CH3)2 < C(CH3)3 < Mg < Li
Electronégativité du Carbone et hybridation :
L'état
d'hybridation d'un atome de carbone modifie légèrement
son électronégativité, quand le caractère
p augmente, l'électronégativité augmente
également.
L'ordre croissant des électronégativités
est donc le suivant : sp3
< sp2
< sp
Les
carbones sp et sp2 seront ainsi donneurs (effet -I) vis à
vis des carbones sp3.
Additivité
des effets inductifs :
On
peut admetre que les effets inductifs sont en première
approximation additifs.
L'intensité de l'effet inductif
sera d'autant plus élevée que le nombre d'atome qui en
est à l'origine sera plus important.

Conséquences de l'effet inductif :
Acidité des acides carboxyliques :
L'évolution des valeurs expérimentales des pKa des acides carboxyliques peuvent s'interpréter en termes d'effet inductif.
|
Acide |
pKa |
|
|
CH3-COOH |
4,76 |
Référence |
|
ClCH2-COOH |
2,87 |
1 Chlore |
|
Cl2CH-COOH |
1,25 |
2 Chlores |
|
Cl3C-COOH |
0,65 |
3 Chlores |
|
F3C-COOH |
0,25 |
3 Fluors |
Dans cette première série, on constate que l'acidité augmente (le pKa diminue) quand le groupement COOH est situé en a d'un groupement attracteur à effet -I.
Plus l'effet -I est important et plus l'acidité augmente.
Cet effet s'atténue avec l'éloignement de l'atome attracteur comme le montre cette deuxième série :
|
Acide |
pKa |
|
|
CH3-CH2 -CH2-COOH |
4,82 |
Référence |
|
CH3-CH2 -CHCl-COOH |
2,86 |
1 Chlore en a |
|
CH3-CHCl -CH2-COOH |
4,05 |
1 Chlore en b |
|
CH2Cl-CH2 -CH2-COOH |
4,52 |
1 Chlore en g |
Pour expliquer cette augmentation de l'acidité par effet -I, il faut examiner l'évolution de la charge au niveau de l'atome d'oxygène lié à l'atome d'hydrogène (groupement hydroxyle fonction O-H).
Comme nous l'avons vu pour l'effet mésomère, si la densité électronique diminue sur cet atome, l'acidité va augmenter car l'oxygène avide d'électron (très électronégatif) va attirer d'autant plus fortement le doublet de la liaison O-H. Cette liaison sera donc d'autant plus facile à casser et le composé sera donc d'autant plus acide.
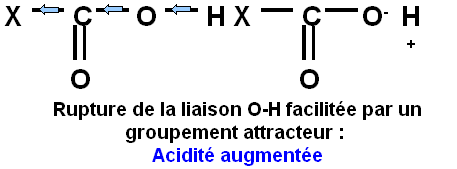 I
I
nversement la présence d'un groupement donneur (Effet + I) aura tendance à diminuer l'acidité du composé par augmentation de la densité électronique sur l'oxygène du groupement hydroxyle, la rupture de la liaison O-H, sera moins favorisée et l'acidité diminuera donc.
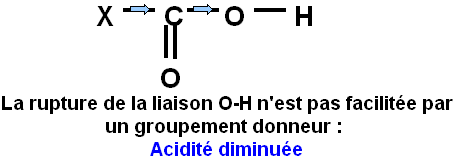
C'est ce qu'illustre cette troisième série de données :
|
Acide |
pKa |
|
|
H COOH |
3,75 |
Référence |
|
CH3 - COOH |
4,75 |
1 carbone en a |
|
CH3-CH2 - COOH |
4,87 |
1 carbone en a et 1 en b |
|
(CH3)3C-COOH |
5,05 |
1 carbone en a et 3 en b |
Quand l'effet donneur augmente, on observe bien une diminution de l'acidité (augmentation du pKa)..
Le raisonnement que nous venons de tenir s'applique de la même manière pour expliquer par exemple l'acidité des alcools....
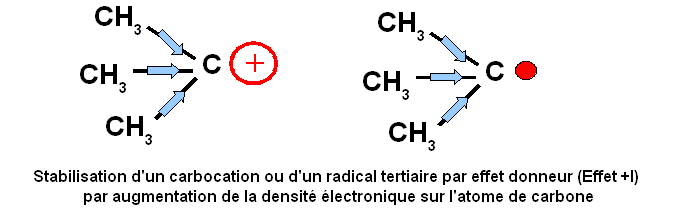
Stabilisation des carbocations et des radicaux :
L'effet inductif donneur des groupement alkyles explique également l'ordre des stabilités observées pour les carbocations et les radicaux carbonés.
CH3 < primaire < secondaire < tertiaire
CH3+ < R-CH2+ < R2- CH+ < R3 C+
CH3° < R-CH2° < R2- CH° < R3 C°
R représente une chaine carbonée “ordinaire” CH3, CH3CH2, CH3-CH2-CH2 etc