Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com
UNIVERSITE DE LA REUNION ANNEE UNIVERSITAIRE 2002-2003
TRAVAUX DIRIGES D'INITIATION A LA CHIMIE THEORIQUE-ATOMISTIQUE
PREMIERE PARTIE - LES ATOMES
SERIE 1 - Atomistique
mp = 1,00727 u.m.a mn = 1,00866 u.m.a me = 9,1095 10-31 kg
N = 6,022 1023 RH = 1,097 107 m-1 h= 6.62 10-34 Js C = 3 108 ms-1
Exercice 1 :
Le noyau de l'atome de Lithium est formé de 4 neutrons et trois protons. Calculer en u.m.a la masse théorique de ce noyau. La comparer à sa valeur réelle de 7,01601 u.m.a. Calculer l'énergie de cohésion de ce noyau en J et en MeV.
Exercice 2 :
Soit la réaction suivante :
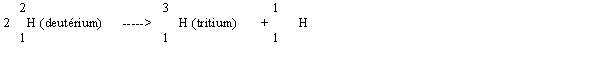
On donne les masses atomiques suivantes en u.m.a :
Hydrogène M=1.00783 Deutérium M=2.01410 Tritium M=3.01605
a) Quelle quantité d'énergie est libérée par la fusion de 1 kg de deutérium ?
b) Le pouvoir calorifique du charbon est de 33400 KJ Kg-1, quelle masse de charbon doit-on brûler pour produire l'énergie équivalente à celle produite par la fusion d'un Kg de deutérium ?
Exercice 3 :
Le Magnésium (Z = 12 ) existe sous forme de trois isotopes de nombre de masse 24, 25 et 26. Les fractions molaires dans le magnésium naturel sont respectivement : 0,101 pour 25Mg et 0,113 pour 26Mg.
a) Déterminer une valeur approchée de la masse molaire atomique du Magnésium naturel.
b) Pourquoi la valeur obtenue n’est-elle qu’approchée ?
Exercice 4 :
Le chlore naturel est un mélange de deux isotopes 35Cl et 37Cl dont les proportions relatives sont respectivement en nombre d’atomes 75% et 25%.
a) Calculer la masse molaire atomique du Chlore naturel.
b) Combien de sortes de molècules de dichlore existe-t-il dans le dchlore naturel?
c) Quelles sont leur masses molaire respectives et leur proportions relatives dans le dichlore naturel ?
Exercice 5 :
1) Le Gallium Ga possède deux isotopes stables 69Ga et 71Ga.
2) L’Arsenic a une masse molaire atomique de 74,92 g.mol-1 et ne possède qu’un seul isotope stable. Préciser la composition (nombre de protons et de neutrons) de son noyau. Quel est le symbole de cet isotope ?
Exercice 6 :
Le Silicium naturel est un mélange de trois isotopes stables 28Si, 29Si et 30Si . L'abondance isotopique naturelle de l'isotope le plus abondant est de 92,23%. La masse molaire atomique du Silicium naturel est de 28,085 g.mol-1.
1) Quel est l'isotope du Silicium le plus abondant ?
2) Calculer l'abondance naturelle des deux autres isotopes.
SERIE 2 - Spectre de l’Hydrogène et des Hydrogénoïdes
Exercice 1 :
Si l’électron de l’Hydrogène est excité au niveau n=5, combien de raies différentes peuvent-elles être émises lors du retour à l’état fondamental. Calculer dans chaque cas la fréquence et la longueur d’onde du photon émis.
Exercice 2:
Si un atome d’Hydrogène dans son état fondamental absorbe un photon de longueur d’onde l1 puis émet un un photon de longueur d’onde l2, sur quel niveau l’électron se trouve t-il après cette émission ? l1 = 97, 28 nm et l2 = 1879 nm
Exercice 3 :
Le Strontium peut être caractérisé par la coloration rouge vif qu'il donne à la flamme. Cette coloration est due à la présence dans son spectre de deux raies visibles à 605 nm et 461 nm. L'une est jaune-orangée et l'autre bleue. Attribuer sa couleur à chacune et calculer l'énergie et la fréquence des photons correspondants.
Exercice 4 :
a) Un atome d'hydrogène initialement à l'état fondamental absorbe une quantité d'énergie de 10,2 eV. A quel niveau se trouve-t-il alors ?
b) Un atome d'hydrogène initialement au niveau n=3 émet une radiation de longueur d'onde l = 1027 A°. A quel niveau se retrouve-t-il ?
Exercice 5 :
L'énergie de première ionisation de l'atome d'hélium est 24,6 eV.
a) quelle est l'énergie du niveau fondamental ?
b) Un atome d'hélium se trouve dans un état excité d'énergie -21,4 eV. Quelle est la longueur d'onde de la radiation émise quand il retombe au niveau fondamental ?
SERIE 3 - Configurations électroniques - Nombres Quantiques -
Notion de Couche et de sous-couche - Classification périodique
Exercice 1 :
Etablir les configurations électroniques des atomes suivants.Vérifier le résultat obtenus sur une classification périodique. Justifier les éventuelles anomalies.
As(Z=33) - Fe(Z=26) - Br(Z=35) - Cs(Z=55) - Cr (Z=24) - Mo (Z=42) - Au (Z=79) -
Exercice 2 :
Les affirmations suivantes sont-elles exactes ou inexactes? Pourquoi ?
a) Si l=1, l’électron est dans une sous couche d.
b) Si n=4 l’électron est dans la couche O.
c) Pour un électron d, m peut être égal à 3.
d) Si l=2, la sous-couche correspondante peut recevoir au plus 6 électrons
e) Le nombre n d’un électron d’une sous-couche f peut être égal à 3.
f) Si deux " édifices atomiques " ont la même configuration électronique, il s’agit forcément du même élément.
g) Si deux " édifices atomiques " ont des configurations électroniques différentes il s’agit forcément de deux éléments différents.
Exercice 3 :
Indiquez en le justifiant le nombre d'éléments présents dans les 2ème, 3ème , 4ème et 5ème périodes de la classification. Indiquez dans chaque cas le nombre d'éléments de transition.
Exercice 4:
Un élément a moins de 18 électrons et possède 2 électrons célibataires. Quelles sont les configurations électroniques possibles pour cet élément ? Quel est cet élément sachant qu'il appartient à la période du lithium(3) et au groupe de l'étain(50).
Exercice 5 :
Un élément appartient à la quatrième période et possède deux et seulement deux électrons " célibataires " (seuls dans une case quantique).
SERIE 4 - Approximations hydrogénoïdes de Slater - Propriétés atomiques
Exercice 1 :
Le tableau suivant donne : le rayon de covalence et le rayon ionique (en A°) et les énergies de première ionisation (E.I.1) et de deuxième ionisation (E.I.2) en KJ mol-1 des 4 premiers alcalins.
Rayon Covalent (A°) |
Rayon Ionique (A°) |
E.I 1 (KJ mol-1) |
E.I 2 (KJ mol-1) | |
Lithium |
1,23 |
0,60 |
520,3 |
7298 |
Sodium |
1,54 |
0,95 |
495,8 |
4562 |
Potassium |
2,03 |
1,33 |
419 |
3051 |
Rubidium |
2,16 |
1,48 |
403 |
2632 |
Dans le Chlorure de Potassium KCl la distance internucléaire K-Cl est de 3,14 A°.
Evaluer les rayons ioniques de K et de Cl.
Exercice 2 : Les éléments de la colonne 14
Les éléments de la colonne 14 de la classification périodique sont dans l'ordre de leur numéro atomique croissant : Carbone - Silicium - Germanium - Etain - Plomb
Le tableau suivant résume quelques données sur ces éléments :
Nom |
Rayon de covalence (A°) |
Rayons ioniques (A°) |
Carbone |
0,77 |
|
Silicium |
1,18 |
|
Germanium |
1,22 |
0,53 - 0,93 |
Etain |
1,40 |
0,71 - 1,12 |
Plomb |
1,46 |
0,84 - 1, 20 |
Nom |
Symbole |
Z |
Configuration électronique simplifiée [gaz rare] (couches externes) |
Z* |
Carbone |
||||
Silicium |
||||
Germanium |
||||
Etain |
||||
Plomb |
2-2: Donner l'expression obtenue pour le rayon d'une orbite de Bohr.
2-3 : Donner l'expression obtenue pour l'énergie de l'électron sur une orbite de Bohr.
2-4 : Que deviennent les deux expressions précédantes dans le cadre du modèle des approximations hydrogénoïdes de Slater.
2-5: Rayons de covalence et rayons atomiques
On évalue le rayon atomique par l'expression Ra = a0 * n2 / Z* (a0=0,529 A°)
Calculer en utilisant cette expression les rayons atomiques des éléments de la colonne 14.
2-6: Donner la définition du rayon de covalence d'un atome.
2-7: Représenter graphiquement l'évolution du Rayon de covalence en fonction du rayon atomique (définit comme précédemment) pour les éléments de la colonne 14.
2-8: Existe-t-il une relation de proportionnalité entre rayon de covalence et rayon atomique pour les éléments de la colonne 14 ?
2-9: En fait, pour "améliorer "le modèle de Slater on utilise des valeurs "corrigées" de n notées n*. Pour n = 1, 2 ou 3 on a simplement n* = n, pour n = 4 on prend n* = 3,7 et pour n = 5 on prend n* = 4. Sur le graphique précédant faire figurer les points obtenus en utilisant ces valeurs corrigées de n.
2-10: Le résultat obtenu est-il plus satisfaisant ?
2-11: Quelle valeur faut-il donner à n* quand n = 6 ?
3-1: Pour chaque rayon ionique de la table fournie donner la nature de l'ion correspondant. Justifier vos réponses.
Nom |
Rayons ioniques (A°) |
Ion |
Rayons ioniques (A°) |
Ion |
Germanium |
0,53 |
0,93 |
||
Etain |
0,71 |
1,12 |
||
Plomb |
0,84 |
1, 20 |
Exercice 3 :
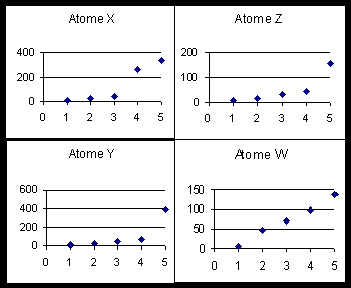
Soit 4 éléments X, Y, Z et W.
On sait que ces 4 éléments sont situés dans les 3 premières lignes de la classification périodique.
On donne les 5 premières énergies d’ionisation (en eV) de ces quatres éléments.
On donne d’autre part une représentation graphique de la variation de ces énergies d’ionisation.
1) Identifiez pour chacun de ces éléments sa colonne dans la classification.
2) Pour un de ces 4 éléments on peut sans hésitation attribuer aussi sa ligne dans la classification. De quel élément s’agit-il ? Donner son symbole chimique et son nom.
3) Deux de ces éléments appartiennent à un même groupe de la classification, comment cela se traduit-il sur la représentation graphique ? Attribuer à ces deux atomes leur symbole et leur nom.
4) Enfin l’attribution certaine d’une ligne est difficile pour un de ces éléments.
Lequel ? Proposer pour cet élément les deux possibilités pour son symbole et son nom.Pour lever l’indétermination sur la nature de cet élément calculer trois de ses énergies d’ionisation par les approximations hydrogénoïdes de Slater. Identifier cet élément par comparaison avec les valeurs expérimentales.
5) Pour l’atome Z sur le graphique on constate que les énergies d’ionisation successives se répartissent en deux groupes de deux (EI1 et EI2) (EI3 et EI4) ; EI5 étant très différente. Justifiez cette répartition.
E.I |
Atome X |
Atome Y |
Atome Z |
Atome W |
1 |
8,26 |
11,22 |
8,12 |
5,14 |
2 |
25 |
24,27 |
16,27 |
47,3 |
3 |
37,75 |
47,65 |
33,35 |
71,6 |
4 |
258,1 |
64,22 |
44,93 |
98,9 |
5 |
338,5 |
390,1 |
156,6 |
138,4 |
Exercice 4 :
* Pour les atomes suivants : F - O - C - Mg - Si
Evaluer : l'energie de 1° ionisation ; le rayon atomique ; le rayon de covalence ; l'électronégativité d'Alred et Rochow.
* Par comparaison des n2/Z*, classer les entités suivantes par ordre de taille croissante : Li - Na+ - O - F- - Mg2+ - C - S - N3- - S2-
Comparer le classement obtenu à la réalité (on prendra les rayons ioniques et les rayons de covalence du cours). Recommencez le classement en séparant atomes neutres et ions. Conclusions ?
Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com