Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com
SERIE 3 - Configurations électroniques - Nombres Quantiques -
Notion de Couche et de sous-couche - Classification périodique
Exercice 1 :
Etablir les configurations électroniques des atomes suivants. Vérifier le résultat obtenu sur une classification périodique. Justifier les éventuelles anomalies.
As(Z=33) - Fe(Z=26) - Br(Z=35) - Cs(Z=55) - Cr (Z=24) - Mo (Z=42) - Au (Z=79) -
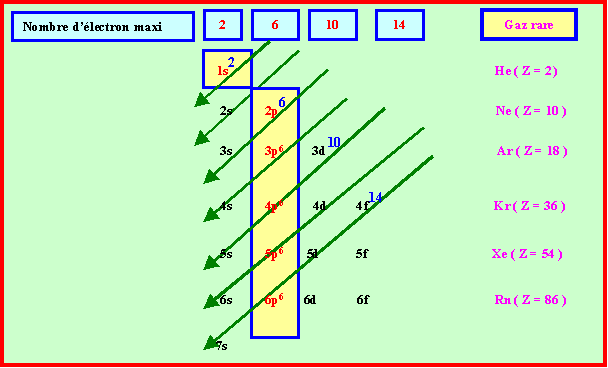
Règle de Klechkowski :
A quelques exceptions près, le remplissage des couches et des sous-couches se fait dans l’ordre des valeurs de ( n + l ) croissant. Si plusieurs combinaisons possibles conduisent à la même valeur, on choisit celle possédant la plus petite valeur de n . La représentation suivante est une méthode mnémotechnique permetant de retrouver facilement cet ordre de remplissage :

As : Z = 33
Configuration "lue sur le tableau" : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
Il convient de réécrire cette configuration dans l'ordre naturel.
Ecriture complète : 1s2 2s2 2p6 3s2 3p6 3d104s2 4p3
On peut aussi utiliser deux notations simplifiées :
Ecriture simplifiée [gaz rare] : [Ne] 3d10 4s2 4p3
Ecriture simplifiée "couches uniquement" K2 L8 M18 N5
Fe : Z = 26
Configuration "lue sur le tableau" : 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Il convient de réécrire cette configuration dans l'ordre naturel.
Ecriture complète : 1s2 2s2 2p6 3s2 3p6 3d6 4s2
On peut aussi utiliser deux notations simplifiées :
Ecriture simplifiée [gaz rare] : [Ne] 3d6 4s2
Ecriture simplifiée "couches uniquement" K2 L8 M14 N2
Br : Z = 35
Configuration "lue sur le tableau" : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Il convient de réécrire cette configuration dans l'ordre naturel.
Ecriture complète : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5
On peut aussi utiliser deux notations simplifiées :
Ecriture simplifiée [gaz rare] : [Ne] 3d10 4s2 4p5
Ecriture simplifiée "couches uniquement" K2 L8 M18 N7
Cs : Z = 55
Configuration "lue sur le tableau" : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1
Il convient de réécrire cette configuration dans l'ordre naturel.
Ecriture complète : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 6s1
On peut aussi utiliser deux notations simplifiées :
Ecriture simplifiée [gaz rare] : [Xe] 6s1
Ecriture simplifiée "couches uniquement" K2 L8 M18 N18 O8 P1
Pour les éléments suivants nous écrirons directement la configuration simplifiée faisant apparaître la structure du gaz rare qui est la plus pratique.
Configurations prévues par la règle de Klechkowski
Chrome (Cr) : Z = 24 = 18 + 6 à ( Ar ) 4s2 3d4 ( Ar ) 3d4 4s2
Molybdène (Mo) : Z = 42 = 36 + 6 à ( Kr ) 5s2 4d4 ( Kr ) 4d4 5s2
Or (Au) : Z = 79 = 54 + 25 à ( Xe ) 6s2 4f14 5d9 ( Xe ) 4f14 5d9 6s2
Comparaison avec les configurations électroniques réelles :
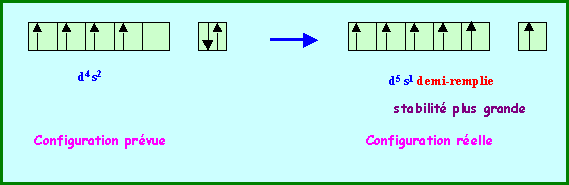
La règle de Klechkowski ne permet pas d’obtenir à coup sur la configuration électronique réelle des atomes. A partir de n = 3 de nombreuses exceptions à cette règle apparaissent. Nous ne chercherons pas à justifier toutes ces exceptions mais on peut expliquer certaines d’entre elles en admettant qu’une sous-couche totalement remplie ou à demi-remplie apporte une stabilité supplémentaire.
Ainsi la configuration d5 s1 est-elle plus stable que la configuration d6 s2 ( Cr et Mo)
De même la configuration d10 s1 est plus stable que la configuration d9 s2 ( Au )
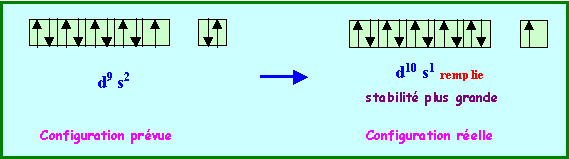
Les configurations réelles de ces trois éléments sont donc :
Cr : ( Ar ) 3d5 4s1 - Mo : ( Kr ) 4d5 5s1 - Au : ( Xe ) 4f14 5d10 6s1
Nous admettrons cette règle et l’appliquerons quand ces cas semblables se présenteront.
Nous rencontrerons des situations analogues lors de l’étude des énergies de première ionisation et pour expliquer la formation de certains ions.
Remarque : Si la configuration est modifiée la position dans la classification périodique ne l’est pas.
Exercice 2 :
Les affirmations suivantes sont-elles exactes ou inexactes? Pourquoi ?
a) Si l=1, l’électron est dans une sous couche d.
b) Si n=4 l’électron est dans la couche O.
c) Pour un électron d, m peut être égal à 3.
d) Si l=2, la sous-couche correspondante peut recevoir au plus 6 électrons
e) Le nombre n d’un électron d’une sous-couche f peut être égal à 3.
f) Si deux " édifices atomiques " ont la même configuration électronique, il s’agit forcément du même élément.
g) Si deux " édifices atomiques " ont des configurations électroniques différentes il s’agit forcément de deux éléments différents.
Rappels sur les 4 nombres quantiques :
Nombre quantique principal n : entier non nul, caractérise la couche occupée par l'électron, la couche est aussi symbolisée par une lettre majuscule avec la correspondance suivante :
n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
couche |
K |
L |
M |
N |
O |
P |
Q |
Nombre quantique secondaire (ou azimutal) l : nombre entier avec 0 £ l £ n - 1 caractérise la sous-couche occupée par l'électron. La sous-couche est aussi symbolisée par une lettre minuscule avec la correspondance suivante :
l |
0 |
1 |
2 |
3 |
4 |
5 |
Sous-couche |
s |
p |
d |
f |
g |
h |
Nombre quantique magnétique m : Nombre entier avec -l £ m £ +l caractérise la "case quantique" occupée par l'électron peut être aussi symbolysée graphiquement par une case rectangulaire.
Nombre quantique de spin s : ne peut prendre que deux valeurs : s = ± 1/2, peut être symbolisé graphiquement par une flèche verticale ( dirigée vers le haut pour s = + 1/2 ou dirigées vers le bas ¯ pour s = - 1/2.
a) Si l = 1, l’électron est dans une sous couche d.
l = 1 à sous-couche p : FAUX
b) Si n = 4 l’électron est dans la couche O.
n = 4 à couche N : FAUX
c) Pour un électron d, m peut être égal à 3.
d à l = 2 à ml = -2, -1, 0, 1, 2 : FAUX
d) Si l = 2, la sous-couche correspondante peut recevoir au plus 6 électrons.
l = 2 à ml = -2, -1, 0, 1, 2 à 5 cases quantiques à 10 électrons maximum : FAUX
e) Le nombre n d’un électron d’une sous-couche f peut être égal à 3.
n = 3 à l = 0, 1, 2 (s,p,d) à pas de f sur couche 3 : FAUX
f) Si deux " édifices atomiques " ont la même configuration électronique, il s’agit forcément du même élément.
" édifice atomique " = atome " neutre " ou ion
Un ion a la même configuration électronique qu’un atome neutre d’un autre élément : FAUX
Exemples : Na+ , Ne et O2- ont la même configuration électronique.
g) Si deux " édifices atomiques " ont des configurations électroniques différentes il s’agit forcément de deux éléments différents.
L’ion et l’atome neutre du même élément ont forcement des configurations électroniques différentes : FAUX
Exercice 3 :
Indiquez en le justifiant le nombre d'éléments présents dans les 2ème, 3ème , 4ème et 5ème périodes de la classification. Indiquez dans chaque cas le nombre d'éléments de transition.
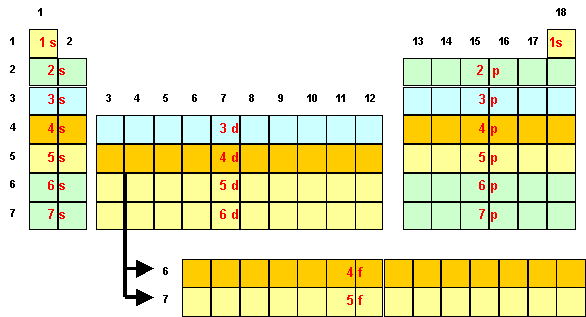
La classification périodique est un reflet quasi fidèle de la règle de Klechkovski.
La première ligne correspond à la première couche électronique 1s et contient donc deux éléments 1s1 et 1s2.
La deuxième ligne correspond à la deuxième couche et contient donc 8 éléments ( 2 s1 à 2 p6 ).
La troisième couche contient au maximum 2*32 = 18 électrons avec trois sous-couches 3s, 3p et 3d. Les éléments de configurations 3s et 3p font bien partie de la troisième ligne, en revanche, puisque le niveau 3d se remplit après le niveau 4s, les éléments de configuration 3d seront placés dans la quatrième ligne. La ligne 3 contient donc 8 éléments (3s et 3p).
La quatrième couche contient au maximum 2*42 = 32 électrons avec quatre sous-couches 4s, 4p,4d et 4f. Les éléments de configurations 4s et 4p font bien partie de la quatrième ligne, en revanche, puisque le niveau 4d se remplit après le niveau 5s, les éléments de configuration 4d seront placés dans la cinquième ligne. De même, le niveau 4f se remplissant après le niveau 6s, les éléments correspondants seront placés dans la ligne 6.
La ligne 4 contient donc 18 éléments (4s, 3d et 4p).
La cinquième couche contient au maximum 2*52 = 50 électrons avec cinq sous-couches 5s, 5p, 5d, 5f et 5g. Les éléments de configurations 5s et 5p font bien partie de la cinquième ligne, en revanche, puisque le niveau 5d se remplit après le niveau 6s, les éléments de configuration 5d seront placés dans la sixième ligne. De même, le niveau 5f se remplissant après le niveau 7s, les éléments correspondants seront placés dans la ligne 7. Enfin, la sous-couche 5g serait placée dans la ligne 8 mais dans la pratique les éléments actuellement connus n'utilisent pas des niveaux aussi élevés.
La ligne 5 contient donc 18 éléments (5s, 4d et 5p).
La construction de la classification obéit donc à des règles logiques et reproduit l'ordre de remplissage des niveaux donné par la règle de Klechkovski.
Ce n'est qu'a la ligne 6 que les éléments de type f commenceront a apparaître avec la sous-couche 4f, la ligne 6 contiendra donc 50 éléments 6s, 5d, 6p et 4f…
Remarque : Les éléments de type f devrait selon Klechkowski apparaître entre les niveaux de type s et ceux de type d, la majorité de ces éléments n'obéissent toutefois pas a la règle de Klechkowski, le premier électron d apparaissant avant les électrons de type f, pour cette raison les éléments f ont été décalé d'une case (voir classification).
Eléments de transition : Selon l'Union Internationale de Chimie Pure et Appliquée (I.U.C.P.A) un élément est dit élément de transition si l'élément lui même ou un de ses états d'oxydation stables possède une sous couche électronique de type d ou f incomplète. L'utilisation d'une telle définition est toutefois peu pratique car elle sous-entend que les états d'oxydations stables de chaque élément serai connu de l'utilisateur de la définition ce qui n'est pas votre cas à l'heure actuelle. Nous nous contenteront donc d'une définition plus facilement utilisable en disant que les éléments des blocs d et f sont des éléments de transition. Pour la très grande majorité des cas, les deux définitions conduisent au même résultat, il existe toutefois des cas particuliers tel le zinc Zn qui bien qu'appartenant au bloc d n'est pas un élément de transition selon l'I.U.C.P.A car le seul état oxydé stable de Zn est le Zn(II) pour lequel la couche 3d est complète.
Avec notre définition simple on aura :
Lignes 1,2 et 3 : pas d'éléments de transition.
Lignes 4 et 5 : 10 éléments de transition de type d.
Lignes 6 et 7 : 24 éléments de transition 10 de type d et 14 de type f.
Exercice 4:
Un élément a moins de 18 électrons et possède 2 électrons célibataires. Quelles sont les configurations électroniques possibles pour cet élément ? Quel est cet élément sachant qu'il appartient à la période du lithium(3) et au groupe de l'étain(50).
L’élément en question appartient à l’une des trois premières lignes de la classification.
La représentation sous forme de cases quantiques montre que seules les configurations p2 et p4 possèdent "exactement" deux électrons célibataires. On peut aussi considérer que la configuration s2p3 peut convenir puisqu'elle compte 3 électrons célibataires. L’élément en question ne peut donc être que : C, Si, O , S , N ou P.
On sait qu’il appartient a la période du lithium, donc Si , S et P sont éliminés.
Cherchons la configuration de l'étain ( Z = 50)
50 = 36 + 14 è (Kr) 4d10 5s2 5p2
L’élément cherche appartenant au même groupe que l’étain est donc le Carbone C.
s1 |
s2 |
p1 |
p2 |
p3 |
p4 |
p5 |
p6 |
H |
He |
||||||
Li |
Be |
B |
C |
N |
O |
F |
Ne |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
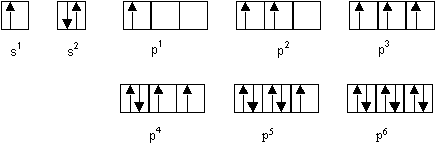
Exercice 5 :
Un élément appartient à la quatrième période et possède deux et seulement deux électrons " célibataires " (seuls dans une case quantique).
a) Combien de possibilités y a-t-il ? Préciser pour chacune le N° de la colonne et celui de la ligne.
b) On sait de plus que cet élément n’est pas un élément de transition. Combien reste-t-il de possibilités ? Préciser pour chacune le N° de la colonne et celui de la ligne.
c) On sait de plus que cet élément appartient a la famille des chalcogènes. Combien reste-t-il de possibilités ? Préciser pour chacune le N° de la colonne et celui de la ligne.
On sait que la période concernée est la période 4 soit également la ligne 4.
Possibilités de configurations a deux électrons célibataires :
p2 = colonne 14
p4 = colonne 16
d2 = colonne 4
d8 = colonne 10
Si on élimine les éléments de transition (d2 et d8) il ne reste que deux possibilités p2 colonne 14 et p4 colonne 16.Les chalcogènes sont les élément de la colonne 16 (famille de l'Oxygène). L'élément recherché est donc le Sélénium : Se (Z = 34) (ligne 4 - colonne 14).
Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com