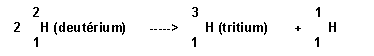
Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com
UNIVERSITE DE LA REUNION ANNEE UNIVERSITAIRE 2002-2003
SECTION S.S.M.1
TRAVAUX DIRIGES DE CHIMIE THEORIQUE-ATOMISTIQUE
T. BRIERE
SERIE 1 - Atomistique
mp = 1,00727 u.m.a mn = 1,00866 u.m.a me = 9,1095 10-31 kg
N = 6,022 1023 RH = 1,097 107 m-1 h= 6.62 10-34 Js C = 3 108 ms-1
Exercice 1 :
Le noyau de l'atome de Lithium est formé de 4 neutrons et trois protons. Calculer en u.m.a la masse théorique de ce noyau. La comparer à sa valeur réelle de 7,01601 u.m.a. Calculer l'énergie de cohésion de ce noyau en J et en MeV.
Masse théorique du noyau : mthéo = 4 * 1,00866 + 3 * 1,00727 = 7,05645 u.m.a
1 u.m.a = 1 / N g
mthéo = 7,05645 / N = 1,17178 10-23 g = 1,17178 10-27 Kg
La masse réelle du noyau est inférieure à sa masse théorique, la différence Dm ou défaut de masse correspond à l'énergie de cohésion du noyau.
Défaut de masse : Dm = 7,05645 - 7,01601 = 0,04044 u.m.a/noyau = 6,71538 10-29 Kg / noyau = 0,04044 g / mole de noyaux
Energie de cohésion :
E = Dm C2
E = 6,71538 10-29 (3 108)2 = 6,04384 10-12 J/noyau = 37,77 MeV/noyau
Moyen de vérification : On peut vérifier que l'ordre de grandeur obtenu est correct en calculant l'énergie moyenne de cohésion par nucléons ici on trouve 5,4 MeV/nucléon ce qui correspond bien à l'ordre de grandeur de la courbe d'Aston d'environ 8 MeV/nucléon pour les atomes stables 30 < Z < 80.
Exercice 2 :
Soit la réaction suivante :
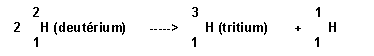
On donne les masses atomiques suivantes en u.m.a :
Hydrogène M = 1,00783 Deutérium M = 2,01410 Tritium M = 3,01605
a) Quelle quantité d'énergie est libérée par la fusion de 1 kg de deutérium ?
b) Le pouvoir calorifique du charbon est de 33400 KJ Kg-1, quelle masse de charbon doit-on brûler pour produire l'énergie équivalente à celle produite par la fusion d'un Kg de deutérium ?
2 2H à 3H + 1H
Dm = 3,01605 + 1.00783 – (2 * 2,0141) = -0,00432 u.m.a
Dm = - 0,00432 u.m.a / 2 atomes ou Dm = -0,00432 g / 2 moles
DE = Dm * C2 = - 3,89 1011 J / 2 moles
Le signe négatif indique que l’énergie est dégagée par cette réaction "exothermique".
Soit 3,89 1011 / 2 = 1,94 1011 J / mole ; soit 1,94 1011 / 2,0141 = 9,65 1010 J / g
soit finalement : 9,65 1013 J / Kg
b) Le pouvoir calorifique du charbon est de 33400 KJ Kg-1, quelle masse de charbon doit-on brûler pour produire l'énergie équivalente à celle produite par la fusion d'un Kg de deutérium ?
Masse de charbon équivalente : MC = 9,65 1013 / 33400 103 = 3000 tonnes environ
L'énergie dégagée par les processus nucléaires est beaucoup plus importante que celle dégagée par les processus chimiques ordinaires (ici 3 106 fois plus). Cela explique l’utilisation de l'énergie nucléaire malgré tous les risques potentiels.
Exercice 3 :
Le Magnésium (Z = 12 ) existe sous forme de trois isotopes de nombre de masse 24, 25 et 26. Les fractions molaires dans le magnésium naturel sont respectivement : 0,101 pour 25Mg et 0,113 pour 26Mg.
a) Déterminer une valeur approchée de la masse molaire atomique du Magnésium naturel.
b) Pourquoi la valeur obtenue n’est-elle qu’approchée ?
M = S xi Mi
x25Mg= 0,101 et M25Mg » 25
x26Mg= 0,113 et M26Mg » 26
x24Mg= 1 - 0,101 - 0,113 = 0,786 et M27Mg » 24
M Mg » 0,101*25 + 0,113*26 + 0,786*24 = 24,3 g.mol-1
Approximations :
* mp » mn » 1 u.m.a
* masse des électrons négligée
* défaut de masse négligé
Remarque : on peut vérifier dans une table que la première décimale est néanmoins exacte.
Dans la grande majorité des cas l'approximation est très correcte.
Exercice 4 :
Le chlore naturel est un mélange de deux isotopes 35Cl et 37Cl dont les proportions relatives sont respectivement en nombre d’atomes 75% et 25%.
a) Calculer la masse molaire atomique du Chlore naturel.
b) Combien de sortes de molècules de dichlore existe-t-il dans le dchlore naturel?
c) Quelles sont leur masses molaire respectives et leur proportions relatives dans le dichlore naturel ?
MCl = 0,75 * 35 + 0,25 * 37 = 35,5 g.mol-1
Molécule |
Masse Molaire (Mi) | Abondance (xi) |
35Cl – 35Cl |
70 |
0,75 * 0,75 = 0,5625 |
37Cl – 37Cl |
74 |
0,25 * 0,25 = 0,0625 |
35Cl – 37Cl ou 37Cl – 35Cl |
72 |
2 * 0.25 * 0,75 = 0,375 |
Vérifications possibles : S xi = 1 et MCl2 = 2 * 35,5 = 71 = S ( xi Mi )
Exercice 5 :
1) Le Gallium Ga possède deux isotopes stables 69Ga et 71Ga.
M = x1 M1 + x2 M2
M1 » A1 = 69 et M2 » A2 = 71
69,72 = 69 x1 + 71 x2
x1 + x2 = 1
69,72 = 69 x1 + 71 ( 1 - x1 )
69,72 = 69 x1 + 71 - 71 x1
2 x1 = 71 - 69,72 = 1,28
x1 = 0,64 et x2 = 0,36
64 % de 69Ga et 36 % de 71Ga
Ga : Z =31
69Ga : 31 protons et 38 neutrons - Isotope stable
71Ga : 31 protons et 40 neutrons - Isotope stable
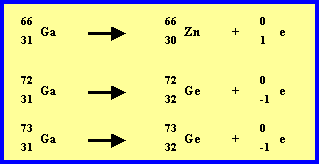
66Ga : 31 protons et 35 neutrons - Isotope Instable
Par comparaison avec les isotopes stables, on constate que cet isotope présente un défaut de neutrons, pour se stabiliser il cherchera à transformer un proton en neutron, il émettra donc de l'électricité positive, c'est un émetteur b+.
72Ga : 31 protons et 41 neutrons - Isotope Instable
Par comparaison avec les isotopes stables, on constate que cet isotope présente un excès de neutrons pour se stabiliser il cherchera à transformer un neutron en proton, il émettra donc de l'électricité négative, c'est un émetteur b-.
73Ga : 31 protons et 42 neutrons - Isotope Instable
Par comparaison avec les isotopes stables, on constate que cet isotope présente un excès de neutrons pour se stabiliser il cherchera à transformer un neutron en proton, il émettra donc de l'électricité négative, c'est un émetteur b-.
2) L’Arsenic a une masse molaire atomique de 74,92 g.mol-1 et ne possède qu’un seul isotope stable. Préciser la composition (nombre de protons et de neutrons) de son noyau. Quel est le symbole de cet isotope ?
As : Z = 33 et M » 75 è A = 75 è 33 protons et 42 neutrons
![]()
Exercice 6 :
Le Silicium naturel est un mélange de trois isotopes stables 28Si, 29Si et 30Si . L'abondance isotopique naturelle de l'isotope le plus abondant est de 92,23%. La masse molaire atomique du Silicium naturel est de 28,085 g.mol-1.
1) Quel est l'isotope du Silicium le plus abondant ?
2) Calculer l'abondance naturelle des deux autres isotopes.
M = 28,085 g.mol-1 = 28,085 u.m.a » 28 è L'isotope 28 est le plus abondant.
Appelons x l'abondance de l'isotope 29 et y celle de l'isotope 30.
Assimilons fautes de données masse atomique et nombre de masse pour les trois isotopes.
28,085 = 0,9223*28 + 29 x + 30 y
28,085 - 0,9223*28 = 2,2606 = 29 x + 30 y
0,9223 + x + y = 1
0,0777 = x + y
y = 0,0777 - x
29 x + 30 ( 0,0777 - x ) = 2,2606
29 x + 2,331 - 30 x = 2,2606
x = 0,0704 = 7,04%
y = 0,0073 = 0,73%
Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com