Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com
SERIE 2 - Spectre de l’Hydrogène et des Hydrogénoïdes
Exercice 1 :
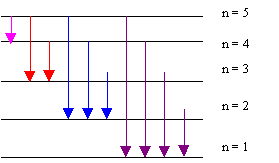
Si l’électron de l’Hydrogène est excité au niveau n=5, combien de raies différentes peuvent-elles être émises lors du retour à l’état fondamental. Calculer dans chaque cas la fréquence et la longueur d’onde du photon émis.
10 raies possibles :

On peut utiliser indifféremment le modèle de Bohr ou la formule empirique de Balmer-Rydberg.
Modèle de Bohr : En = - E0 / n2
Formule de Rydberg : 1/l = RH (1/n2 – 1/p2)
E n,p = -E0 / n2 + E0 / p2 = E0 (1/p2 - 1/n2)
E = h . n et n = C / l
E0 = h C RH = 6,62 10-34 * 3 108 * 1,097 107
E0 = 2,18 10-18 J ( 13,6 eV )
E n,p = 2,18 10-18 (1/p2 - 1/n2)
Raie - Transition |
Energie (J ) |
Fréquence ( 1015 Hz ) |
Longueur d’onde (nm) |
Domaine spectral |
Série |
|
5 è 4 |
4,905 10-20 |
0,074 |
4049 |
I.R |
Bracket |
|
5 è 3 |
1,55 10-19 |
0,23 |
1281 |
I.R |
Paschen |
|
5 è 2 |
4,58 10-19 |
0,69 |
433,8 |
Visible |
Balmer |
|
5 è 1 |
2,09 10-18 |
3,16 |
94,9 |
U.V |
Lyman |
|
4 è 3 |
1,06 10-19 |
0,16 |
1874 |
I.R |
Paschen |
|
4 è 2 |
4,09 10-19 |
0,62 |
486 |
Visible |
Balmer |
|
4 è 1 |
2,04 10-18 |
3,09 |
97,2 |
U.V |
Lyman |
|
3 è 2 |
3,02 10-19 |
0,46 |
656 |
Visible |
Balmer |
|
3 è 1 |
1,93 10-18 |
2,93 |
102,5 |
U.V |
Lyman |
|
2 è 1 |
1,63 10-18 |
2,5 |
121,5 |
U.V |
Lyman |
|
Remarques :
- Une erreur fréquente consiste à penser que les niveaux sont équidistants, ce qui diminuerait le nombre de raies.

Exercice 2 :
Si un atome d’Hydrogène dans son état fondamental absorbe un photon de longueur d’onde l1 puis émet un un photon de longueur d’onde l2, sur quel niveau l’électron se trouve t-il après cette émission ? l1 = 97, 28 nm et l2 = 1879 nm
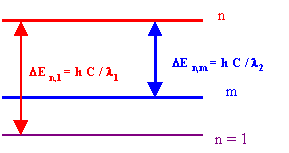
DE n,1 = h C / l1 = E0 (1 - 1/n2) = h C RH * (1 - 1/n2)
1 / l1 = RH * (1 -1/n2)
(1 -1/n2) = 1/ (RH l1) = 1/ (1,097 107 * 97,28 10-9 ) = 0,937
1/n2 = 1 - 0,937 = 0,0629
n2 = 15,89 è n = 4
DE n,1 = h C / l1 = E0 (1 - 1/n2) = h C RH * (1 - 1/n2)
DE n,m = h C / l2 = E0 (1/m2 - 1/n2) = h C RH * (1/m2 - 1/n2)
1 / l2 = RH * (1/m2 -1/n2)
(1/m2 -1/n2) = 1/ (RH l2) = 1/ (1,097 107 * 1879 10-9 ) = 0,0485
1/m2 - 1/n2 = 0,0485
1/m2 = 0,0485 + 1/16 = 0,111
m2 = 9,009 è m = 3
Exercice 3 :
Le Strontium peut être caractérisé par la coloration rouge vif qu'il donne à la flamme. Cette coloration est due à la présence dans son spectre de deux raies visibles à 605 nm et 461 nm. L'une est jaune-orangée et l'autre bleue. Attribuer sa couleur à chacune et calculer l'énergie et la fréquence des photons correspondants.
Le domaine du visible s'étalle approximativement de 400 nm à 800 nm.
L'ordre des couleurs est celui bien connu de l'arc en ciel : VIBVJOR soit Violet - Indigo - Bleu - Vert - Jaune - Orange - Rouge. Le violet correspond aux hautes énergies, aux hautes fréquences et aux faibles longueurs d'onde. Inversement, le rouge correspond aux faibles énergies, aux faibles fréquences et aux grandes longueurs d'onde.
Il est donc facile d'attribuer sa couleur à chaque raie par simple comparaison.
n = c / l
E = h n = h C / l
Raie 1 : l1 = 605 nm
n1 = 3 108/ 605 10-9 = 4,96 1014 Hz
E1 = 6,62 10-34 * 4,96 1014 = = 3,28 10-19 J
Couleur jaune orangée (longueur d'onde élevée fréquence et énergie faibles)
Raie 2 : l2 = 461 nm
?1 = 3 108/ 461 10-9 = 6,51 1014 Hz
E1 = 6,62 10-34 * 6,51 1014 = = 4,31 10-19 J
Couleur bleue (longueur d'onde faible fréquence et énergie élevées)
Exercice 4 :
( 1 / n2 - 1 / m2) = DE / E0
Ici n = 1
( 1 - 1 / m2) = DE / E0
1 / m2 = 1 - (DE / E0) = 1 - (10,2 /13,6) = 0,25
m2 = 4 et m = 2
l = 1027 A° = 1027 10-10 m
E = h C / l = 6,62 10-34* 3108 /1027 10-10= 1,934 10-18 J = 12,086 eV
?E = E0 ( 1 / n2 - 1 / m2)
( 1 / n2 - 1 / m2) = DE / E0
Ici m = 3
( 1 / n2 - 1 / 9) = DE / E0
1 / n2 = 1 /9 + (DE / E0) = 1/9 + (12,086 /13,6) = 0,9998
n2 = 1 et n = 1
Exercice 5 :
L'énergie de première ionisation de l'atome d'hélium est 24,6 eV.
a) Quelle est l'énergie du niveau fondamental ?
E1 = -24,6 eV puisque l'énergie d'ionisation est l'énergie à fournir pour arracher l'électron du niveau fondamental pour l'ammener au niveau ionisé correspondant à n = ¥ .
b) Un atome d'hélium se trouve dans un état excité d'énergie -21,4 eV. Quelle est la longueur d'onde de la radiation émise quand il retombe au niveau fondamental ?
DE = 24,6 - 21,4 = 3,2 eV = 5,12 10-19 J
DE = h C / l è l = h C / DE = 6,62 10-34 * 3 108 / 5,12 10-19 = 3,88 10-7 m = 388 nm
Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com