Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com
SERIE 6 : LIAISONS POLARISEES - MOMENT DIPOLAIRES - LIAISONS HYDROGENE
Exercice 1 :
Soient les énergies de dissociation suivantes en kJ mol-1
H2 435 ; F2 155 ; Cl2 242 ; HF 566 ; HCl 431
Déterminer les électronégativités selon Pauling des atomes F et Cl.
On prendra k = 2,2 pour H.
H2 |
F2 |
Cl2 |
Br2 |
I2 |
HF |
HCl |
HBr |
HI |
|
E (eV) |
4,51 |
1,61 |
2,51 |
1,99 |
1,55 |
5,87 |
4,47 |
3,79 |
3,10 |
On sait que HF, HCl, HBr et HI sont tous des acides se dissociant en X- et H+, tous les halogènes sont donc plus électronégatif que H.
On peut calculer l'électronégativité de Pauling en utilisant soit la moyenne arithmétique, soit la moyenne géométrique.
Moyenne arithmétique : DX2 = EAB - 1/2 ( EAA+EBB )
DX2 |
DX |
X |
|
F |
2,81 |
1,68 |
3,88 |
Cl |
0,96 |
0,98 |
3,18 |
Br |
0,54 |
0,74 |
2,94 |
I |
0,07 |
0,26 |
2,46 |
Moyenne géométrique : DX2 = EAB - Ö (EAA EBB)
DX2 |
DX |
X |
|
F |
3,17 |
1,78 |
3,98 |
Cl |
1,10 |
1,05 |
3,25 |
Br |
0,80 |
0,89 |
3,09 |
I |
0,45 |
0,67 |
2,87 |
Les deux méthodes de calcul sont peu différentes mais c'est la moyenne géométrique qui est utilisée le plus fréquemment.
Exercice 2 :
Calculer les pourcentages ioniques des liaisons suivantes :
H ---- Cl m = 1,08 D d = 1,27 A°
H ---- Br m = 0,79 D d = 1,42 A°
H ---- I m = 0,38 D d = 1,61 A° (1 D = 0,333 10-29 C . m)
H ---- F |
m = 1,82 D |
d = 0,92 A° |
H ---- Cl |
m = 1,08 D |
d = 1,27 A° |
H ---- Br |
m = 0,79 D |
d = 1,42 A° |
H ---- I |
m = 0,38 D |
d = 1,61 A° |
m = d * d
d = m / d
d en Coulomb si m en C.m et d en m
%I = d / e * 100
m (D) |
d(A°) |
d = m / d (C) |
%I |
|
| H ---- F | 1,82 |
0,92 |
6,59E-20 |
41 |
| H ---- Cl | 1,08 |
1,27 |
2,83E-20 |
18 |
| H ---- Br | 0,79 |
1,42 |
1,85E-20 |
12 |
| H ---- I | 0,38 |
1,61 |
7,86E-21 |
5 |
Exercice 3 :
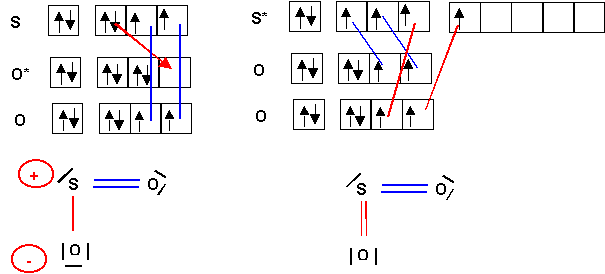
La molécule SO2 a une géométrie en V ; l’angle des deux liaisons S-O est de 119°. Son moment dipolaire mesuré est de 1,65 D (1 D = 0,333 10-29 C . m). Donner la structure de Lewis de cette molécule. Montrer qu’on peut la décrire par deux structures mésomères obtenues soit en " excitant " S, soit en " excitant " O. La longueur de liaison expérimentale est de 1,43 A°. Comparer à la valeur calculée. Conclusion ? Calculer le pourcentage d’ionicité de ces liaisons. Calculer les charges partielles portées par chaque atome.

La géométrie de la molécule est bien du type AX2E en forme de V avec un angle proche de 120°.
La valeur expérimentale de l'angle 119° est justifiée par la présence du doublet libre qui est pratiquement compensée par celles des deux doubles liaisons, l'effet du doublet libre l'emporte tout de même et l'angle est très légèrement inférieur à 120°.
Si on examine les deux formes mésomères on accordera un poids statistique plus important à la forme à deux doubles liaisons et non chargée puisqu'elle possède à la fois d'avantage de liaisons et moins de charges que l'autre forme.
Remarque : la règle de l'octet n'est pas respectée pour cette forme alors qu'elle l'est pour l'autre, mais cette règle ne s'applique strictement qu'aux éléments de la deuxième période ce qui n'est pas le cas du soufre.
On peut aussi s'intéresser à la longueur expérimentale des liaisons.
Z*S = 5,45 , n*S = 3 , Z*O = 4,55, n*O = 2 soit pour les longueurs des liaisons S - O :
Simple 1,72 A° - Double : 1,48 A° - Triple 1,34 A°
La longueur réelle de la liaison de 1,43 A° est légèrement plus courte que la valeur approchée calculée pour la liaison double SO. Cela est en accord avec l'hypothèse que la forme mésomère à doubles liaisons est bien la forme la plus représentative de la molécule réelle. Nous verrons que le raccourcissement observé peut être attribué à la forte polarité de la liaison SO.
Calcul des charges partielles et du pourcentage d'ionicité :
Les moments dipolaires des liaisons s'ajoutent vectoriellement, leur résultante est le moment dipolaire global de la molécule. Ici le moment dipolaire global est connu et nous cherchons le moment dipolaire partiel d'une liaison SO qui nous permettra ensuite de déterminer le pourcentage d'ionicité de la liaison.
Nous négligerons le moment dipolaire partiel du au doublet libre qu'il est impossible d'évaluer.
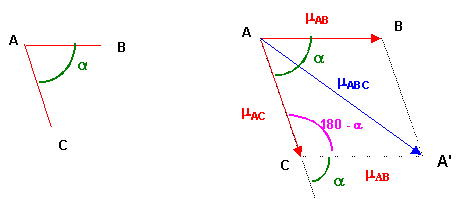
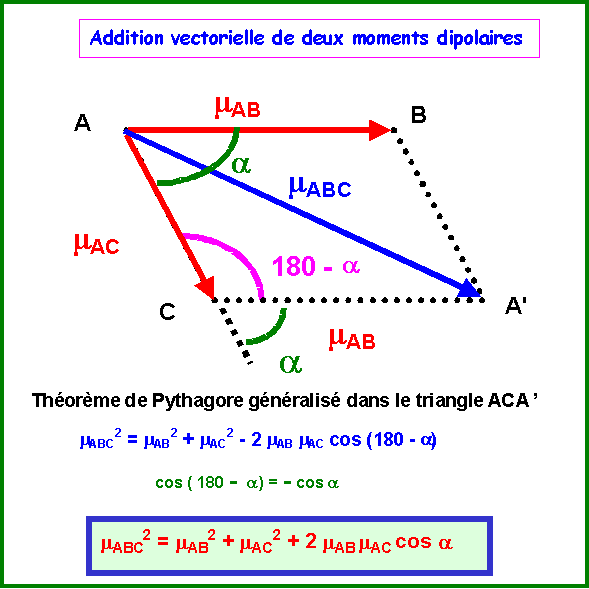
Théorème de Pythagore généralisé : Triangle ACA'
mABC2 = mAB2 + mAC2 - 2 mAB mAC cos (180 - a)
mABC2 = mAB2 + mAC2 + 2 mAB mAC cos a
Ici on à de plus mAB = mAC = mSO
mSO22 = mSO2 + mSO2 + 2 mSO mSO cos a
mSO22 = 2 mSO2 + 2 mSO2 cos a
mSO22 = 2 mSO2 ( 1 + cos a )
Soit mSO2 = mSO22 / 2 ( 1 + cos a )
Application numérique :
mSO2 = 1,652 / 2 ( 1 + cos 119 ) = 2,64
mSO = 1,625 D
%ISO = 20,8 * 1,625 / 1,43 = 23,6 %
Soit d = 0,24 e = 3,68 10-20 C
Cette liaison 24 % ionique est plus polarisée que la liaison H-Cl pour laquelle le pourcentage d'ionicité n'est que de 17 %, cette forte ionicité justifie le raccourcissement de la liaison observé.
Exercice 4 :
Sachant que le moment dipolaire partiel de liaison mN-O est de 0,15 D :
a) calculer le moment dipolaire global de l’ion NO3-.
b) calculer le moment dipolaire global de la molécule NO2 (a = 134°).
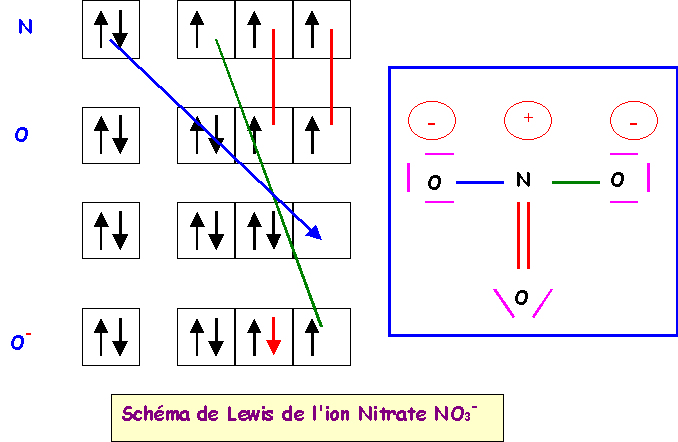
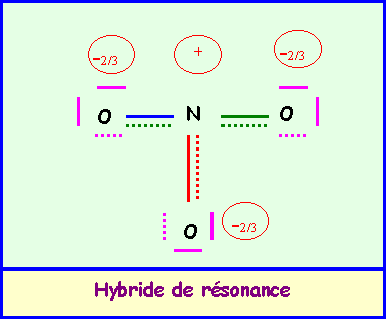
La géométrie de cet ion est du type AX3 parfaitement symétrique, triangle équilatéral parfait avec trois angles de 120° exactement. En raison de cette symétrie parfaite le moment dipolaire global de NO3- sera nul, en effet la résultante de deux des vecteurs mNO donne un vecteur exactement opposé au troisième vecteur mNO et il y a donc annulation du moment dipolaire global. Cela se voit facilement graphiquement mais on peut aussi le vérifier par le calcul.
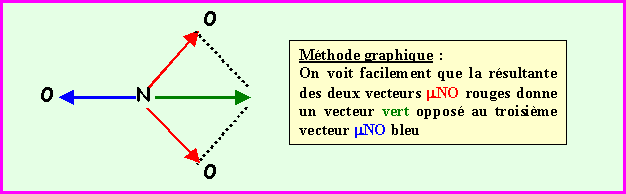
Dans notre cas : a = 120° et cos a = -0,5, de plus, mAB = mAC
mABC2 = mAB2 + mAC2 + 2 mAB mAC cos a
mABC2 = 2 mAB2 + 2 mAB2 * -0,5
mABC2 = 2 mAB2 - mAB2 = mAB2
mABC = mAB
On obtient bien un vecteur opposé au troisième è Résultante totale nulle.
b) calculer le moment dipolaire global de la molécule NO2 (a = 134°).
Dans ce cas : a = 134° et cos a = -0,695, de plus, mAB = mAC
mABC2 = mAB2 + mAC2 + 2 mAB mAC cos a
mABC2 = 2 mAB2 + 2 mAB2 cos a = 2 mAB2 ( 1 - cos a )
mABC2 = 2 * 0,15 * ( 1 + 0,695 ) = 0,5085
mABC = 0,713 D
mNO2 = 0,713 D
Exercice 5 :
Le moment dipolaire du mono-sulfure de carbone CS est de 1,98 D et la longueur de liaison est de 1,53 A°.
a) Vérifier par le calcul la longueur de liaison expérimentale
b) Calculer la charge partielle portée par chaque atome.
c) Calculer le caractère ionique partiel de la liaison C- S .
Formule de calcul des longueurs de liaisons :
Simple liaison : L (A°) = 0,239 S (n*2/Z*) + 0,164 S n* + 0,297
double = 86% de la simple - triple = 78% de la simple
Calcul de Z*C
C : 1 s2 - 2s2 2p2
Z*C = 6 - ( 3 * 0,35 ) - ( 2 * 0,85 ) = 3,25
soit n*2 / Z* = 4 / 3,25 = 1,2308
Calcul de Z*S
S : 1 s2 - 2s2 2p6 - 3 s2 3 p4
Z*C = 16 - ( 5 * 0,35 ) - ( 8 * 0,85 ) - ( 2 * 1 ) = 5,45
soit n*2 / Z* = 9 / 5,45 = 1,6514
Calcul de la longueur de liaison simple CS :
L (A°) = 0,239 S (n*2/Z*) + 0,164 S n* + 0,297
L (A°) = 0,239 ( 1,2308 + 1,6514 ) + 0,164 ( 2 + 3 ) + 0,297 = 1,806 A°
Simple liaison CS : 1,806 A°
Double liaison CS : 0,86 * 1,806 = 1,553 A°
Triple liaison CS : 0,78 * 1,806 = 1,409 A°
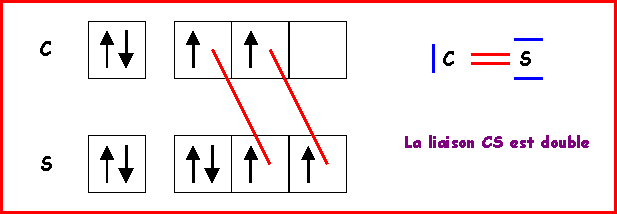
La longueur de liaison CS doit donc être proche de 1,55 A°
La longueur expérimentale est de 1,53 A°
soit un écart de (1,55 - 1,53 ) / 1,53 = 0,015 soit 1,5 %.
Remarque : On peut éventuellement faire intervenir une forme mésomère à triple liaison, ce qui raccourcirait la liaison. Mais des charges sont alors présentes et de plus en désaccord avec l'électronégativité légèrement supérieure de S. Bien que respectant la règle de l'octet cette forme mésomère semble donc avoir un très faible poids statistique. La liaison réelle doit donc être très proche de la double liaison.
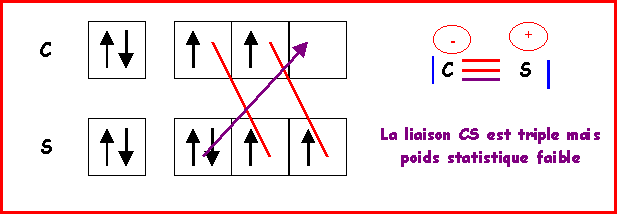
b) Calculer la charge partielle portée par chaque atome.
m = 1,98 D = 1,98 * 0,333 10-29 = 6,59 10-30 C . m
m = d * d
d = m / d = 6,59 10-30 / 1,53 10-10 = 4,309 10-20 C = 0,27 e
c) Calculer le caractère ionique partiel de la liaison C- S .
La liaison est à 27 % ionique.
Remarque :
On trouve un pourcentage d'ionicité très élevé, or C et S ont des électronégatvités très proche (XC =2,55 et XS = 2,58) la liaison devrait donc être faiblement polarisée et le moment dipolaire faible. Ce paradoxe peut être en partie expliqué par la présence de doublets libres qui possèdent un moment dipolaire propre dont on n'a pas tenu compte dans le calcul. Le moment dipolaire de la molécule est donc en réalité différent de celui de la liaison C-S et on ne peut donc déduire le pourcentage d'ionicité de la liaison C-S aussi simplement.
Dans la pratique on est souvent amené à négliger les moments dipolaires dus aux doublets libre ce qui peut parfois fausser les résultats.
Exercice 6 :
Quel moment dipolaire peut on attribuer au chloroforme CHCl3 sachant que les moments partiels de liaisons sont mCH = 0,4 D et mCCl = 1,5 D
CHCl3 présente une géométrie tétraédrique de type AX4
Orientons d'abord les vecteurs moment dipolaire de liaison :
Classement des atomes par ordre d'électronégativité croissante : H < C < Cl
Liaison C-H : Vecteur mCH dirigé de H vers C
Liaison C-Cl : Vecteur mCCl dirigé de C vers Cl
On pourrait chercher à résoudre géométriquement le problème par addition vectorielle successives, mais il est plus simple de tenir compte des simplifications pour raison de symétrie.
Pour des raisons de symétrie (voir figure) les molécules de type AX4 comme CCl4 ne possèdent pas de moment dipolaire permanent, en effet les moments dipolaires partiels des liaisons C- Cl s'annulent deux à deux et le moment global résultant est nul.
On peut donc considérer simplement que l'addition vectorielle de 3 moments de liaisons C-Cl donne un vecteur exactement opposé a moment dipolaire de la quatrième liaison C-Cl
On peut donc remplacer 3 vecteurs mCCl par un seul opposé au 4ème.
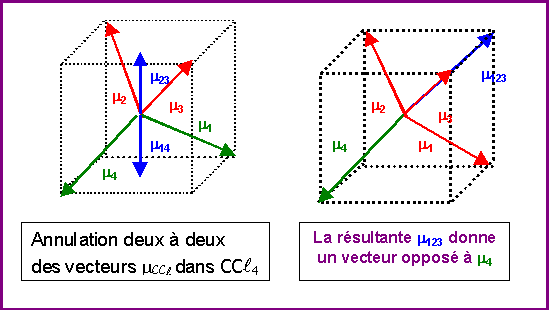
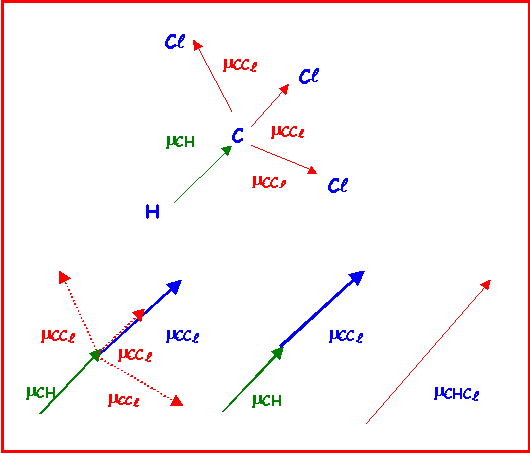
On peut utiliser cette propriété pour calculer facilement le moment dipolaire global de CHCl3.
On suppose pour simplifier que CHCl3 à une géométrie tétraédrique parfaite.
On remplace les trois vecteurs mCCl par un seul vecteur de même norme et dont on sait qu'il se trouve dans le prolongement du vecteur mCH. Le moment global est la somme de ces deux vecteurs colinéaires et de même sens.
Soit mCHCl3 = mCH + mCCl = 0,4 + 1,5 = 1,9 D
Exercice 7
La molécule d'eau possède un moment dipolaire global m H2O = 1,845 D.
L’angle des liaisons O-H dans la molécule d’eau étant de 104,5 ° et la longueur de la liaison O - H de 0,95 A°.
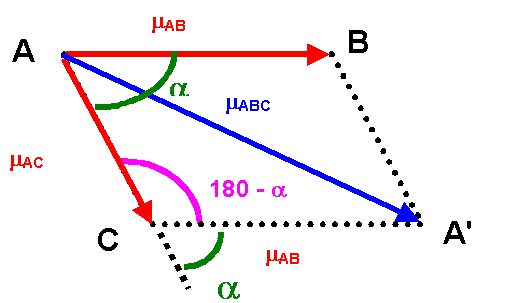
mABC2 = mAB2 + mAC2 + 2 mAB mAC cos a
mH2O2 = mOH2 + mOH2 + 2 mOH mOH cos a
mH2O2 = 2 mOH2 (1+ cos a)
mOH2 = mH2O2 / 2 (1+ cos a)
mOH2 = 1,8452 / 2 (1+ cos 104,5 = 2,27
mOH = 1,51 D = 5,018 10-30 C.m
m = d * d
d = m / d = 5,018 10-30 / 0,95 10-10 = 5,28 10-20 C = 0,33 e
La liaison OH est ionique à 33%
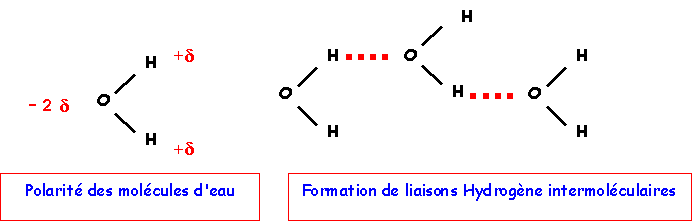
Il a pour autre conséquence que les points d'ébullition et de fusion de l'eau sont anormalement élevés. Justifier ce fait expérimental.
Dans l'eau, il existe des liaisons Hydrogène inter moléculaires qui unissent les molécules entre elles. Les point d'ébullition et de fusion sont donc fortement augmentés.
Exercice 8 : Acide maléïque et acide fumarique
Ces deux composés isomères ont la même formule brute C4H4O4 et présentent les structures suivantes :
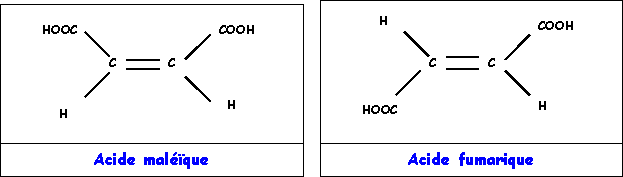
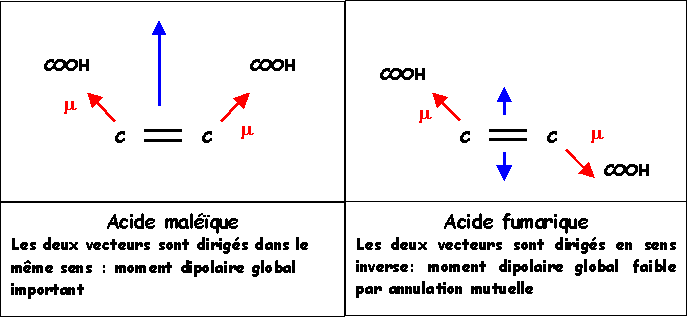
2) Solubilité dans l'eau des acides maleïque et fumarique
Sachant que les molécules polaires sont très solubles dans les solvant polaires alors que les substances peu polaires le sont beaucoup moins, prévoir lequel des deux acides maleïque ou fumarique est le plus soluble dans l'eau.
L'acide maléique polaire sera le plus soluble dans l'eau.
3) Point de fusion des acides maleïque et fumarique
L'un de ces deux acides possède un point de fusion de 130°C et l'autre un point de fusion de 226°C. Justifiez cette forte différence et attribuez son point de fusion à chaque isomère.
Il existe ici des liaisons Hydrogène intramoléculaires dans l'acide maléique qui n'existent pas pour l'acide fumarique. Ces liaisons intramoléculaires provoquent un fort abaissement des températures de changement d'état. Les liaisons se faisant à l'intérieur de la même molécule, les molécules sont plus individualisées. Inversement l'éxistence de liaison inter-moléculaires (entre molécules différentes) dans l'acide fumarique augmente ses températures de changement d'état.
Acide maléique : liaisons H intra-moléculaires è Point de Fusion abaissé Tf = 130°C
Acide fumarique : liaisons H inter-moléculaires è Point de Fusion élevé Tf = 226°C
4) Constantes d'acidité des acides maleïque et fumarique
L'un des deux isomères possède les pKa suivants : pK1 = 3 et pK2 = 4,4
L'autre isomère possède les pKa suivants : pK1 = 1,9 et pK2 = 6,2
On voit que l'un des deux composés possède simultanément le pK1 le plus petit et le pK2 le plus grand. Justifier ce fait expérimental par un/des schéma(s).
Attribuer a chaque isomère les valeurs de ces deux pKa.
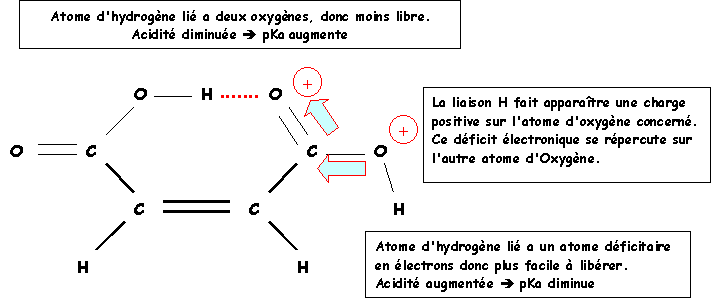
L'acide maléique à liaison Hydrogène intramoléculaire possède à la fois le pK1 le plus petit et le pK2 le plus élevé.
Acide maléïque : pK1 = 1,9 et pK2 = 6,2
Acide fumarique : pK1 = 3 et pK2 = 4,4
Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com