Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com
SERIE 8 : Recouvrement et Hybridation des Orbitales Atomiques - Orbitales Moléculaires - Modèle C.L.O.A - O.M - Mesomérie
Exercice 1 :
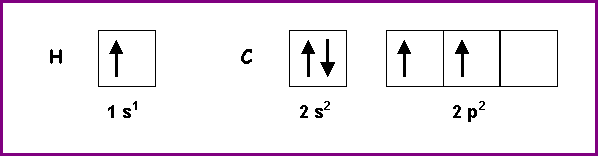
Pour l’atome de Carbone et l’atome d’Hydrogène
H : Z = 1 - 1 s1
C : Z = 6 - 1 s1 2 s2 2 p2

- Quel composé devrait se former entre ces deux atomes si on considérait simplement le recouvrement de leurs orbitales atomiques de valence dans leur état fondamental?
Le Carbone est divalent et l'Hydrogène monovalent, il devrait donc se former le composé de formule CH2
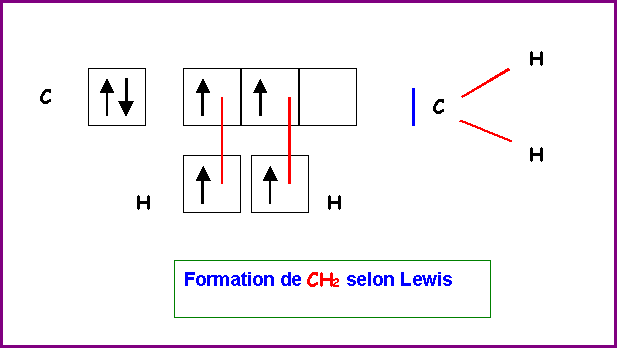
En réalité ce composé est très instable et n’existe pas à l'état naturel.
Le composé naturel le plus simple entre ces deux atomes est le méthane de formule CH4.
On peut utiliser l'état excité 2 s2 - 2 p2 de l'atome de Carbone pour augmenter sa valence et former quatre liaisons avec quatre atomes d'Hydrogène.

Les recouvrements se font de la manière suivante :
1) Orbitale 2 s de C / Orbitale 1 s de H :
Recouvrement axial - Liaison de type s
Les deux orbitales utilisées étant toutes deux de symétrie sphérique, la liaison C-H ainsi formée peut être orientée de façon tout a fait quelconque cette liaison n'a donc pas de direction particulière.
2) Orbitale 2 px de C / Orbitale 1 s de H :
Recouvrement axial - Liaison de type s
Pour obtenir un recouvrement maximal, la liaison C-H ainsi formée pointe dans la même direction que l'orbitale px.
3) Orbitale 2 py de C / Orbitale 1 s de H :
Recouvrement axial - Liaison de type s
Pour obtenir un recouvrement maximal, la liaison C-H ainsi formée pointe dans la même direction que l'orbitale py.
4) Orbitale 2 pz de C / Orbitale 1 s de H :
Recouvrement axial - Liaison de type s
Pour obtenir un recouvrement maximal, la liaison C-H ainsi formée pointe dans la même direction que l'orbitale pz.
On a donc finalement pour CH4 :
Une liaison "non dirigée" et trois liaisons pointant à angles droit dans les trois directions x,y,z.

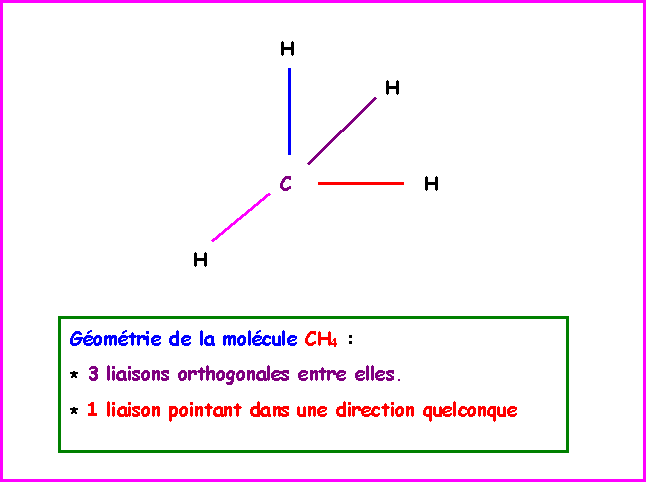
La géométrie réelle du Méthane est tétraédrique.
Cela peut être prévu par la méthode R.P.E.C.V ( ou V.S.E.P.R ou méthode de Gillespie) puisque la molécule est du type AX4.
L'hybridation conduisant à la géométrie tétraédrique ( AX4 ; AX3E ; AX2E2 ; AXE3 ) est l'hybridation de type sp3.
Exercice 2 :
Décrire la géométrie, l’hybridation des atomes de carbone et les liaisons dans les molécules suivantes :
CH2=CH2 , HCOOH , HCHO , CH2 = C =CH2
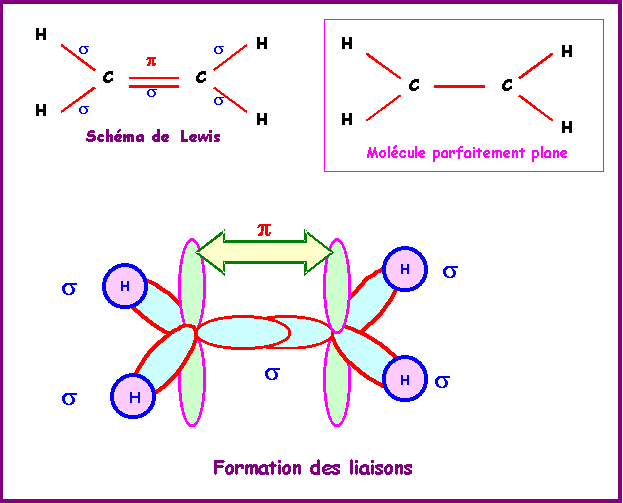
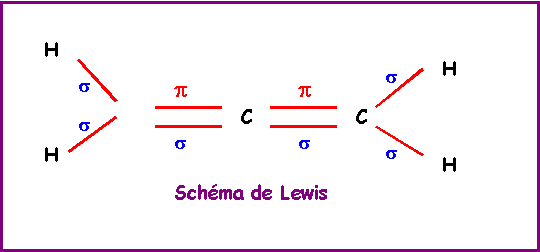
Ethylène : CH2 = CH2
La géométrie autour des deux atomes de Carbone est du type AX3 soit une hybridation trigonale de type sp2. La méthode R.P.E.C.V prévoit une géométrie basée sur deux triangles équilatéraux mais ne dit rien sur la co-planéité ou non de ces deux triangles. Le modèle quantique en revanche prévoit une planéité totale de la molécule. En effet les deux orbitales p ne peuvent se recouvrir latéralement pour donner la liaison p que si elles sont parfaitement parallèles entre elles. Les orbitales sp2 doivent donc toutes être dans le même plan.
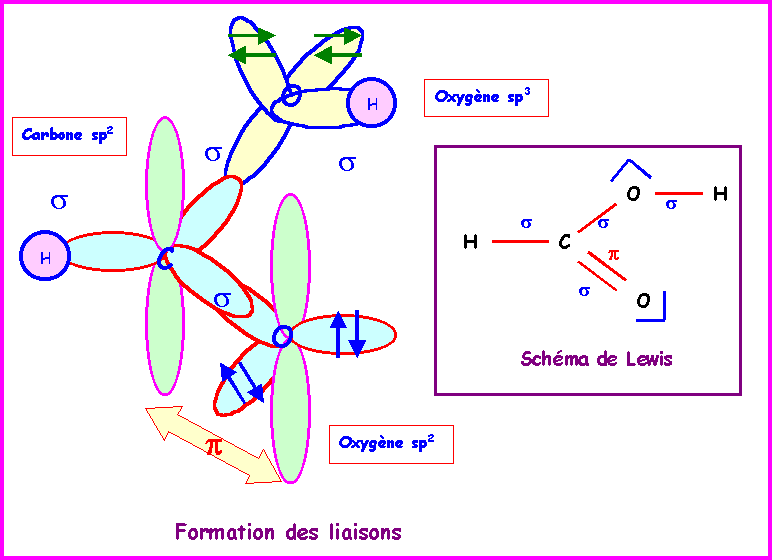
Acide méthanoïque : HCOOH
Le schéma de Lewis de la molécule montre que la géométrie est du type AX3 autour du carbone et AX2E2 autour de l'oxygène porteur de l'atome d'hydrogène. Enfin, on peut considérer qu'elle est du type AXE2 autour de l'autre atome d'oxygène.
On a donc des hybridations du type :
sp2 pour C
sp3 pour le O de OH
sp2 pour le O de C=O
Pour simplifier le problème nous ne tiendrons compte que de la forme mésomère principale et nous négligerons la conjugaison (voir série 1).
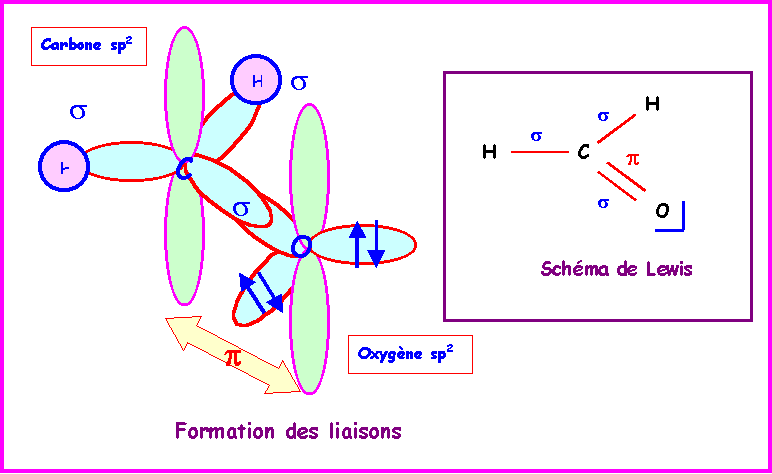
Méthanal : HCHO
Le Carbone central est hybridé sp2 pour une géométrie trigonale de type AX3, la molécule est plane.
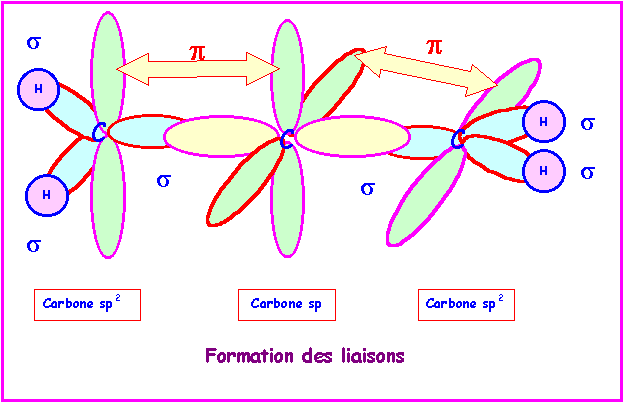
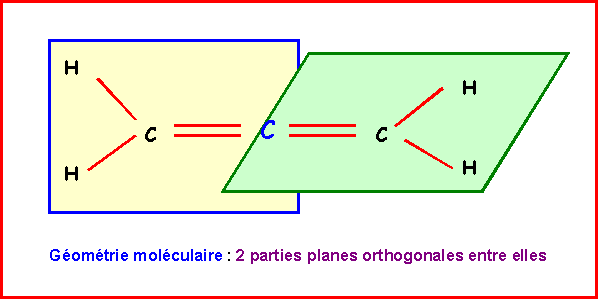
Allène : CH2 = C = CH2
Atome |
CH2 |
= C = |
CH2 |
Géométrie |
AX3 |
AX2 |
AX3 |
Hybridation |
sp2 |
sp |
sp2 |
Les deux doubles liaisons sur le même atome de Carbone imposent deux parties planes contenues dans deux plans perpendiculaires entre eux.
Exercice 3 :
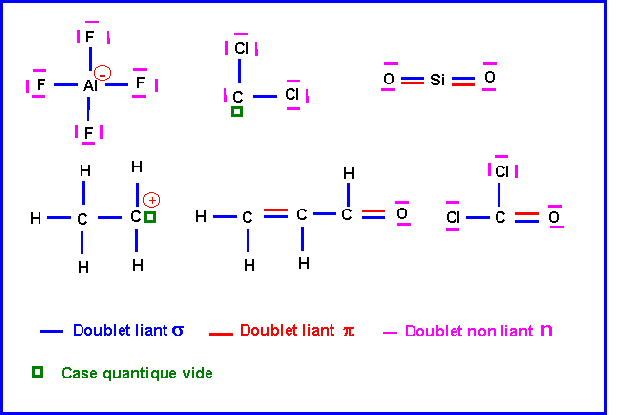
Dans les structures suivantes dénombrer les doublets liants s ou p, les doublets non liants n, et les cases vides présents dans les couches de valence.
AlF4- - CCl2 - SiO2 - CH3-CH2+ - CH2=CH-CH=O - COCl2
Exercice 4 :
On s’intéresse aux molécules O2 et S2.
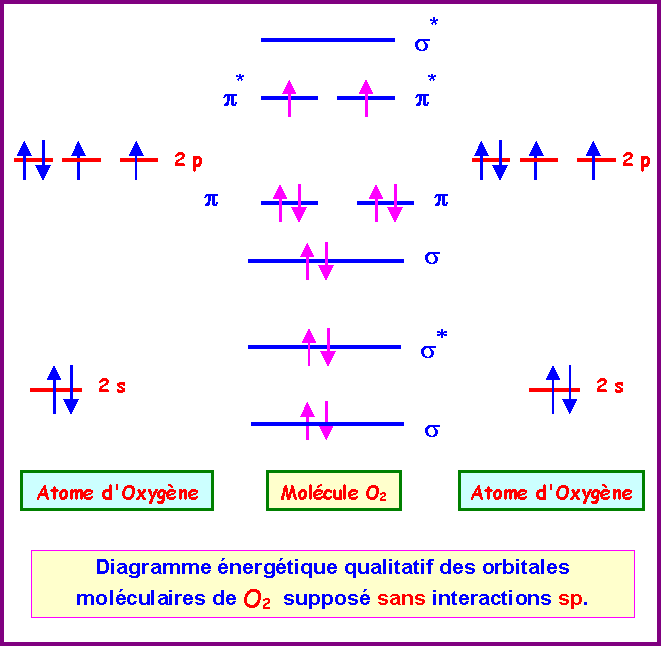
Si on suppose que O2 est avec interactions sp :
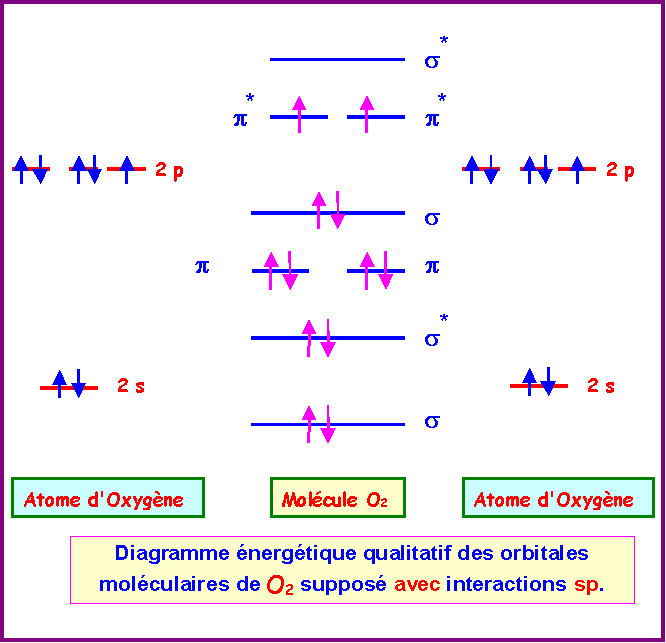
La molécule O2 est donc paramagnétique.
Remarque :
Les deux diagrammes (avec ou sans interactions sp) sont en fait très peu différents.
Ordre des O.M :
Sans interactions : s - s* - s - p p - p* p* - s*
Avec interactions : s - s* - p p - s - p* p* - s*
Pour que les deux types de remplissage conduisent à des différences notables il faut que le nombre d'électrons a placer dans les O.M soit compris entre 5 et 9.
Parmi les molécules diatomiques homonucléaires seules Be2 et C2 conduiront à des différences marquées selon le type de remplissage utilisé.
Dans le modèle de Lewis les électrons sont toujours associés par paires, sauf bien entendu, s'ils sont en nombre impair.
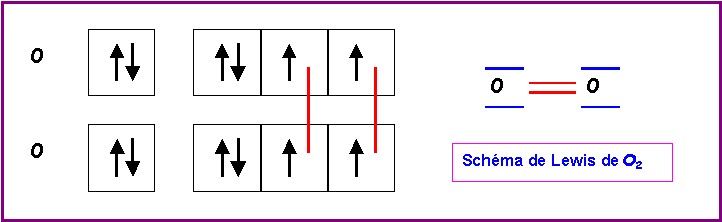
Il n'apparaît pas d'électrons célibataires dans le schéma de Lewis de O2 qui semble donc être diamagnétique.
d) Pour la molécule S2 et les ions moléculaires correspondants (S2+; S22+ ; S2- ; S22-) on trouve les résultats suivants pour les distances de liaisons S-S :
d S-S (A°) 1,72 1,79 1,88 2 2,20
Attribuer à chaque espèce sa longueur de liaison.
S et O appartiennent à la même colonne de la classification périodique.
Nous supposerons que les orbitales atomiques 3 d de S n'interviennent pas dans la formation des liaisons dans S2.
Leurs orbitales atomiques sont donc similaires et le diagramme des orbitales moléculaires de S2 est semblable à celui de O2 établi précédemment.
Nous avons vu plus haut que les diagrammes avec ou sans interaction conduiront aux même conclusions puisque seules les molécules Be2 et C2 conduisent à des différences notables. On sait d'autre part que O2 est en fait sans interactions sp à cause de l'écart énergétique important entre les niveaux 2s et 2p.
Nous supposerons qu'il en est de même pour S2 et nous utiliserons donc le diagramme sans interactions sp.
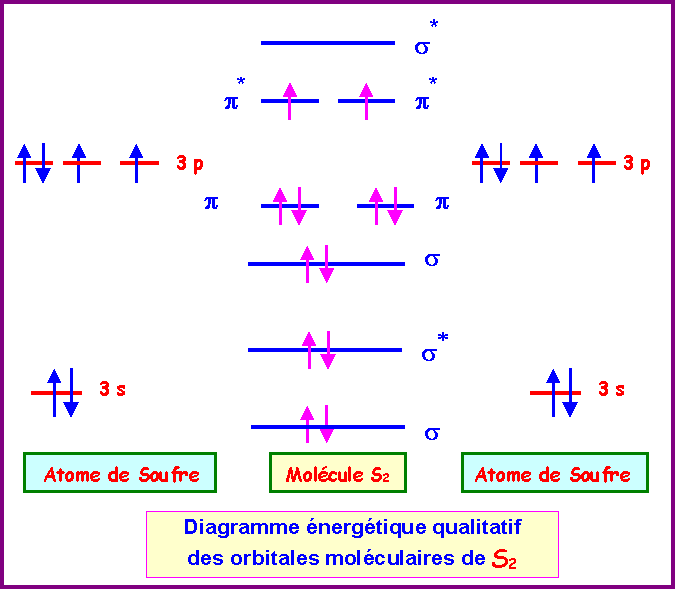
La configuration électronique de S2 peut s'écrire :
s12 - s1*2 - s22 - p12 - p22 - p1*1 - p2*1 - s2*0
Le dernier niveau occupé est un niveau anti-liant de type p*.
Il contient 2 électrons et peut encore en recevoir deux autres.
Si on ajoute 1 ou 2 électrons à la molécule S2 pour former S2- et S22- les deux électrons ajoutés viendront finir de remplir ce niveau anti-liant.
Cela déstabilisera la molécule, l'indice de liaison diminuera et la longueur de liaison S-S augmentera.
nl = 1/2( n - n*)
Pour S2 : nl = 1/2( n - n*) = 1/2 ( 8 - 4 ) = 2
Pour S2- : nl = 1/2( n - n*) = 1/2 ( 8 - 5 ) = 1,5
Pour S22- : nl = 1/2( n - n*) = 1/2 ( 8 - 6 ) = 1
Si on enlève 1 ou 2 électrons à la molécule S2 pour former S2+ et S22+ les deux électrons enlevés partiront de ce niveau anti-liant.
Cela stabilisera la molécule, l'indice de liaison augmentera et la longueur de liaison S-S diminuera.
nl = 1/2( n - n*)
Pour S2 : nl = 1/2( n - n*) = 1/2 ( 8 - 4 ) = 2
Pour S2+ : nl = 1/2( n - n*) = 1/2 ( 8 - 3 ) = 2,5
Pour S22+ : nl = 1/2( n - n*) = 1/2 ( 8 - 2 ) = 3
Il est donc facile d'attribuer les diverses longueurs de liaisons aux diverses espèces :
S22+ |
S2+ |
S2 |
S2- |
S22- |
|
Indice de liaison |
3 |
2,5 |
2 |
1,5 |
1 |
d S-S (A°) |
1,72 |
1,79 |
1,88 |
2 |
2,20 |
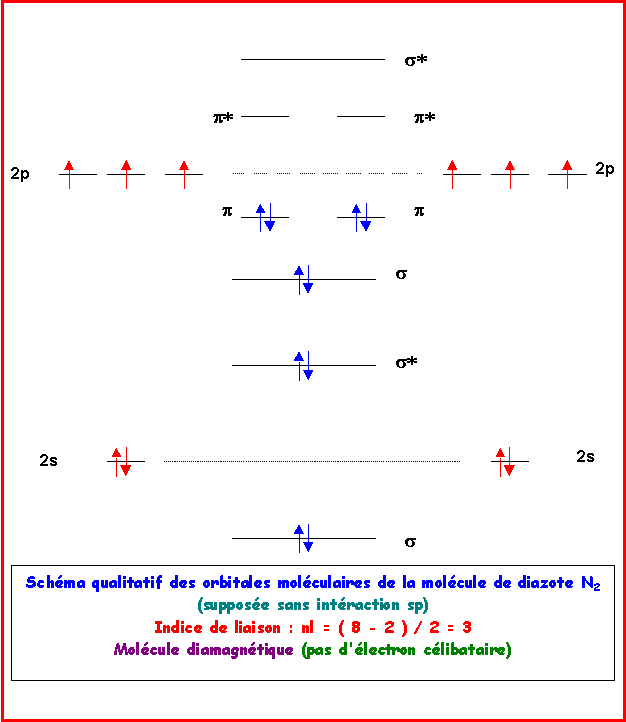
Exercice 5: Le Diazote N2
Décrire la molécule de diazote N2 dans le modèle C.L.O.A - OM. On précisera l'indice de liaison et on indiquera si ce composé est paramagnétique ou diamagnétique ?
Remarque : Qu'il y ait ou non intéraction sp le résultat est identique.
Exercice 6
On donne les énergies des orbitales atomiques des atomes de carbone et d’oxygène exprimées en eV.
Carbone : 1s (-307 eV) ; 2s (-19 eV) ; 2p (-11,7 eV)
Oxygène : 1s (-560 eV) ; 2s (-33,7 eV) ; 2p (-17,1 eV)
1) Molécules C2 et O2
a) Construire sur un même graphique les diagrammes énergétiques de C et O.
b) Pour une de ces molécules il y a une forte interaction sp. Laquelle ?
c) L’interaction sp est négligeable pour l’autre. Laquelle ?
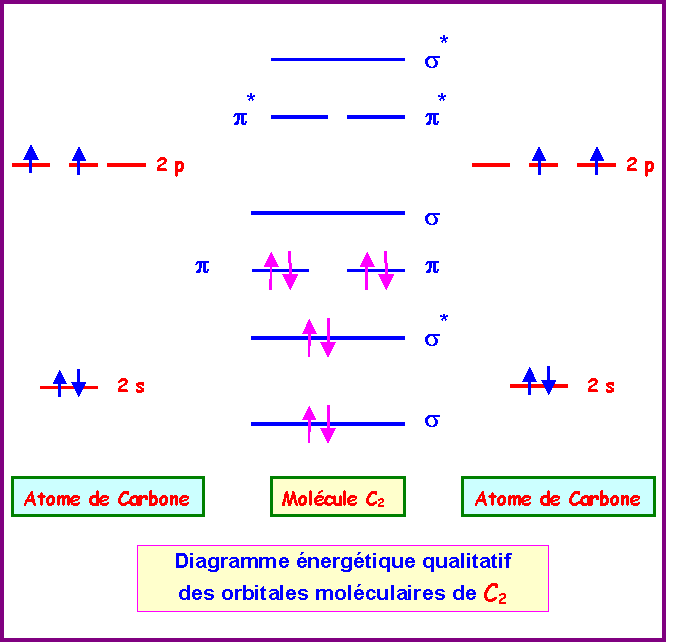
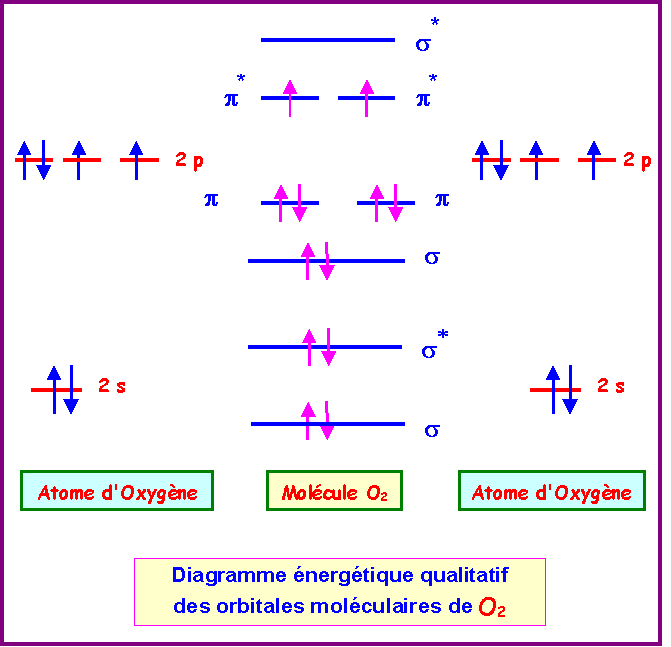
d) Construire le diagramme des Orbitales moléculaires de C2 et de O2.
e) Ces deux molécules peuvent donner chacune un cation et un anion. Quand on observe les longueurs de liaisons on trouve :
dO2- > dO2 > dO2+ et dC2+ > dC2 > dC2-
Justifier ces résultats.
f) Dans la série O2 , O2+ et O2- quelle est la molécule dont l’énergie de dissociation est la plus élevée? Pourquoi?
2) Molécule CO
On donne les énergies des O.M de CO en eV :
-560 (1 s) ; -307 (2 s) ; -40,5 (3 s) ; -19,9 ( 4 s) ; -15,8 (1 p) ; -13,5 (5 s) ; 7,1 (2 p) ; 25,3 (6 s)
a) Construire le diagramme des O.M correspondant.
b) Quand on passe de CO à CO+, la distance de liaison ne varie pratiquement pas. Justifiez ce résultat expérimental.
Molécules C2 et O2
Seules les orbitales de valence sont prises en compte, les électrons de cœur n'intervenant pas dans les propriétés chimiques.
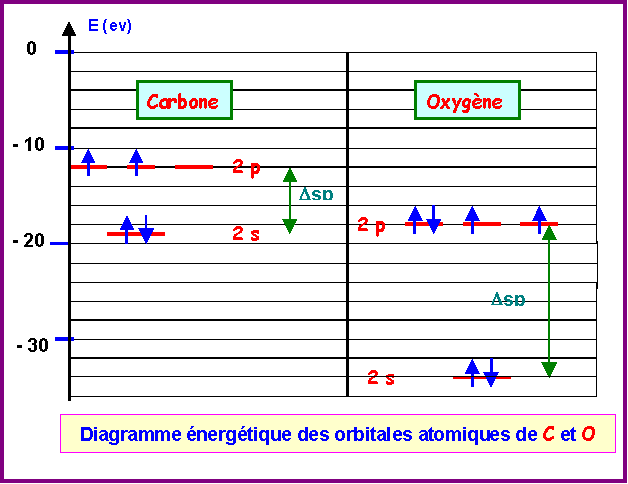
Les interactions sp seront importantes pour C2 et négligeables pour O2.
En effet, l'écart Dsp est faible dans le cas du Carbone ( Dsp = 19 -11,7 = 7,3 eV) et important dans le cas de l'Oxygène ( Dsp = 33,7 -17,1 = 16,6 eV).
e)
Cas de O2
La configuration électronique de O2 peut s'écrire :
s12 - s1*2 - s22 - p12 - p22 - p1*1 - p2*1 - s2*0
L'indice de liaison dans O2 est de :
nl = 1/2( n - n*) = 1/2 ( 8 - 4 ) = 2
Si on ajoute un électron pour former O2- l'électron supplémentaire se placera sur le premier niveau vacant (non complètement occupé) c'est à dire ici p1*.
L'ajout d'un électron sur un niveau anti liant déstabilise la molécule, cela se traduit par une diminution de l'énergie de dissociation et à une augmentation de la longueur de la liaison. On peut vérifier cela en calculant l'indice de liaison dans O2-.
nl = 1/2( n - n*) = 1/2 ( 8 - 5 ) = 1,5
Si on enlève un électron pour former O2+ l'électron partant sera celui de plus haute énergie c'est à dire situé sur le dernier niveau occupé, ici p1* ( ou p2* ) .
Le départ d'un électron sur un niveau anti liant stabilise la, cela se traduit par une augmentation de l'énergie de dissociation et à une diminution de la longueur de la liaison.
On peut vérifier cela en calculant l'indice de liaison dans O2+.
nl = 1/2( n - n*) = 1/2 ( 8 - 3 ) = 2,5
Finalement on retrouve bien l'ordre des longueurs de liaison :
d O2+ < dO2 < d O2-
Règles :
Plus une liaison est forte (indice de liaison élevé) et plus sa longueur est courte.
Plus une liaison est faible (indice de liaison faible) et plus sa longueur est grande.
Cas de C2
La configuration électronique de C2 peut s'écrire :
s12 - s1*2 - p12 - p22 - s20 - p1*0 - p2*0 - s2*0
L'indice de liaison dans C2 est de :
nl = 1/2 ( n - n* ) = 1/2 ( 6 - 2 ) = 2
Si on ajoute un électron pour former C2- l'électron supplémentaire se placera sur le premier niveau vacant (non complètement occupé) c'est à dire ici s2.
L'ajout d'un électron sur un niveau liant stabilise la molécule, cela se traduit par une augmentation de l'énergie de dissociation et à une diminution de la longueur de la liaison. On peut vérifier cela en calculant l'indice de liaison dans C2-.
nl = 1/2( n - n*) = 1/2 ( 7 - 2 ) = 2,5
Si on enlève un électron pour former C2+ l'électron partant sera celui de plus haute énergie c'est à dire situé sur le dernier niveau occupé, ici p1( ou p2 ) .
Le départ d'un électron sur un niveau liant déstabilise la molécule, cela se traduit par une diminution de l'énergie de dissociation et à une augmentation de la longueur de la liaison. On peut vérifier cela en calculant l'indice de liaison dans C2+.
nl = 1/2( n - n*) = 1/2 ( 5 - 2 ) = 1,5
Finalement on retrouve bien l'ordre des longueurs de liaison :
d C2+ > d C2 > d C2-
Règles :
Plus une liaison est forte (indice de liaison élevé) et plus sa longueur est courte.
Plus une liaison est faible (indice de liaison faible) et plus sa longueur est grande.
f) Par le même raisonnement on trouve que l'ordre croissant de stabilité est :
O2- < O2 < O2+
Plus une molécule est stable et plus son énergie de dissociation D est élevée donc :
D O2- < D O2 < D O2+
Règles :
Plus une liaison est forte (indice de liaison élevé) et plus son énergie de dissociation est élevée.
Plus une liaison est faible (indice de liaison faible) et plus son énergie de dissociation est faible.
2) Molécule CO :
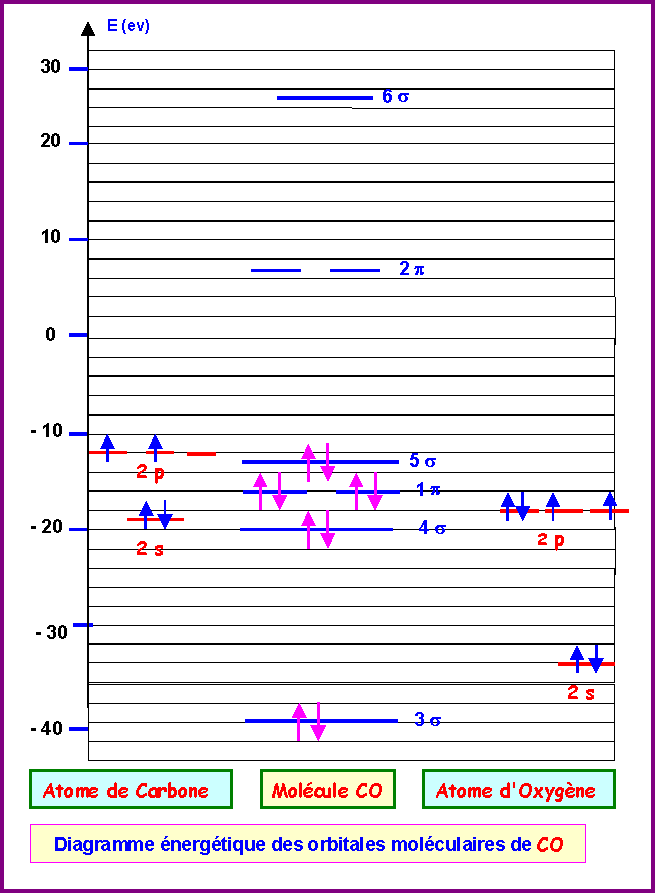
Attribution des caractères liant ou anti-liant aux diverses orbitales moléculaires :
Le modèle qualitatif décrit dans le cours pour les molécules homo-nucléaires est un peu trop simpliste pour pouvoir décrire correctement toutes les molécules. Des calculs très complexes sont en réalité nécessaires pour cela. Nous n'aborderons pas ici de tels calculs, nous allons tout de même voir "qualitativement" dans ce cas les modifications qu'on peut y apporter.
On reconnaît le schéma typique d'une molécule avec interactions sp par l'ordre d'apparition des diverses orbitales moléculaires:
3s - 4s - 1p - 5s - 2p - 6s
A priori on doit donc avoir les caractères suivants :
3 s: orbitale liante (contient 2 électrons)
4s : orbitale anti-liante (contient 2 électrons)
1p : orbitale liante (contient 4 électrons)
5s : orbitale liante (contient 2 électrons)
2p : orbitale anti-liante (contient 0 électrons)
6s : orbitale anti-liante (contient 0 électrons)
S'il en est ainsi l'indice de liaison de CO est de :
nl = 1/2( n - n*) = 1/2 ( 8 - 2 ) = 3
Le dernier niveau occupé 5s est un niveau liant et si on arrache un électron pour former CO+ on déstabilise la molécule, l'indice de liaison diminue et la longueur de liaison devrait donc augmenter.
Pour CO+ : nl = 1/2( n - n*) = 1/2 ( 7 - 2 ) = 2,5
En fait, la longueur de liaison reste pratiquement inchangée. Cela s'explique par le fait que les orbitales moléculaires ne sont pas toujours franchement liantes (ou anti-liantes). Si leur énergie est très proche des énergies des orbitales atomiques, la stabilisation (ou la déstabilisation) sont en pratique très faibles.
Ainsi, l'orbitale 5s n'est en réalité que très faiblement liante, le fait d'enlever un électron de cette orbitale ne va donc que très peu déstabiliser la molécule et la longueur de liaison ne va en fait que très faiblement varier.
Exercice 7 :
La molécule de monoxyde d’azote NO est paramagnétique.
Cette molécule possède un nombre impair d'électrons, il s'agit d'un Radical.
L'électron célibataire est représenté par un point.
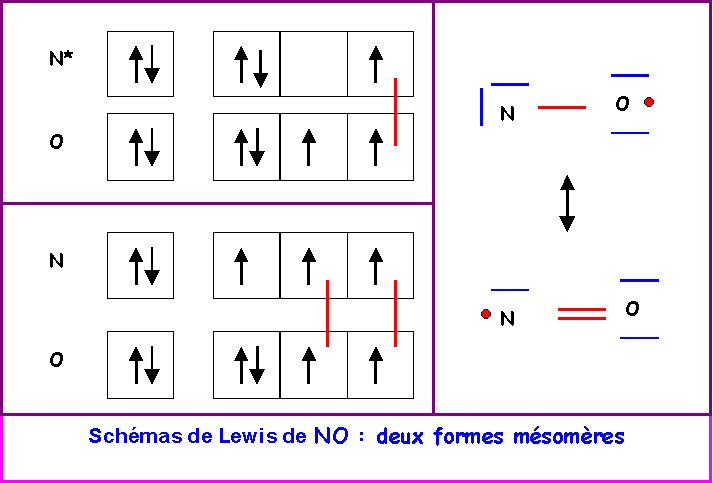
La molécule possédant un électron célibataire est donc bien paramagnétique.
(on supposera qu’il y a intéraction s-p)
L'atome d'Oxygène étant plus électronégatif que l'atome d'Azote ces niveaux énergétiques sont plus bas.
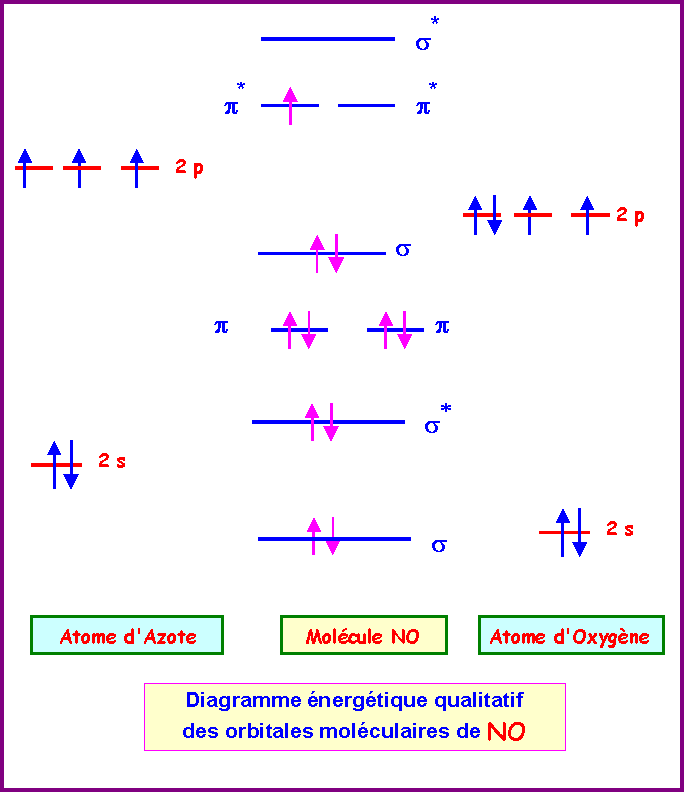
Il y a bien un électron célibataire (sur un niveau p*), la molécule est donc bien paramagnétique.
On utilise la formule approchée de calcul des longueurs de liaisons.
R (A°) = 0,215 (n*2/Z*) + 0,148 n* + 0,225
dA-B = 1,11 dCalc - 0,203
Liaison double = 86 % de la simple - Liaison triple = 78% de la simple
On obtient :
Z*N = 3,9
n*N = 2
RN = 0,742 A°
Z*O = 4,55
n*O = 2
RO = 0,71 A°
LNO Simple : 1,41 A° - LNO Double : 1,21 A° - LNO Triple : 1,10 A°
La longueur expérimentale de 1,15 A° est intermédiaire entre la double et la triple liaison.
Le calcul de l'indice de liaison confirme ce calcul approché :
nl = 1/2 ( 8 - 3 ) = 2,5
L'ionisation de NO en NO+ correspond à l'enlèvement d'un électron anti-liant et stabilise donc la molécule.
L'ion NO+ est donc facile à obtenir.
On remarque que NO+ est iso-électronique de N2 (10 électrons) sont indice de liaison est 3.
La liaison N-O sera plus courte dans NO+ que dans NO.
Exercice 8 : La molécule d'éthylène C2H2
a) Expliquer grâce à un schéma clair la formation des liaisons dans la molécule d'éthylène par recouvrement d'orbitales atomiques hybrides dont on précisera la nature. Indiquez le type (s ou p) des liaisons obtenues.
b) Expliquer pourquoi si l'on substitue deux hydrogènes (situés sur deux carbones différents) par un groupe quelconque X il existe deux isomères bien distincts.
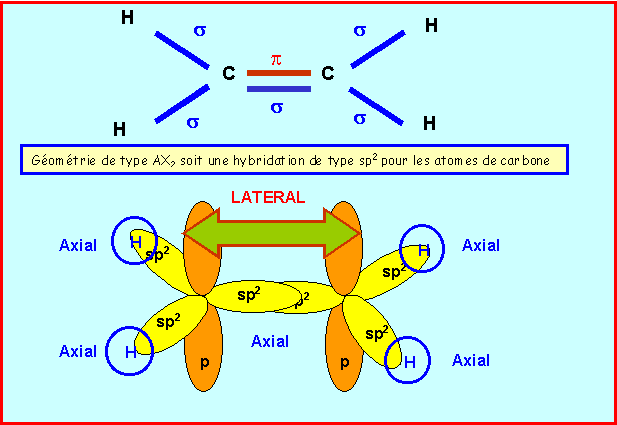
Pour que la liaison p puisse se former, il faut que les orbitales sp2 soient coplanaires entre elles. Il n'y donc pas de libre rotation autour de la double liaison C=C, ce qui entraîne l'existence de l'isomérie E,Z.
Exercice 9 :
On s’intéresse à la géométrie de la molécule de prop-2-énal :
CH2 = CH - CHO
a) en appliquant la méthode V.S.E.P.R donner la géométrie autour de chaque carbone. Peut-on prévoir la géométrie globale de la molécule ?
Les 3 atomes de Carbone ont une géométrie du type AX3, on à donc affaire à trois triangles équilatéraux mais rien n'indique si ces trois triangles sont ou non coplanaires.
b) L’expérience montre que la molécule est plane. Représenter le système p et justifier ce fait expérimental.
La géométrie de type AX3 correspond à une hybridation de type sp2.
Pour que les liaisons p puissent se former, la molécule adopte une conformation totalement plane. Toutes les orbitales hybrides sp2 se placent dans un même plan et toutes les orbitales p sont alors parallèles, cela permet un recouvrement maximal des orbitales p entre elles ce qui stabilise la molécule. On a affaire à un système dit conjugué, un "nuage" p délocalisé englobe les trois atomes de Carbone et l'atome d'Oxygène.
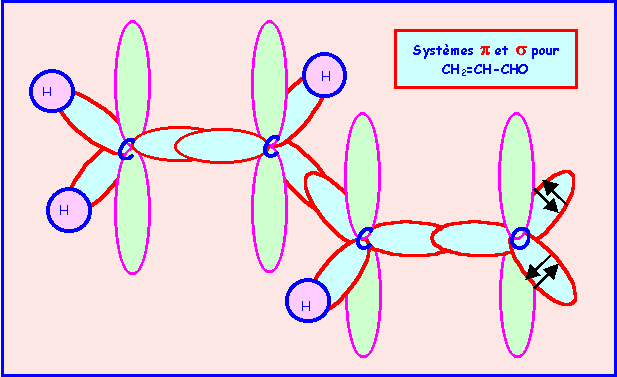
c) Que peut-on prévoir pour les longueurs de liaison C-C ?
Ces liaisons seront en fait intermédiaires entre simple et double liaison. La molécule est un hybride de résonance entre plusieurs formes mésomères qui diffèrent par la position des doubles liaisons.
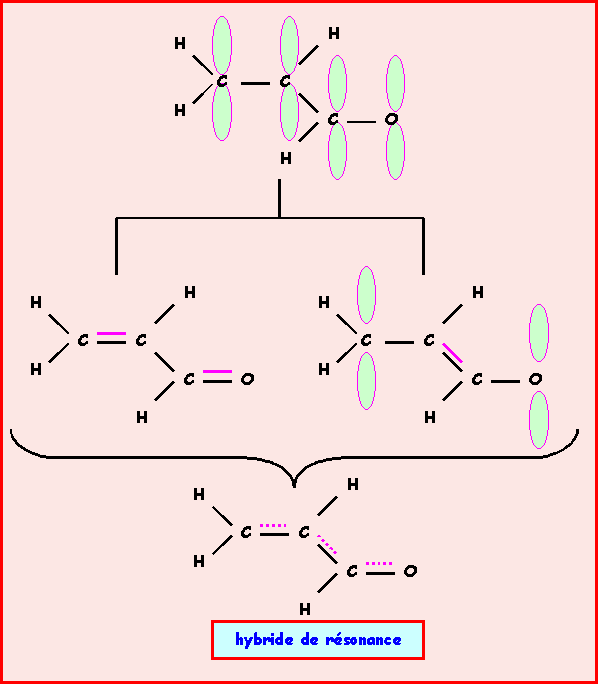
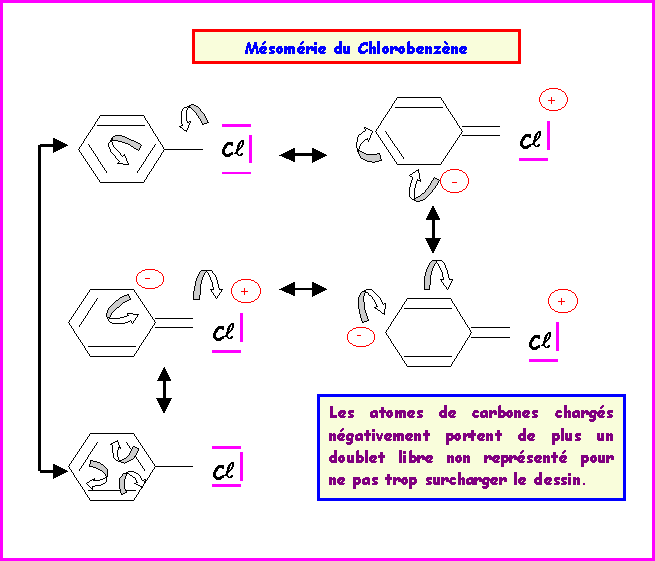
Exercice 10 :
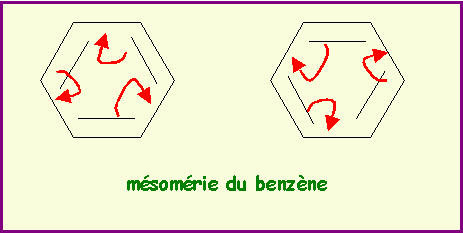
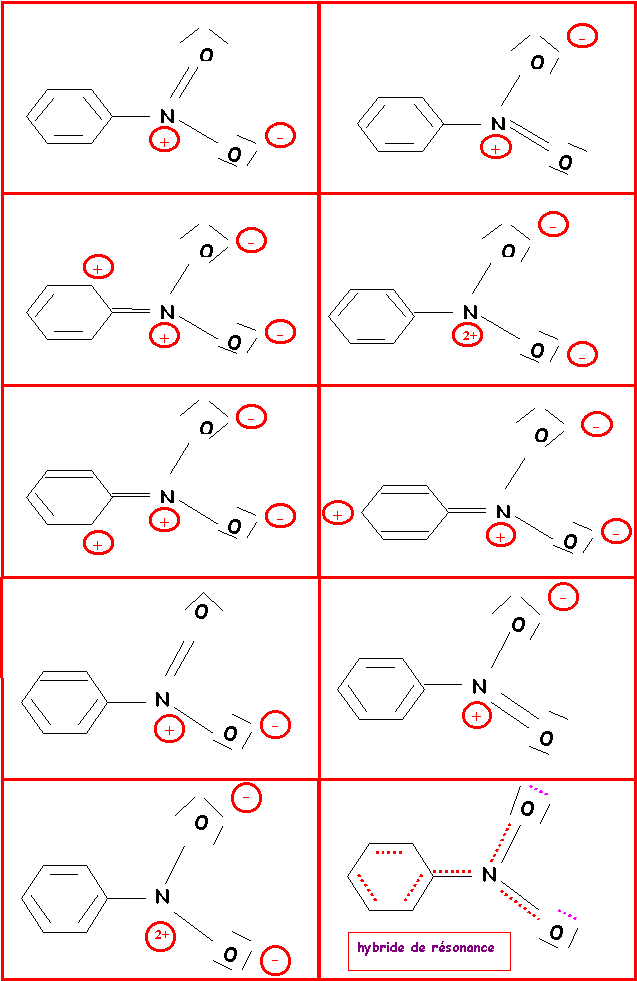
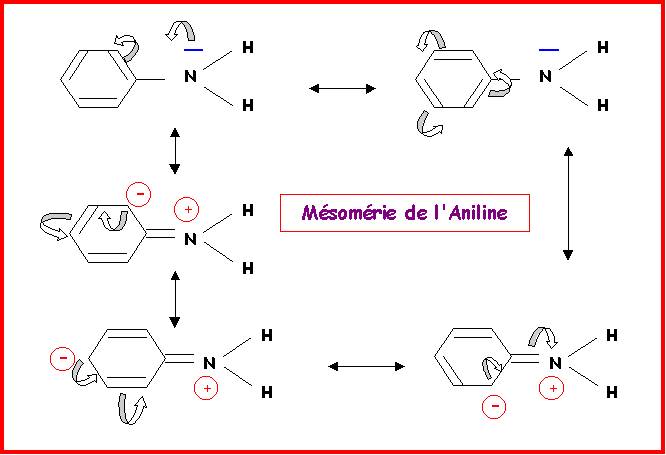
Donner les diverses formes limites de résonance des composés suivants :
Benzène C6H6- Nitrobenzène C6H5NO2- Aniline C6H5NH2 - Chlorobenzène C6H5Cl
Aniline : Pour ne pas trop surcharger le schéma, le doublet libre de l'atome de carbone porteur de la charge négative n'ont pas été représentés.
Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com