Influence des phénomènes de compléxation
sur les réactions redox et de précipitation
Matériel et Produits :
Solutions 0,1 M de Chlorure de Fer (III) - Solution d'Iodure de Potassium à 10% - Tétrachlorure de Carbone - Solution 0,1 M de Thiosulfate de Sodium - Solution 1 M de Soude - Solution à,1 M de Sulfate de Cuivre - Solution 0,1 M d'Ammoniaque - Ammoniaque Concentré - Solution Titrée d'Ammoniaque 10 M - Ethanol - Solution 1 M de Fluorure de Sodium - Solution Titrée 0,1 M de Nitrate d'Argent - Solution de Chlorure de Sodium - Solution de Sulfate de Zinc - Solution de Chlorure de Mercure (II) - Solution de Nitrate de Mercure (II) - Solution de Nitrate de Plomb - Solution de H2SO4 0,1 M - Solution de Al2(SO4)3 0,1 M - Solution de NaOH 0,5 M -Pipettes 10 ml (3) - Pipettes 5 ml (2) - Burette- Fioles Jaugées 100 ml (3) - Eprouvette 10 ml (2) - Bechers 150 ml (5) - Buchner - Fiole à Vide - Multimètre Numérique ou pH-mètre - Fils électriques - Electrodes d'Argent (2) - Electrodes de Cuivre (2) - Electrodes de Zinc (2) - Ponts Salins (4) - Pipettes Compte-gouttes (10) - pH mètre + électrodes - Agitateur magnétique - Barreau aimanté -
Introduction :
Les interférences entre plusieurs phénomènes sont courantes en chimie des solutions aqueuses et viennent compliquer, mais surtout enrichir celle-ci. On peut envisager des interférences multiples entre réactions : acide-base (pH) / Oxydoréduction / Précipitation / Complexation. Nous allons nous limiter ici à l'étude expérimentale de l'influence du phénomène de complexation sur les réactions d'oxydo-réduction et de précipitation.
I) Influence du phénomène de complexation sur les réactions d'oxydo-réduction :
1) Action des ions fer (III) sur les ions iodures :
a) Réaction normale :
Dans un tube à essais verser 1 ml de solution de chlorure de fer (III) 0,1 M, puis 2 ml d'eau. Verser alors 2 ml de solution d'iodure de potassium à 10 %. On observe un changement de coloration du mélange réactionnel. Verser 1 ml de tétrachlorure de carbone dans le tube, celui-ci forme une deuxième phase plus lourde que l'eau. Par agitation le tétrachlorure de carbone se colore en rose puis en violet, ce qui montre la formation de diiode. Récupérer la phase aqueuse et la décolorer par ajout goutte à goutte d'une solution de thiosulfate de sodium. Cette opération permet d'éliminer le diiode restant. Verser alors un peu de soude dans la phase aqueuse on observe la formation d'un précipité vert d'hydroxyde de fer(II) Fe(OH)2. Montrer qu'avec les ions fer (III) de départ le précipité d'hydroxyde de fer (III) Fe(OH)3 obtenu est de couleur rouille. Dans cette réaction les ions fer (III) ont donc oxydé les ions Iodures :
Fe(III) + 2 I- ---> Fer(II) + I2
b) Influence de la complexation :
Opérer de la même façon mais ajouter une solution 1 M de fluorure de sodium au lieu de l'eau distillée. On n'observe plus de réaction. Les ions fluorures ont donné un complexe avec le fer (III) (la complexation se manifeste par un léger trouble de la solution). Le fer(III) sous sa forme complexée n'est plus capable d'oxyder les ions iodures.
c) Justification théorique :
Données thermodynamiques :
I2 + 2 e- ----> 2 I- E0 = 0,53 V
Fe3+ + 1 e- ----> Fe2+ E0 = 0,77 V
(FeF6)3- -----> Fe3+ + 6 F- pKd = 15,3
A l'aide des données calculer le E0 du couple (FeF6)3- / Fe2+
(FeF6)3- + 1 e- -----> Fe2+ + 6 F- E0 = ?
Montrer alors que l'oxydation des ions iodure n'est plus possible. (Voir annexe 1)
2) Influence de la complexation sur le potentiel redox :
a) Expérience :
Réaliser deux piles de Daniell : Cu / Cu2+ (0,1 M) / Pont Salin / Zn2+ (0,1 M) / Zn. Avec un multimètre numérique utilisé en voltmètre, mesurer leur f.e.m. Le pôle positif est sur le cuivre, le pôle négatif sur le zinc. (V/A sur Cu ; COM sur Zn). On trouve 1,1 V.
Dans la première pile, verser 5 ml d'ammoniaque concentré (10 M) dans le compartiment du cuivre, la d.d.p diminue. Le potentiel de l'électrode de cuivre à donc baissé par complexation de Cu2+.
Dans la deuxième pile, verser 5 ml d'ammoniaque concentré (10 M) dans le compartiment du zinc, la d.d.p augmente. Le potentiel du zinc à baissé par complexation de Zn2+.
Justification théorique :
Données Thermodynamiques :
Cu2+ + 2 e- ---> Cu E0 = 0,34 V
Zn2+ + 2 e- ---> Zn E0 = - 0,76 V
Cu2+ + 4 NH3 ---> (Cu(NH3)4)2+ pKf = - 12,59
Zn2+ + 4 NH3 ---> (Zn(NH3)4)2+ pKf = - 9,06
A l'aide des données précédantes évaluer la f.e.m des piles réalisées et les comparer à l'expérience. On pourra négliger l'influence des concentrations et se contenter de calculer l'écart des E0. (voir Annexe 2)
3) Détermination d'une constante de dissociation de complexe
Voir thème N°3 : Complexe aminé de l'argent pour le mode opératoire.
II) Influence du phénomène de complexation sur les réactions de précipitation :
1) Masquage de l'ion central :
Dans un tube à essais introduire une solution de nitrate d'argent, ajouter ensuite une solution de chlorure de sodium. On observe la formation d'un précipité de chlorure d'argent qui noircit à la lumière. Refaire la même expérience mais cette fois rajouter un peu d'ammoniaque concentré avant d'introduire NaCl. Le précipité apparaît plus, l'ion Ag+ semble avoir disparu de la solution. Il est dissimulé par la complexation sous forme de Ag(NH3)2)+.
3) Redissolution de précipités :
Ion Mercure (II) :
Dans un tube à essais introduire une solution de chlorure mercurique. Verser à la pipette, goutte à goutte, une solution de KI. On observe tout d'abord un précipité rouge-orangé d'iodure mercurique HgI2, le précipité se redissout dans un excès de KI pour donner une solution incolore d'ion complexe tétraiodomercurate HgI42- (pKd=30,3).
Ions Zinc (II) et Aluminium (III) :
Dans un tube à essais introduire une solution de sulfate de zinc. Verser goutte à goutte une solution de soude 1 M. On observe tout d'abord la formation d'un précipité blanc d'hydroxyde de zinc (II) : Zn(OH)2. Le précipité se redissout ensuite par formation de l'ion complexe Zn(OH)42- si l'on continue à ajouter de la soude. On observe les mêmes phénomènes avec l’ion Al3+.
Suivi pH-mètrique : Titrage de Al3+ en milieu sulfurique par la soude
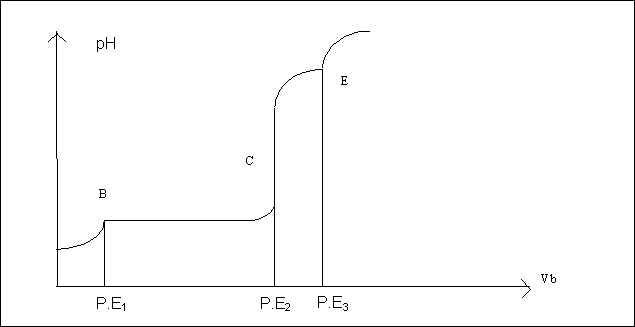
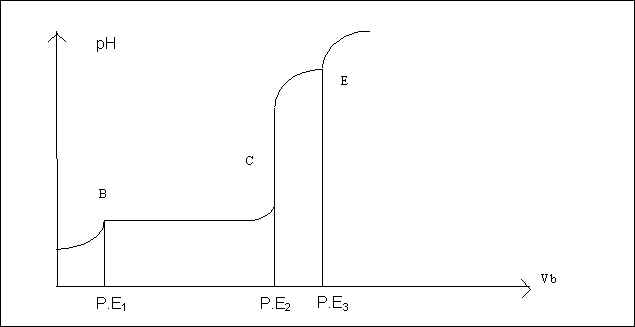
Dans une fiole jaugée de 100 ml introduire à la pipette jaugée 10 ml d’une solution 0,1 M de H2SO4 et 10 ml d’une solution 0.1 M de sulfate d’aluminium. Complèter à 100 ml avec de l’eau distillée. Transvaser dans un bècher de 200 ml. Immerger une électrode de pH-métrie. Verser progressivement à l’aide d’une burette de la soude 0,5 M de 0,5 ml en 0,5 ml jusqu’a 25 ml. Noter le pH de la solution après chaque ajout et tracer la courbe de titrage pH=f(Vb).
La courbe obtenue ne ressemble pas au courbes de pH habituelles, elle présente trois points singuliers correspondant au titrage de H2SO4, à la précipitation de Al(OH)3 puis à sa redissolution sous forme d’ion complexe Al(OH)4-. On peut d’ailleurs suivre visuellement l’apparition et la disparition du précipité.
Les réactions chimiques sont :
H2SO4 + 2 OH- ----> 2 H2O + SO42-
Al3+ + 3 OH- ------> Al(OH)3 pKs = 33 avec Ks=(Al3+) (OH-)3
Al3+ + 4 OH- ------> Al(OH)4- log b = 35 avec b = (Al(OH)4-) / (Al3+) (OH-)4

Le P.E1 (point B) correspond au début de la précipitation de Al(OH)3. Il correspond pratiquement au point équivalent du titrage de H2SO4 si celui-ci était seul.
Le P.E 2 (point C) correspond schématiquement à la fin de précipitation et au début de la redissolution de Al(OH)3. En fait ce point est difficile à définir puisque précipitation et redissolution sont en réalité concomitantes.
Le P.E 3 (point E) correspond à la redissolution totale du précipité. Al3+ est alors totalement compléxé.
On peut à partir des P.E déterminer les concentration de H2SO4 et Al2(SO4)3
Pour H2SO4 à partir du PE1 :
H2SO4 réagit avec 2 NaOH soit : 2 Ca Va = Cb Vb
(H2SO4) = Ca = 0,5 VPE1 / 200
Pour Al2(SO4)3 à partir du P.E2 ou du P.E3 :
- P.E2 : Al3+ réagit avec trois OH- pour donner Al(OH)3 soit : 3 Ca Va = Cb Vb
Il ne faut pas oublier de retrancher le volume nécessaire à la neutralisation de H2SO4 : (Al3+) = Ca = 0,5 (VPE2-VPE1)/300
- PE.3 : Al3+ réagit avec 4 OH- pour donner Al(OH)4- soit : 4 Ca Va = Cb Vb
Comme précédemment on doit retrancher le volume nécessaire à la neutralisation de H2SO4 : (Al3+) = Ca = 0,5* (VPE3-VPE1)/400
Théoriquement on devrait obtenir la même valeur pour la concentration en Al3+ quelquesoit le PE utilisé, dans la pratique on obtient deux valeurs différentes. Il est préférable de conserver la concentration obtenue avec le troisième point équivalent : ce point équivalent est bien définit sur la courbe alors que le deuxième ne l’est pas. De plus l’utilisation du deuxième P.E suppose la précipitation et la redissolution comme deux réactions successives sans interférences entre elles ce qui n’est pas vrai. D’autre part il existe aussi Al(OH)2+ et Al(OH)2+ dont on devrait tenir compte. Enfin, l’apparition du précipité entraîne une fluctuation du pH qui est peu stable ce qui fausse les mesures dans la zone où le précipité existe.
Pour une simulation informatique de ce titrage et une analyse plus précise voir thème N° 29 et disquette d’accompagnement : Fichier Alumin
4) Application séparation d'ions :
a) Séparation des ions Ag+ et Pb2+:
Ces deux cations donnent des chlorures insolubles, AgCl est blanc et noircit à la lumière, PbCl2 est blanc également. Montrer leur précipitation individuelle par action de HCl 1 M sur le nitrate correspondant.
Préparer un mélange de nitrate d'argent, et de nitrate de plomb. Ajouter une solution d'acide chlorhydrique 1 M. Les 2 chlorures insolubles précipitent. Filtrer et récupérer le solide. Le laver dans une solution d'ammoniaque 1 M. Le chlorure d'argent se redissout en donnant le complexe Ag(NH3)2+. Filtrer de nouveau et traiter le filtrat par l'acide nitrique 1 M afin d'éliminer l'ammoniaque et de réobtenir l'ion Ag+. Le caractériser par ajout de chlorure de sodium.
Finalement, il reste un résidu blanc, c'est le chlorure de plomb PbCl2.
b) Séparation des ions Pb2+et Hg2+:
Ces 2 cations donnent des iodures insolubles PbI2 est jaune et HgI2 est rouge. De plus on a vu que HgI2 était soluble dans un excès de KI par formation du complexe HgI42-. Préparer un mélange de ces deux ions puis rajouter goutte à goutte la solution de KI, on observe la précipitation des deux iodures. En ajoutant un excès de KI le précipité rouge se redissous. Filtrer, on obtient PbI2 jaune seul et HgI42-dans le filtrat. Pour caractériser les ions Hg2+ dans le filtrat, y tremper une pièce de 10 ou 20 centimes. Au bout d’un certain temps la pièce se recouvre d’une pellicule grise d’amalgame de mercure. En raison de la complexation la concentration en Hg2+ libre est très faible et le résultat est beaucoup moins spectaculaire qu’avec Hg2+ non compléxé (voir thème N°2). Ceci illustre à nouveau l’influence de la compléxation sur la réaction rédox.
5) Influences mutuelles : précipitation / oxydoréduction / complexation
Complexe aminé de l'ion cuivre (II) :
a) Préparation du sel complexe :
Dans un becher introduire du sulfate de cuivre en solution puis ajouter une quantité suffisante d'ammoniaque concentré de façon à former le complexe. Verser alors de l'éthanol pour faire précipiter le sel complexe. Filtrer et sécher sur Buchner.
b) Action de l'ion Cu2+ sur l'ion iodure :
Dans un tube à essais verser un peu de solution de KI 10%. Ajouter ensuite un peu de sulfate de cuivre solide. On observe la formation de diiode et la précipitation d'iodure cuivreux CuI. Mettre en évidence I2 en versant un peu de CCl4 dans le tube à essais ; il forme une phase plus lourde que l'eau qui se colore en rose puis en violet par agitation. Si on veut montrer plus facilement le précipité de CuI, on peut décolorer la phase aqueuse par le thiosulfate de sodium.
Remarque : CCl4 présentant une toxicité relativement élevée on pourra si on le désire le remplacer par l’hexane par exemple. La phase organique sera alors moins dense que l’eau.
c) Action de l'ion complexe sur l'ion iodure :
Refaire la même expérience avec le sel complexe préparé précédemment ; la réaction n'a plus lieu : sous sa forme complexée l'ion cuivre (II) n'est plus capable d'oxyder I-.
d) Application : Dosage de l'ion Cu2+par iodométrie .
Prélever 20 ml (pipette) de la solution d'ions Cu2+ à doser, ajouter 25 ml de solution de KI 1 M et 20 ml de tampon acétique molaire. On observe l'apparition de diiode et la formation d'un précipité blanc de CuI . Titrer le diiode formé par une solution titrée 0,1 M de thiosulfate de sodium. Ajouter en fin de titrage un peu d'empois d'amidon et 1 ml de solution saturée de thiocyanate de sodium. Soit V le volume de thiosulfate versé pour atteindre le point équivalent. L'écriture des deux réactions utilisées pour le titrage montre qu'il y a correspondance directe entre le nombre de mole d'ion Cu2+ et le nombre de mole de thiosulfate. On a donc : C0 = 0,1 * V / 20
Justification théorique :
Données thermodynamiques :
CuI pKs = 12
Cu2+ / Cu E0 = 0,34 V
Cu+ /Cu E0 = 0,52 V
I2/I- E0 = 0,53 V
Cu(NH3)42+ Log Kf = 12,59
Montrer que c'est grâce à la formation de CuI insoluble que Cu2+ est capable d'oxyder I-. Cela montre l'influence d'une précipitation sur une réaction d'oxydoréduction. Montrer ensuite que la complexation de l'ion Cu2+ empêche l'oxydation de I-. Cela montre l'influence de la complexation sur la réaction rédox et en conséquence sur la réaction de précipitation. (voir annexe 3).
Annexe 1 :
(1) I2 + 2 e- ----> 2 I- E0 = 0,53 V
(2) Fe3+ + 1 e- ----> Fe2+ E0 = 0,77 V
(3) (FeF6)3 - -----> Fe3+ + 6 F- pKd = 15,3
Calcul du E0 du couple (FeF6)3- / Fe2+
(4) (FeF6)3- + 1 e- -----> Fe2+ + 6 F-
(4) = (2) + (3)
-FE04 = -FE02 - RT LnKd
E04 = E02 + 2,3 RT/F LogKd
E04 = E02 + 0,06 LogKd
E04 = 0,77 + (0,06 * -15,3) = -0,11 V
Le potentiel de référence du couple (FeF6)3- / Fe2+ est inférieur à celui du couple I2/I-, l'oxydation de I- n'est donc plus possible en présence d'ions fluorure.
Annexe 2 :
On ne tient pas compte des concentrations pour simplifier les calculs.
(1) Cu2+ + 2 e- ---> Cu E0 = 0,34 V
(2) Zn2+ + 2 e- ---> Zn E0 = - 0,76 V
(3) Cu2+ + 4 NH3 ---> (Cu(NH3)4)2+ pKf = - 12,59
(4) Zn2+ + 4 NH3 ---> (Zn(NH3)4)2+ pKf = - 9,06
* Pile Cu2+ et Zn2+ :
E = ECu - EZn = 0,34 - (-0,76) = 1,1 V
** Pile (Cu(NH3)4)2+ et Zn2+
Calcul du E0 (Cu(NH3)4)2+/Cu
(5) (Cu(NH3)4)2+ + 2 e- ---> Cu + 4 NH3
(5) = (1) - (3)
-2F E05 = -2FE01+ RT LnKf
E05 = E01 - 2,3 RT / 2F LogKf
E05 = E01 + 0,03 pKf
E05 = 0,34 + (0,03 * - 12,59) = -0,04 V
E = -0,04 -(-0,76) = 0,68 V
La d.d.p diminue bien, la complexation rend l'ion Cu2+ moins oxydant.
Un raisonnement qualitatif aurait pu conduire à la même conclusion :
ECu = E0Cu + 0,03 log (Cu2+) comme (Cu2+) diminue fortement du fait de la complexation (complexe très stable) le potentiel de l'électrode de cuivre diminue et la d.d.p E = ECu - EZn diminue elle aussi.
*** Pile Cu2+et (Zn(NH3)4)2+:
Calcul du E0 (Zn(NH3)4)2+ / Zn
(6) (Zn(NH3)4)2+ + 2 e- ---> Zn + 4 NH3
(6) = (2) - (4)
-2F E05 = -2F E02+RT Ln Kf
E06 = E02 - 2,3 RT / 2F LogKf
E06 = E02 + 0,03 pKf
E06 = - 0,76 + (0,03 * - 9,06) = - 1,03 V
E = 0,34 - (-1,03) = 1,37 V
La d.d.p augmente bien, la complexation rend le zinc encore plus réducteur. Un raisonnement qualitatif aurait pu conduire à la même conclusion :
EZn = E0Zn + 0,03 log (Zn2+) comme (Zn2+) diminue fortement du fait de la complexation (complexe très stable) le potentiel de l'électrode de zinc diminue et la d.d.p E = ECu - EZn augmente.
Annexe 3 :
(1) CuI ---> Cu2+ + I- pKs = 12
(2) Cu2+ + 2 e- ---> Cu E02 = 0,34 V
(3) Cu+ + 1 e- ---> Cu E03 = 0,52 V
(4) I2 + 2 e- ---> 2 I- E04 = 0,53 V
(5) Cu2+ + 4 NH3 ---> Cu(NH3)42+ pKf = - 12,59
Le E0 du Couple Cu2+ / Cu est inférieur à celui du couple I2/I-, Cu2+ne peut donc normalement oxyder I-.
Envisageons alors le couple Cu2+ / Cu+.
Calcul du E0 Cu(II)/Cu+ :
(6) Cu2+ + 1 e- ---> Cu+
(6) = (2) - (3)
-F E06 = -2F E02 + F E03
E06 = 2 E02 - E03
E06 = (2 * 0,34) - 0,52 = 0,16 V
La situation est encore moins favorable.
Envisageons alors l'influence de la réaction de précipitation de CuI.
La réaction envisagée est alors :
(7) Cu2+ + I- + 1 e- ---> CuI E07 = ?
Calcul du E0 Cu(II) / CuI :
(7) = (6) - (1)
-F E07 = -F E06 + RT LnKs
E07 = E06 - 2,3 RT / F log Ks
E07 = E06 + 0,06 pKs
E07 = 0,16 + (0,06 * 12) = 0,88 V
Le potentiel du couple (Cu2+ + I-) / CuI est supérieur à celui du couple I2 / I-, Cu2+ peut donc oxyder I-, grâce à la précipitation de CuI.
Voyons maintenant ce qui se passe quand Cu2+ est sous forme complexe Cu(NH3)42+ .Le couple à envisager est alors :
(8) Cu(NH3)42+ + I-+ 1 e- ---> CuI + 4 NH3 E08 = ?
(8) = (7) - (5)
-F E08 = -F E07 + RT Ln Kf
E08 = E07 - 2,3 RT / F Log Kf
E08 = E07 - 0,06 Log Kf
E08 = 0,88 - (0,06 * 12,59) = 0,12 V
Le E0 est devenu inférieur à celui du couple I2 / I-. En milieu ammoniacal l'oxydation de I- redevient impossible. Il en va de même pour la précipitation de CuI.