Utilisation de l’informatique en chimie :
Quelques exemples d’utilisation d’un tableur-grapheur
Introduction :
L'informatique est de plus en plus utilisée dans l'enseignement des sciences physiques, mais on croit souvent à tort qu'il est nécessaire d'utiliser des logiciels spécialisés et difficiles d'accès. Nous allons voir qu'il n'en est rien et qu'un simple tableur-grapheur d'usage courant permet de réaliser des applications d'autant plus intéressantes qu'elles seront réalisables par les élèves eux mêmes sans aucune difficultés. Le logiciel utilisé ici est Excel qui est un standard très répandu et par conséquent connu et utilisé par un très grand nombre de personnes. Aisé d'utilisation il permet de réaliser facilement soi-même des applications variées.
I) SIMULATION DE TITRAGES ACIDO-BASIQUES
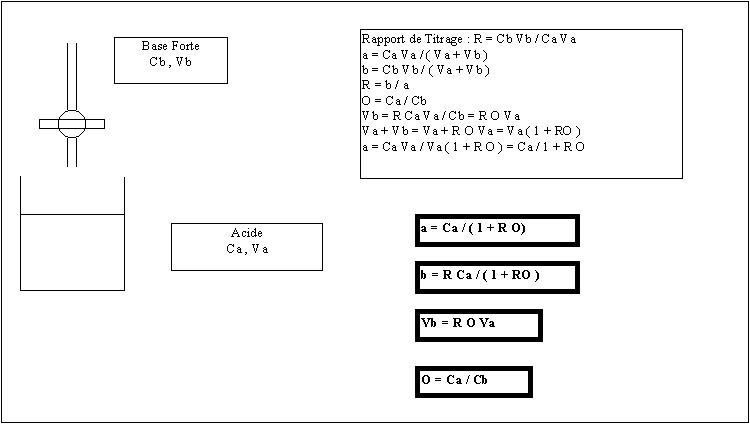
Simulation du Titrage d’un Acide par une Base Forte :
Nous allons construire un programme (utilisable sur une simple calculette) permettant la simulation de titrages d’un acide quelconque par une base forte. Il s’agit de tracer la courbe de titrage donnant le pH en fonction du volume de base versé : pH = f (Vb). Le problème est normalement du troisième degré en H3O+ mais nous allons utiliser une astuce de calcul permettant de le ramener au premier degré. Nous allons considérer le pH comme une donnée et calculer le volume correspondant. En réalité nous allons utiliser non le volume de base versé mais le rapport de titrage R. Nous allons tout d’abord établir les formules permettant le calcul de R en fonction du pH pour les cas les plus courants selon qu’on a affaire à un acide fort , un acide faible , un diacide faible ou un triacide faible. On utilisera des notations identiques dans tous les cas, ces notations seront définies en cours de calcul. A partir des formules obtenues il sera aisé de construire dans un premier temps un programme de simulation sur calculatrice. La transformation de ce programme pour son utilisation sur micro-ordinateur avec le tableur EXCEL sera alors très facile à réaliser. On pourra pour se simplifier le travail réaliser des feuilles de calcul correspondant à chaque type de titrage.
A : Approche théorique préalable :

I) ACIDE FORT : HX
E.N : ( H3O+ ) + ( Na+ ) = (OH- ) +( X- )
C.M : ( Na+ ) = b ; ( X- ) = a
H + b = W + a H = (H3O+) W = (OH-)
H - W = a -b
D = a - b D = H - W
D = (Ca / ( 1 + R O ) ) - (R Ca / ( 1 + R O ))
D + DRO = Ca - R Ca
DRO + R Ca = Ca - D
R = ( Ca - D ) / ( DO + Ca )
II) MONOACIDE FAIBLE : AH
AH + H2O = A- + H3O+
K1 = ( A- ) ( H3O+ ) / ( AH )
(AH ) = ( A- ) ( H3O+ ) / K1
C.M : ( AH ) + ( A- ) = a ; ( Na+ ) = b
( A- ) ( 1 + ( H / K1 ) ) = a
( A- ) = a / ( 1 + ( H / K1 ) )
( A- ) = a / L L = 1 + ( H / K1 )
E.N : ( A- ) + ( OH- ) = ( H3O+ ) + ( Na+ )
( a / L ) + W = H + b
( a / L ) - b = H - W
( a / L ) - b = D M = 1 / L
Ca M - R Ca = D + DRO
R = ( Ca M - D ) / ( Ca + DO)
III) DIACIDE FAIBLE : AH2
AH2 + H2O = AH- + H3O+
K1 = ( AH- ) ( H3O+ ) / ( AH2 )
(AH2 ) = ( AH- ) ( H3O+ ) / K1
AH- + H2O = A2- + H3O+
K2 = ( A2- ) ( H3O+ ) / ( AH- )
(AH- ) = ( A2- ) ( H3O+ ) / K2
(AH2 ) = ( A2- ) ( H3O+ )2 / K1 K2
C.M : ( AH2 ) + ( AH- ) + ( A2-) = a ; (Na+ ) = b
( A2-) ( 1 + ( H / K2 ) + ( H2 / K1 K2 ) ) = a
( A2- ) = a / L L = 1 + ( H / K2 ) + ( H2 / K1 K2 ) )
E.N : 2 ( A2- ) + ( AH- ) + ( OH- ) = ( H3O+ ) + ( Na+ )
2 ( a/L ) + ( (a/L) (H / K2 ) ) + W = H + b
a ( (2/L) + (H/K2L) ) - b = D M = ( 2 / L ) + ( H / K2 L )
Ca M - R Ca = D + DRO
R = ( Ca M - D ) / ( Ca + DO)
IV) TRIACIDE FAIBLE : AH3
AH3 + H2O = AH2- + H3O+
K1 = ( AH2- ) ( H3O+ ) / ( AH3 )
(AH3 ) = ( AH2- ) ( H3O+ ) / K1
AH2- + H2O = AH2- + H3O+
K2 = ( AH2- ) ( H3O+ ) / ( AH2- )
(AH2- ) = ( AH2- ) ( H3O+ ) / K2
AH2- + H2O = A3- + H3O+
K3 = ( A3- ) ( H3O+ ) / ( AH2- )
(AH2- ) = ( A3- ) H / K3
(AH2- ) = ( A3- ) H2 / K2 K3
( AH3) = ( A3- ) H3 / K1 K2 K3
C.M : ( AH3 ) + ( AH2- ) + ( AH2-) + ( A3- ) = a ; ( Na+ ) = b
( A3-) ( 1 +( H / K3) + ( H2 / K2 K3 ) + ( H3 / K1 K2 K3) ) = a
( A3- ) = a / L L = 1 + ( H / K2 ) + ( H2 / K1 K2 ) +( H3 / K1 K2 K3) ) )
E.N : 3 ( A3- ) +2 ( AH2-) + ( AH2- ) +( OH- ) = ( H3O+ ) + ( Na+)
3 ( a/L ) + ( 2 (a / L) (H / K3 ) ) + ( (a/L) (H2 / K2 K3 ) ) + W = H + b
a ( (3/L )+ (2H/K3L) + (H2 / K2K3L)) - b = D
M = ( 3 / L ) + ( 2H / K3 L ) + ( H2 / K2 K3 L)
Ca M - R Ca = D + DRO
R = ( Ca M - D ) / ( Ca + DO)
V) Résumé :
On constate que la formule obtenue est identique dans tous les cas :
R = ( Ca M - D ) / ( Ca + DO)
Pour l’acide fort il suffit de poser L = M = 1 pour s’y ramener.
Acide fort :
L = 1 M = 1
Monoacide faible
L= 1 + ( H / K1 ) M = 1 / L
Diacide faible
L = 1 + ( H/ K2 ) + H2 / K1K2 M = ( 2 / L ) + ( H / K2 L )
Triacide faible
L= 1 + ( H / K3 ) + (H2 / K2K3) + (H3 / K1K2K3)
M = ( 3 / L ) + ( 2H / K3 L ) + ( H2 / K2 K3 L)
La régularité des formules obtenues permet même aisément de prévoir les résultats pour un tétra ou un pentacide.
Il va donc être aisé de réaliser un programme général permétant la simulation d’un titrage quelconque.
Cas du titrage d’une base par un acide fort :
La technique de calcul est exactement la même, on obtient les résultats suivants :
R = ( Cb M + D ) / ( Cb - DO )
Base forte : L = 1 , M = 1
Monobase faible : L = 1 + (K1/H) , M = 1/L
Dibase faible : L = 1+ ( K1/H ) + (K1K2/H2) , M = (2/L)+(K1/HL)
Tribase faible : L = 1 + ( K1 / H ) + ( K1 K2 / H2 ) + ( K1 K2 K3 / H3 )
M = ( 3 / L) + ( 2 K1 / H L) + ( K1 K2 / H2 L)
B) REALISATION DU PROGRAMME
Programme (pour calculatrice de type CASIO)
" Ca " ? -> A : " Cb " ? -> B : " K1 " ? -> E : " K2 " ? -> F : " K3 " ? -> G :
A / B -> O : Lbl 1 : " pH " ? -> P : 10 -P -> H : 1 E-14 / H -> W : H - W -> D :
E=0 => Goto 2 : F=0 => Goto 3 : G=0 => Goto 4 :
1 + ( H / G ) + (H2 / G / F) + ( H3 / G / F / E ) -> L :
( 3 / L ) + ( 2 H / G / L ) + ( H2 / G / F / L ) -> M :
" R " : ( AM - D) / ( A + DO ) D
Goto 1 : Lbl 4 : 1 + ( H / F) + ( H2 / F / E ) -> L : ( 2 / L ) + ( H / F / L ) -> M :
" R " : ( AM - D) / ( A + DO ) D
Goto 1 : Lbl 3 : 1 + ( H / E) -> L : 1 / L -> M :
" R " : ( AM - D) / ( A + DO ) D
Goto 1 : Lbl 2 :" R " : ( A - D) / ( A + DO ) D
Goto 1 :
Fonctionnement du programme :
On entre tout d’abord les valeurs des concentrations de l’acide et de la base Ca et Cb.
On entre ensuite les valeurs des Ka successifs K1 , K2 , K3
pour un acide fort on entrera 0 , 0 , 0
pour un monoacide faible on entrera K1 , 0 , 0
pour un diacide faible on entrera K1 , K2 , 0
Les Ka pourront être entrés directement sous la forme 10-pKa
On entre ensuite une valeur quelconque pour le pH et la machine affiche alors la valeur correspondante de R.
On note les valeurs de pH et de R et on trace au fur et à mesure la courbe de titrage : pH = f ( R ).
On choisira soi même les valeurs du pH qui permettront un bon tracé de la courbe de titrage. Une précision de 0,1 sur le pH et 0,01 sur R est généralement largement suffisante.
Remarques :
1) On peut si on le désire automatiser le processus en rajoutant les instructions :
" pH " : P + 0,5 -> P D
après chaque instruction de calcul de R :
" R " : ( AM - D) / ( A + DO ) D ou " R " : ( A - D) / ( A + DO ) D
Il faudra aussi déplacer le Lbl 1 pour le mettre entre " pH " ? -> P : et 10-P -> H :
Dans ce cas, seule la première valeur du pH sera choisie et la machine incrémentera automatiquement avec un pas de 0,5 unités de pH.
On gagnera du temps mais on ne choisira plus soi-même le pH ce qui peut être gênant si on veut par exemple déterminer avec précision le pH au Point Equivalent.
2) On peut modifier légèrement le programme pour calculer le volume de base versé au lieu du rapport de titrage R. Il faudra entrer la valeur du volume d’acide utilisé dans les données préalables . On ajoutera l’instruction " Va " ? -> V : entre l’instruction " Cb " ? -> B : et " K1 " ?-> E :
On modifiera les instructions de calcul de R " R " : ( AM - D) / ( A + DO ) D qu'on remplacera par :
" Vb " : ( AM - D) / ( A + DO ) * O * V D
ou " Vb " : ( A - D) / ( A + DO ) * O * V D pour l’acide fort.
C) SIMULATIONS sur EXCEL :
Tous les " logiciels " décrits dans les paragraphes suivants sont disponibles sur la disquette d’accompagnement. S’y reporter pour faciliter la compréhension des explications qui suivent.
Nous allons détailler la manière de procéder pour réaliser soi même un logiciel de simulation basé sur les principes précédants. Il s’agira dans un premier temps de la simulation du titrage d’un diacide faible par une base forte. Il sera ensuite " aisé " de transposer ce logiciel pour créer le logiciel correspondant à un autre type de titrage. Les explications qui suivent vous paraîtront peut être compliquées mais un petit effort vous montrera qu’il n’en est rien et que la réalisation de son propre logiciel est très gratifiante. Dans un deuxième temps nous aborderons le cas général du titrage d’un acide quelconque par une base forte.
DESCRIPTION SOMMAIRE DU LOGICIEL " DIACIDE "
Le logiciel se présente sous la forme d’une feuille de calcul EXCEL.
Se reporter à la disquette d’accompagnement pour suivre les explications.
Cette feuille de calcul à été conçue de la manière suivante :
DONNEES PREALABLES :
Concentration de l’acide : Ca
Volume d’acide utilisé pour le titrage : Va
Concentration de la base : Cb
Valeurs des deux pKa : pK1 et pK2
Ces différentes données seront nommées et fixées en premier
Calculs intermédiaires :
O = Ca/Cb ; K1 et K2 seront calculés à partir des données initiales
Réalisation de la simulation :
On va créer un tableau permettant le calcul de Vb à partir du pH à partir des formules démontrées précédemment. On calculera successivement :
(H3O+) = H = 10-pH
(OH-) = W = 10-14 / H
(H3O+) - (OH-) = D = H - W
L = 1 + ( H / K2 ) + ( H2 / K1K2 )
M = ( 2 / L) + ( H / K2L)
R = ( Ca M - D ) / ( Ca + DO)
Vb = R O Va
De plus nous allons calculer les dérivées dpH/dR et dpH/dVb.
Pour pouvoir tracer les courbes pH = f ( R ) , dpH/dR = f ( R ) ; pH = f ( Vb ) et dpH/dVb = f ( Vb) à l’assistant graphique on devra réintroduire les valeurs de pH à coté de celles de R et de Vb.
On introduira aussi le calcul des concentrations des diverses espèces en tout point du dosage ce qui permetrat une visualisation graphique des espèces majoritaires. L’introduction de ces valeurs prenant de la place elle apparaitrat en pratique sur une autre page (colonnes en gras dans le tableau suivant).
Le tableau obtenu est donc le suivant :
pH H W D L M R pH dpH/dR Vb pH dpH/dVb Vb pH (A2-) (AH-) (AH2)
Sous chaque titre on écrira la formule correspondante.
Pour obtenir des courbes de titrages de bonne allure il faut aussi fixer le pH de départ, et le pas utilisé. De plus, il faut que la courbe dérivée soit superposable à la courbe de titrage avec la même échelle (c’est à dire avoir des valeurs de la dérivée du même ordre de grandeur que celle du pH).
Détermination du pH initial et du pas d’incrémentation :
- Le pH initial est calculable en utilisant les approximations classiques. Ici on supposera que le diacide faible se comporte en première approximation comme un monoacide faible et on utilisera la formule classique pHi = 1/2 pK1 - 1/2 logCa pour le calcul du pH initial.
- Le pH final atteint en fin de titrage tend vers celui d’une solution de base forte
pHf =14 + logCb
Si on veut tracer une courbe de titrage contenant 20 points le pas maximal est alors :
(pHf - pHi )/20.
Calcul des courbes dérivées :
Le calcul de la dérivée est approximée par Dy/Dx. On ajoutera un coefficient multiplicateur pour ramener la dérivée et le pH au même ordre de grandeur. Le pH maximal atteint en fin de titrage étant pHf il faut que la valeur maximale de la dérivée lui soit égale si on veut des courbes bien superposables sans effet d’écrasement de l’une par rapport à l’autre. On calculera donc le coefficient multiplicateur par : Coef = pH final / Maximum de la dérivée. Le maximum de la dérivée est accessible par la Fonction MAXIMUM .
Pour que le calcul de la dérivée soit possible par DpH/DR il faut avoir deux couples de valeurs (pH ; R ) pour cette raison le calcul de la dérivée n’est pas possible pour le pH initial et n’interviendra que dans la deuxième ligne du tableau. On garnira donc la première ligne (sauf les deux dérivées) puis on utilisera la fonction recopier vers le bas. Pour cela il faudra avoir pris la précaution de référencer les cellules fixes. On introduira alors les formules de calcul des dérivées (2° ligne) et on recopiera à nouveau vers le bas.
Le reste du travail n’est plus qu’une question de mise en page. On introduira deux petits graphiques de contrôle qui permettront l’ajustement des paramètres pHi , PAS et les deux coefficients de dérivées de façon à avoir la plus belle courbe possible (voir p 1 du logiciel imprimé sur papier).
Un petit tableau de contrôle sera aussi crée, ce tableau vous sera utile pour calculer rapidement les coordonnées de n’importe quel point du titrage et d’autre part, permetra la comparaison des résultats obtenus avec ceux d’ un logiciel commercial comme SIMULTIT par exemple.
Dans ce petit tableau de contrôle figurent :
pH H W D L M R Vb (A2-) (AH-) (AH2)
Enfin on pourra si on le désire tracer deux grands graphes pour l’impression des courbes.
Fonctionnement du logiciel :
Introduire les données Ca, Va , Cb, pK1 et pK2
Descendre dans la page grâce à la flèche jusqu’à avoir les deux graphiques de contrôle visibles. Vérifier préalablement que les valeurs des coefficients en (J ;14) et (J ;15). sont bien de 1 si ce n’est pas le cas écrire 1 en (J ;14) et (J ;15).
Les valeurs calculées de pHi, PASMAX et des coefficients des dérivées apparaissent dans la colonne G . Introduire ces valeurs dans la colonne J (remplacer les deux 1 initiaux par les valeurs calculées des coefficients).
Les deux courbes se tracent et doivent normalement être presque parfaites.
On peut les améliorer en jouant légèrement sur les valeurs entrées en colonne J.
- Modifier pHi permet d’avoir une courbe démarrant à l’origine (en général il faudra augmenter pHi de 0,1 pour éviter des valeurs négatives de R.
- En modifiant le Pas on s’arrangera pour avoir un R Final aux environs de 2,5 ou 3.
- Enfin on peut ajuster les coefficients des dérivées si on n’est pas tout à fait satisfait du résultat.
D) Logiciel général de simulation d’un titrage : (TOUTACID)
On peut, si on le désire, créer un logiciel général permettant la simulation du titrage d’un acide quelconque par une base forte. Il s’agit de l’adaptation à excel du programme pour calculatrice étudié plus haut. La réalisation est néanmoins plus délicate, la difficulté principale étant l’utilisation de la fonction logique SI (test logique; valeur si vrai;valeur si faux) pour remplacer les tests logiques, les LBL et les GOTO du programme pour calculatrice.
Se reporter à la disquette d’accompagnement pour plus de détails.
Pour L on écrira par exemple la formule :
=SI($B$11=0;SI($B$12=0;1+(B36/$B$15);SI($B$13=0;1+(B36/$B$16)+(B362^2/$B$15/$B$16);1+(B36/$B$17)+(B362^2/$B$16/$B$17)+(B36^3/$B$15/$B$16/$B$17))))
Pour M on écrira la formule :
=Si($B$11=0;1;SI($B$12=0;1/E36;SI($B$13=0;(2/E36)+(B36/$B$16/E36);(3/E36+(2*B36/$B$17/E36)+(B36^2/$B$16/$B$17/E36)))))
Pour le calcul du pH initial on écrira =SI(B11=0;-log(B8);0.5*(B11-log(B8)))
Une présentation sommaire est donnée (application intitulée " TOUTACID ")
Avec ce logiciel on pourra simuler rapidement le titrage d’un acide quelconque par une base forte. on pourra en particulier visualiser très rapidement l’effet de l’écart entre les divers pKa et vérifier la règle qui veut qu’un titrage séparé ne soit possible que si cet écart est au moins de trois à quatre nuitées de pH. On pourra aussi vérifier les approximations classiques pH = pKa à la demi-neutralisation par exemple et tester ainsi leurs champs de validité....
Le même logiciel est réalisable pour le titrage d’une base quelconque par un acide fort moyennant des adaptations utilisant les formules données plus haut. Voir disquette d’accompagnement : Fichier TOUTBASE
E) Exploitation de résultats expérimentaux - Modélisation sur EXCEL :
A) Description sommaire du " logiciel " d’exploitation et de modélisation :
Ce " logiciel " se trouve dans la disquette d’accompagnement, s’y reporter pour comprendre plus facilement les explications qui suivent. Dans cet exemple nous étudierons le titrage d’un acide faible par une base forte, la transposition à d’autre titrages ne pose pas de problèmes particuliers.
1) Saisie des points expérimentaux :
Un tableau de 25 points expérimentaux a été prévu.
On titre par exemple 20 ml d’acide acétique environ 0,1 M par la soude 0,2 M en présence d’un ajout de 50 ml d’eau distillée. On utilisera ici le matériel traditionnel pour un titrage pH-métrique.
On réalisera le logiciel préalablement le logiciel avant de l’utiliser pour un titrage réel.
On entrera au fur et à mesure manuellement au clavier les valeurs de Vb et du pH correspondant. La courbe expérimentale se tracera au fur et a mesure. On suivra son évolution afin d’ajuster au mieux les ajouts de base forte. En début de titrage on pourra verser rapidement la base forte ( par 0,5 ou 1 ml). On ralentira les ajouts aux environs du point équivalent ( de 0,1 en 0,1 ml). On augmentera les ajouts ensuite.
2) Tracé de la courbe expérimentale et de sa dérivée :
Comme précédemment on utilisera un coefficient multiplicateur pour que ces deux courbes soient bien superposables. Ce coefficient est calculé en faisant le rapport pH MAX / dpH/dv MAX.
3) Exploitation des résultats expérimentaux :
On entrera tout d’abord les données Cb , Va et V0.
V0 étant le volume d’eau distillée ajouté pour bien immerger les électrodes.
Détermination du Point Equivalent :
C’est le point pour lequel la dérivée est maximale. Il suffit donc de lire dans le tableau le volume pour lequel la dérivée est maximale.
Calcul de la concentration de l’acide :
Ca = Cb Veq / Va
Détermination du pKa de l’acide :
1° Méthode :
On utilise l’approximation classique pH = pKa à la demi-neutralisation. Cette approximation est correcte dans la plupart des cas (voir précédemment). On lira donc dans le tableau la valeur du pH pour Vb = Veq/2. Si ce point ne figure pas dans le tableau il suffira de prendre les deux points qui l’encadrent et de faire une extrapolation linéaire pour déterminer pKa.
2° Méthode :
La connaissance expérimentale du pH permet le calcul des concentrations (H3O+) et (OH-).
H=10-pH ; W=1E-14/H et D=H-W
La connaissance expérimentale du volume de soude versé permet de calculer la concentration (Na+) = Cb Vb / (Va+Vb+V0)
L’électroneutralité de la solution permet de calculer la concentration (A-)
(A-) = (Na+) + H - W = (Na+) + D
La conservation de la matière permet de calculer la concentration (AH)
(AH) = ( Ca Va / (Va + Vb + V0) ) - (A-)
La connaissance simultanée de (H3O+) , (A-) et (AH) permet de déterminer les valeurs de Ka et pKa : Ka = (A-) (H3O+) / (AH) - pKa = - log Ka
Il est donc possible de déterminer le pKa de l’acide à partir des résultats expérimentaux obtenus. Dans la pratique on déterminera le pKa en faisant une moyenne sur les premiers points expérimentaux, en effet, l’incertitude sur le volume versé et le pH fausse rapidement le résultat et l’expérience montre que seuls les premiers points donnent un résultat satisfaisant pour la détermination de Ka. Ce phénomène n’est pas du à une inexactitude des calculs utilisés, mais pour que les résultats obtenus soient corrects il faudrait entrer les valeurs expérimentales de Vb avec une précision supérieure à la 4° décimale ce qui est bien entendu irréalisable. Cet effet est néanmoins négligeable en début de dosage et les premiers points donnent donc de bons résultats.
4) Modélisation - Comparaison Théorie/Expérience :
Elle est basée sur les même principes que les simulations réalisées précédemment avec toutefois quelques différences.
- On tient ici compte de l’ajout d’un certain volume V0 d’eau distillée pour réaliser le titrage expérimental.
Dans ce cas on a :
a = Ca Va / ( Va + Vb + V0 ) et b = Cb Vb / ( Va + Vb + V0 )
On a toujours R = Cb Vb / Ca Va = b / a
b = R a
Vb = R O Va
Va + Vb + V0 = Va + R O Va + V0
a = Ca Va / ( Va + R O Va + V0 )
b = R Ca Va / ( Va + R O Va + V0 )
( A- ) = a / L = Ma avec L = 1 + ( H / K1 ) et M = 1 / L
( A- ) + W = H + b
M a - R a = D
M Ca Va / ( Va + R O Va + V0 ) - R Ca Va / ( Va + R O Va + V0 ) = D
M Ca Va - R Ca Va = D Va + D R O Va + D V0
M Ca Va - D Va - D V0 = D R O Va + R Ca Va
R = ( M Ca Va - D Va - D V0 ) / ( D O Va + Ca Va )
On peut vérifier que si V0 = 0 on obtient bien la même formule que précédemment :
R = ( Ca M - D ) / ( Ca + DO) et Vb = R O Va
- Puisque nous aurons déterminé Ka de deux manières différentes on pourra calculer deux valeurs différentes pour le volume versé.
- On utilisera aussi la valeur " théorique " de pKa c’est à dire la valeur tirée des tables de constante ( pKa = 4,75 pour l’acide acétique).
Nous pourrons ainsi tracer trois courbes modélisées différentes que l’on comparera à la courbe expérimentale.
On crée donc le tableau suivant (voir p 4 du logiciel imprimé sur papier) avec les formules adéquates :
pH H W D M1°méth M2°méth MThéo R pH VbExp Vb1°méth Vb2°méth VbThéo (Na+) (A-) (AH) pKa
RAPPEL :
1°méthode : utilisation de la valeur de pka déterminée en prenant pH à la demi neutralisation.
2° méthode : Utilisation de la valeur de pKa déterminée par le calcul des concentrations de (H3O+), (A-) et (AH).
Théorique : Utilisation de la valeur tabulée de pKa
On tracera les graphes superposés
pH= f (Vb Exp) , pH = f (Vb1°méth) , pH = f (Vb2°méth) et pH = f (VbThéo)
pour comparer les courbes expérimentale et théoriques. Dans la pratique, avec le tableau utilisé, Excel trace les courbes V = f (pH). Il est néanmoins possible de lui faire inverser les axes et de lui faire tracer les courbes habituelles pH = f (Vb ).
Le même traitement informatique est possible pour le titrage d’une base faible par un acide fort c’est le cas du fichier DosNH3 sur la disquette d’accompagnement.
F) Application à un titrage incluant précipitation et complexation :
Nous allons appliquer les mêmes techniques à un problème plus complexe : le titrage d’une solution d’ion Al3+ en solution sulfurique par la soude. On verse progressivement une solution de soude dans un mélange contenant du sulfate d’aluminium et de l’acide sulfurique. On titre d’abord H2SO4 puis un précipité de Al(OH)3 apparait, ce précipité se redissous ensuite par formation du complexe Al(OH)4-. Le problème est relativement complexe mais l’utilisation des techniques précédantes permet de le résoudre assez aisément. (Voir thème N°16 pour le mode opératoire).
Espèces susceptibles d’être présentes :
Solubles : Al3+ ; Al(OH)4- ; H3O+ ; OH- ; SO42- ; Na+
Insolubles : Al(OH)3
Expressions des " concentrations initiales " (en l’absence de toute réaction chimique)
(SO42-) = (0,01 + 3*0,01)*100 / (100+V) = 4/(100+V) = a
(Al3+) = 2*0.01*100/(100+V) = 2/(100+V) = b
(Na+) = 0,5 V / (100+V) = c
1) Absence de précipité de Al(OH)3
L’aluminium se trouve alors sous forme d’ion Al3+ et d’ion complexe Al(OH)4-
Conservation de la matière Al : (Al3+) + (Al(OH)4-) = b
Equilibre de formation du complexe : Al(OH)4- = b (Al3+) (OH-)4
(Al3+) + b (Al3+) (OH-)4 = b
(Al3+) ( 1 + b (OH-)4 ) = b
(Al3+) = b / ( 1 + b (OH-)4 )
Al(OH)4- = b (OH-)4 b / ( 1 + b (OH-)4 )
Posons (OH-) = W , (H3O+) = H et H - W = D
(Al3+) =b / ( 1 + b W4 )
Al(OH)4- = b W4 b / ( 1 + b W4 )
Posons : b W4 = L , 1+L = M et 1/(1+L) = N
(Al3+) =b / ( 1 + L ) = 2N / (100+V)
Al(OH)4- = L b / ( 1 + L ) = 2LN/(100+V)
Electroneutralité : 2 (SO42-) + (Al(OH)4-) + W = 3 (Al3+) + (Na+) + H
8/(100+V) + 2LN/(100+V) + W = 6N/(100+V) + 0,5V/(100+V) + H
8 + 2LN - 6N - 0,5V = (H - W)*(100+V) = D*(100+V) = 100 D + D V
8 + 2LN - 6N - 100D = V (D+0.5)
V = (8 + 2LN - 6N - 100D) / (D+0.5)
Cette expression donne V si le précipité est absent c’est à dire si (Al3+)*(OH-)3 < Ks
Condition de validité : 2N W3 /(100+V) - Ks < 0
2) Présence de précipité de Al(OH)3
La relation Ks = (Al3+)*(OH-)3 est alors vérifiée
(Al3+) = Ks / W3
(Al(OH)4-) = b (Al3+) (OH-)4 = b Ks W
Electroneutralité : 2 (SO42-) + (Al(OH)4-) + W = 3 (Al3+) + (Na+) + H
8/(100+V) + b Ks W + W = 3Ks / W3+ 0,5V/(100+V) + H
8/(100+V) - 0,5V/(100+V) = D + 3Ks / W3 - b Ks W
Posons : D + 3Ks / W3 - b Ks W = O
8/(100+V) - 0,5V/(100+V) = O
8 -0,5 V = O(100+V) = 100 O + OV
8 - 100 O = V( O + 0,5)
V = (8 - 100 O ) / ( O + 0,5 )
Cette expression donne V si le précipité est présent c’est à dire si (Al3+)*(OH-)3 > Ks
Condition de validité : 2N W3 / (100+V) - Ks > 0
Programme pour calculatrice (type CASIO)
PERMETANT DE FAIRE VARIER LES DIVERSES CONCENTRATIONS, LE VOLUME ET LES CONSTANTES THERMODYNAMIQUES
" Ks " -> K : " B " -> J : " H2SO4 " -> A : " Al2(SO4)3 " -> B :
" NaOH " -> C : " V0 " -> E : 2*(A+3B)*E -> F : 2BE -> G : 6BE -> I :
Lbl1 : pH -> P : 10-P -> H : 1E-14/H -> W : H-W -> D :
J W4 -> L : 1+L -> M : 1/(1+L) -> N : D + 3K / W3 - E W -> O :
(F + GLN - IN -ED)/(D+C) -> X :
(F - EO ) / ( O + C ) -> Y :
GN W3 / (E+X) - K -> Z :
Z<0 => X D
Z>0 => Y D
Goto 1 :
Application sur EXCEL :
Se repporter à la disquette d’accompagnement : Fichier Alumin.
Plutôt que de faire une simple simulation nous allons faire de la modélisation c’est à dire que les valeurs expérimentales d’un titrage réel vont être comparées à la courbe théorique.
Comme pour les applications générales TOUTACID ou TOUTBASE, ce programme nécessite l’utilisation de la fonction logique SI. Le logiciel comporte un tableau dans lequel on entre les valeurs expérimentales du pH en fonction du volume de soude versé. On calcule la dérivée (affectée d’un coefficient permettant d’ajuster les valeurs maximales des deux courbes), et on trace sur le même graphique la courbe expérimentale et sa dérivée. On exploite ensuite les résultats expérimentaux en déterminant à partir des trois points équivalents les valeurs des concentrations de H2SO4 et de Al2(SO4)3. Pour ce dernier on peut utiliser soit le P.E2 soit le PE3. En théorie on devrait obtenir le même résultat quelque soit le P.E utilisé. Dans la pratique les deux résultats sont différents et on pourra donc déterminer deux valeurs différentes pour la concentration de Al2(SO4)3 voire même utiliser la moyenne de ces deux valeurs. On procède ensuite à la modélisation (sous la forme du tableau habituel). On trace ensuite sur le même graphe les courbes expérimentales et modélisée. L’accord obtenu est généralement assez bon si on utilise la valeur calculée à partir du P.E3 pour la concentration de Al2(SO4)3.
L’intêret du logiciel est de pouvoir à volonté modifier les valeurs utilisées pour les concentrations :
- On peut en particulier fixer la valeur de la concentration du sulfate d’alluminium à zéro. On réalise alors la simulation du titrage de H2SO4 s’il était seul. On visualise alors instantanément le fait que le P.E1 correspond au titrage de H2SO4 seul et que la courbe expérimentale s’ajuste très bien à la courbe modélisée.
- Inversement on peut supposer la concentration de H2SO4 nulle. On constate alors que la courbe est exactement décalée du volume du P.E1 ce qui confirme l’analyse précédente.
L’utilisation du logiciel facilite grandement la compréhension du phénomène chimique relativement complexe étudié ici.
Conclusion :
Le nombre d’applications possibles est pratiquement illimité. La présentation de quelques unes aura donné je l’espère l’envie au lecteur de se lancer dans leur réalisation pratique. Il est évident que les logiciels commerciaux (SIMULTIT en particulier) sont beaucoup plus performants et facile d’utilisation, mais d’une part on n’en dispose pas forcement (coût relativement élevé), mais surtout ce sont des logiciels fermés dont on ne maîtrise pas le fonctionnement. La réalisation personnelle de son propre logiciel de simulation est très formatrice et gratifiante. Pour vous en convaincre il vous reste maintenant à aller vous amuser avec la disquette d’accompagnement de cet ouvrage qui vous convaincra je l’espère de l’intérêt de ces techniques. Vous y découvrirez un fichier supplémentaire non décrit ici qui concerne la simulation de titrages par précipitation. Ce fichier est intitulé AgClAgI. A vous, maintenant, d’appliquer les principes utilisés ici pour créer vos propres applications. Bon courage et bonne chance pour votre concours.