Force d’un couple acide/base -
Dosage d’une base faible par un acide fort -
Matériel et Produits :
Solutions concentrées (10 M) d'acide Chlorhydrique et d'Ammoniaque - Lessive de Soude (10 M ) - Solutions Titrées 1 M de HCl, CH3COOH, CH3COONa, NH4Cl, NH3, NaOH et NaCl - Solution titrée 0,1 M de HCl - Solution 0,1 M d'ammoniaque - Hélianthine - pH-mètre - solutions tampons - agitateur magnétique - burette - pipette 10 ml - bechers 250 ml (3) - Verre à pied - erlen 250 ml (4) - Montage préparation HCl et NH3 (Ballon + Chauffe-ballon + Régulateur + boy élévateur + Tube de sûreté + tube à dégagement 2 angles droits) (2) - Petits bechers (10) -
Introduction :
La théorie des acides et des bases de Bronsted et Lowry (1923) a permis à la chimie d'énormes progrès. Nous allons tout d'abord en rappeler l'essentiel. Nous illustrerons ensuite expérimentalement les notions d'acide et de base, de couple acido-basique, de force relative des acides et des bases, de réaction acido-basique. Nous réaliserons ensuite le dosage d'une base faible par un acide fort par pH-métrie puis en utilisant un indicateur coloré pour visualiser le point équivalent.
A) Définition des acides et des bases au sens de Bronsted :
Quelques rappels théoriques qu'il faudra bien maîtriser pour aborder ce thème en apparence anodin !
Selon la théorie de Bronsted et Lowry (1923) :
* un acide est un corps capable de libérer un proton H+.
* une base est un corps capable de capter un proton H+.
* à tout acide est associée une base conjuguée
* à toute base est associé un acide conjugué
* On écrit ces différents postulats sous la forme :
(1) Acide ---> Base Conjuguée + H+
(2) Base + H+ ---> Acide conjugué
Exemples :
HCl ----> Cl- + H+
Acide Base
NH3 + H+ ----> NH4+
Base Acide
* Dans la plupart des cas les écritures précédantes sont "hypothétiques", un acide seul ne libère pas de proton spontanément. De même une base seule ne peut capter spontanément de proton . La seule possibilité est qu'ils réagissent sur eux mêmes mais cela est à la limite de la définition retenue (Voir Autoprotolyse) . Par contre un acide peut fournir un proton à une base qui l'acceptera. On à donc toujours affaire à des réactions d'échange de protons entre une base et un acide. Il découle des définitions précédantes qu'au cours de la réaction l'acide est transformé en sa base conjuguée et vice-versa.
On écrira donc :
(3) Acide 1 + Base 2 ----> Base 1 + Acide 2
Exemple :
HCl + NH3 ----> Cl- + NH4+
Acide 1 Base 2 Base 1 Acide 2
* Rôle du solvant : Un cas particulier important : l'eau
L'eau est amphotère, c'est à dire qu'elle possède à la fois les propriétés acide et basique. Elle peut donc réagir sur elle même selon le principe précédant.
H2O + H2O ----> OH- + H3O+
Acide 1 + Base 2 ----> Base 1 + Acide 2
C'est la réaction bien connue d'autoprotolyse de l'eau. Il s'agit d'un équilibre chimique très peu déplacé vers la droite dont la constante Ke = (H3O+) (OH-) vaut 10-14 à 25 °C.
Cette notion est généralisable à tout autre solvant, mais nous allons maintenant nous limiter aux réactions acido-basiques en solution aqueuse. Le solvant est alors l'eau.
Il est important de noter que le proton n'existe jamais à l'état libre mais toujours associé au solvant (solvaté). En milieu aqueux on aura donc affaire à des ions hydroniums H3O+. Il découle de ce fait une nouvelle écriture de définition des acides. Une substance sera acide si elle peut "protoner" l'eau et basique si elle peut la "déprotoner".
(4) Acide + H2O ----> Base + H3O+
(5) Base + H2O ----> Acide + OH-
Exemples :
(6) HCl + H2O ----> Cl- + H3O+
Acide 1 Base 2 Base 1 Acide 2
(7) NH3 + H2O ----> NH4+ + OH-
Base 1 Acide 2 Acide 1 Base 2
Remarquons que ces écritures sont des cas particuliers de (3) pour lesquelles un des couples concernés est celui de H2O.
En pratique une seule de ces écritures est indispensable pour décrire les propriétés d'un couple Acido-basique. On a privilégié l'acide et seule l'écriture (6) sera utilisée par la suite.
Ainsi à la place de (7) on préférera écrire (8) pour décrire le couple NH4+/NH3.
(8) NH4+ + H2O ----> NH3 + H3O+
Acide 1 Base 2 Base 1 Acide 2
* Force des acides :
Toutes les réactions écrites précédemment sont en réalité des équilibres chimiques plus ou mois déplacés vers la droite. On peut donc leur appliquer la loi d'action de masse. L'activité du solvant sera prise égale à l'unité et on assimilera activités et concentrations pour les espèces autres que celui-ci. On définira ainsi la constante d'acidité d'un couple acido-basique Ka.
Acide + H2O ----> Base + H3O+ Ka = (Base) * (H3O+) / (Acide)
La valeur de Ka mesurera la force de l'acide du couple.
En pratique, on préfère utiliser le pKa , cologarithme de Ka : pKa = - log Ka
On peut distinguer trois cas :
a) Si la réaction est totalement déplacée vers la droite :
On a affaire à un acide fort totalement dissocié dans l'eau. Dans ce cas la valeur de Ka tend vers l'infini. La forme acide du couple n'existe pas en solution aqueuse. L'acide étudié est plus acide que l'ion hydronium. Inversement, la forme basique du couple est infiniment faible, on à alors une espèce indifférente.
exemple : HCl acide fort - Cl- ion indifférent
b) Si la réaction est un vrai équilibre :
On a affaire à un acide faible plus ou moins dissocié dans l'eau. Les formes acide et basique du couple coexistent dans l'eau. Toutes deux présentent un caractère d'électrolyte faible partiellement dissocié.
exemple : NH4+ / NH3 pKa=9,25 NH4+ : acide faible NH3 : base faible
c) Si la réaction est totalement déplacée vers la gauche :
Le cas est symétrique du a) : Ka tend vers 0, la base est une base forte totalement dissociée et l'acide une espèce indifférente.
exemple : NaOH base forte Na+ ion indifférent
* Comparaison des forces de deux acides :
Nous venons de voir que Ka augmentait avec la force de l'acide.
Acide infiniment faible : Ka --> 0
Acide faible : Ka = Valeur finie
Acide fort Ka --> infini.
L'acide ayant le plus grand Ka sera donc l'acide le plus fort. On peut aussi dire que l'acide ayant le plus petit pKa est l'acide le plus fort.
* Comparaison des forces de 2 bases :
A l'acide le plus fort correspond la base la plus faible et inversement.
B) MANIPULATIONS :
I) Mise en évidence du caractère acide ou basique :
1) Acidité du gaz chlorure d'hydrogène :
Faire barboter du gaz chlorhydrique préparé par chauffage de HCl concentré dans un becher d'eau distillée dans lequel on aura préalablement immergé les électrodes d'un pH-mètre.
Le pH baisse fortement, il y a donc eu formation d'ions hydronium.
Ces ions proviennent de la protonation de l'eau par HCl qui est donc un acide (voir thème N°5 pour le montage).
Puisque HCl à fourni un proton à H2O il se transforme en sa base conjuguée Cl-.
La réaction est donc :
HCl + H2O ---> Cl- + H3O+
Acide 1 Base 2 Base 1 Acide 2
2) Basicité du gaz ammoniac :
Procéder de la même façon en utilisant une solution concentrée d'ammoniaque au lieu de HCl. Le pH augmente il y a apparition d'ion OH-. L'eau à été "déprotonée" par NH3 qui est donc une base. NH3 en fixant un proton de H2O s'est transformé en son acide conjugué NH4+. La réaction est donc :
NH3 + H2O ---> NH4+ + OH-
Base 1 Acide 2 Acide 1 Base 2
II) Force des acides :
1) Aspect qualitatif :
Prendre des solutions titrées 0,01 M d'acide chlorhydrique, d'acide acétique, de chlorure d'ammonium, de chlorure de sodium, d'acétate de sodium, d'ammoniaque, et de soude. Mesurer leur pH.
Il est fortement recommandé d'utiliser des solutions fraîchement préparées par dilution de solutions 1M avec de l'eau désionisée préalablement bouillie pour en chasser au maximum le CO2 dissous. Cela est particulièrement important pour la solution de NaCl théoriquement neutre et donc très sensible à l'acidité de CO2 dissous qui peut descendre son pH à 5. Vérifier que l'eau utilisée a bien un pH proche de 7 sinon l'interprétation sera délicate. Déduire des valeurs trouvées que HCl est un acide fort, CH3COOH un acide faible, NH4+ un acide encore plus faible, NaCl est indifférent, CH3COO- une base faible, NH3 une base un peu moins faible et NaOH une base forte. (Voir Annexe 1)
2) Aspect quantitatif / Détermination, d'un pKa :
On étudiera le couple Ion Ammonium / Ammoniaque. Voir thème N°3 pour le mode opératoire.
III) Réaction acide-base :
1) Réaction directe entre HCl et NH3 :
Prendre un flacon de HCl concentré et un flacon de NH3 concentré. Déboucher les deux flacons et approchez les l'un de l'autre. Il se forme d'abondantes fumées blanches de NH4Cl en suspension dans l'air. NH4Cl est un solide ionique contenant des ions NH4+ et Cl-, la réaction est donc :
NH3 + HCl ----> NH4+ + Cl-
Base 1 Acide 2 Acide 1 Base 2
2) Réaction en solution aqueuse :
Dans un becher de 100 ml introduire 10 ml d'acide chlorhydrique concentré. Introduire un thermomètre dans la solution. Porter sous agitation magnétique. Mesurer le pH au papier pH. Verser par petite portions et avec précaution de la lessive de soude grâce à une burette par exemple. Noter l'augmentation de la température, qui montre qu'une réaction exothermique se produit. Mesurer le pH au papier pH (ou au pH-mètre après chaque addition). Le pH augmente ce qui montre la consommation d'ions hydroniums par la réaction. Quand le pH est de 6 à 7 arrêter l'addition. Si on a utilisé des solutions suffisamment concentrées on peut observer l'apparition de cristaux blancs dans le becher. Si ce n'est pas le cas on peut concentrer la solution en la portant à ébullition pour évaporer l'eau. Filtrer éventuellement pour récupérer ces cristaux. Dans un tube à essais introduire un peu de nitrate d'argent puis quelques cristaux, l'apparition d'un précipité blanc caractérise la présence d'ion Cl- dans les cristaux. Chauffer une spatule à la flamme d'un bec Bunsen, la flamme doit être "incolore". Mettre un cristal sur la spatule et la reporter dans la flamme, l'apparition d'une coloration jaune intense traduit la présence d'ion Na+ dans les cristaux. Finalement on à obtenu du chlorure de sodium NaCl, la réaction est donc :
NaOH(aq) + HCl(aq) ----> NaCl(aq)
mais nous avons vu que NaOH base forte était totalement dissociée dans l'eau de même que HCl acide fort. De plus NaCl est un solide ionique totalement dissocié lui aussi en Cl- et Na+.
Donc on a en réalité :
Na+ + OH- + H3O+ + Cl- ---> Na+ + Cl-
Na+ et Cl- présents des deux cotés de la flèche ne sont pas concernés par la réaction, ce sont des ions spectateurs ou indifférents. On peut les supprimer de l'écriture de la réaction.
H3O+ + OH- ---> ?
Il est évident que pour équilibrer la réaction il a du se former 2 molécules d'eau.
H3O+ + OH- ----> 2 H2O
Cette réaction est la "réaction inverse" de l'autoprotolyse de l'eau. La constante d'équilibre est donc 1 / Ke = 1014. Cette réaction est appelée neutralisation et peut être considérée comme totale.
IV) Réalisation d'un dosage acide/base :
1) Dosage pH-métrique :
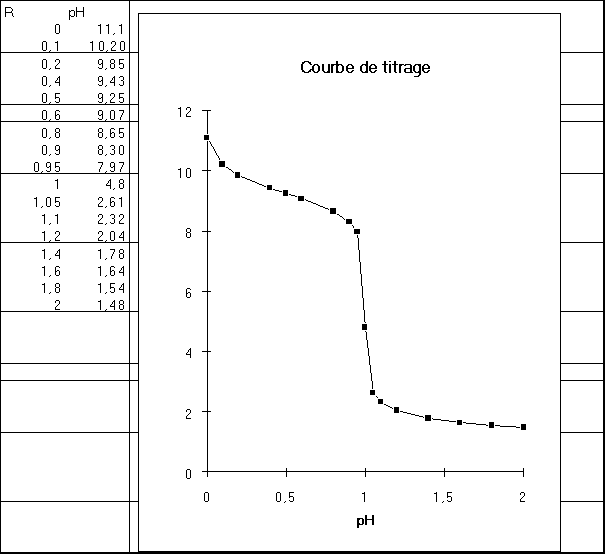
Dans un becher introduire 10 ml (pipette) d'une solution environ 0,1 M d'ammoniaque. Rajouter 20 ml d'eau distillée (éprouvette). Immerger dans la solution les électrodes d'un pH-mètre préalablement étalonné à pH 9 et 7. Placer sous agitation magnétique. Remplir une burette d'une solution titrée d'acide chlorhydrique 0,1 M. Verser l'acide par portions de 0,5 ml et noter les valeurs du pH après chaque addition. Ralentir les ajouts à l’approche du point équivalent (normalement 10 ml). Tracer la courbe du pH en fonction du volume d'acide versé. L'utilisation d'un tableur-grapheur type Excel ou Régréssi est fortement recommandée.
Exploiter la courbe et en déduire la concentration de la solution d'ammoniaque. La courbe de titrage présente deux points d'inflexion : à l'équivalence et à la 1/2 équivalence. Montrer que le pH à la 1/2 équivalence permet la mesure du pKa du couple déjà mesuré précédemment. Comparer les deux valeurs obtenues.
Pour une exploitation informatique voir thème N° 29.et la disquette d’accompagnement : Fichier DosNH3.
Pour une justification simple de la forme de la courbe voir Annexe 2.
2) Utilisation d'indicateurs colorés :
Les 3 principaux indicateurs colorés d'usage courant sont :
- l'hélianthine rouge pour pH < 3,1 et jaune pour pH > 4,4
- le bleu de bromothymol jaune pour pH < 6,2 et bleu pour pH > 7,6 (vert à pH=7)
- la phénolphtaléine incolore pour pH < 8 et rouge violacée pour pH > 10
Faire apparaître ces zones de virage sur la courbe de titrage et montrer que l'hélianthine peut seule convenir à la visualisation du point équivalent. Procéder alors à un nouveau dosage en utilisant celle-ci. Comparer les résultats avec ceux du dosage pH-métrique.
ANNEXE 1 :
Si les solutions sont titrées et le pH mètre bien étalonné on doit obtenir des résultats proches des suivants :
Solution HCl CH3COOH NH4Cl NaCl CH3COONa NH3 NaOH
pH 2,0 3,4 5,6 7,0 8,4 10,6 12,0
1) Aspect qualitatif :
On admettra tout d'abord que NaCl, CH3COONa et NH4Cl sont des solides ioniques totalement dissociés dans l'eau.
Les trois première solutions sont acides. Puisque leurs concentrations sont identiques, on peut déduire que HCl est plus acide que CH3COOH, lui même plus acide que NH4Cl. La solution de NaCl est neutre, donc Na+ et Cl- sont tout deux indifférents. Les trois dernières solutions sont basiques. Puisque leurs concentrations sont identiques on peut déduire que NaOH est une base plus forte que NH3 lui même plus basique que CH3COONa.
Si Cl- est indifférent alors HCl est un acide fort totalement dissocié.
Si Na+ est indifférent alors NaOH est une base forte totalement dissociée.
Si Na+ est indifférent alors la base réelle de CH3COONa est l'ion éthanoate CH3COO-.
Si Cl- est indifférent alors l'acide réel de NH4Cl est l'ion ammonium NH4+.
Conclusion :
Cette expérience permet de classer qualitativement les espèces de la façon suivante :
Acides :
HCl(Fort) > CH3COOH(faible) > NH4+(faible) >>> Na+(indifférent)
Bases :
NaOH(Forte) > NH3 (faible) > CH3COO-(faible) >>> Cl-(indifférent)
2) Aspect quantitatif :
Nous allons établir les approximations classiques qui permettent le calcul des pH de solutions pas trop diluées. Nous utiliserons ensuite ces relations pour déterminer le pKa des couples utilisés et ainsi les comparer entre eux.
Nous négligerons systématiquement la dissociation de l'eau.
* Pour un acide fort totalement dissocié :
AH + H2O ---> A- + H3O+ : Réaction Totale
avant réaction C 0 0
après réaction 0 C C
(H3O+) = C pH = - log C
Seul HCl correspond à ce cas.
* Pour un acide faible partiellement dissocié :
AH + H2O <---> A- + H3O+ : Réaction Equilibrée
avant réaction C 0 0
après réaction C-x x x
(H3O+) = x (A-) = x (AH) = C - x
Ka = x2 / (C-x)
A part pour HCl déjà traité on constate que (H3O+) = x <<< C
Ka = x2 / C
Ka * C = x2
pKa - log C = 2 pH
pH = 1/2 (pKa - log C) Approximation classique
Nous allons utiliser cette approximation pour déterminer la valeur de pKa :
pKa = 2 pH + log C
pour CH3COOH : pKa = 2*3,4 - 2 = 4,8
pour NH4Cl : pKa = 2 * 5,6 - 2 = 9,2
L'accord est en général assez bon avec les valeurs admises par la littérature.
* Pour une base forte totalement dissociée :
B + H2O ----> A + OH- Réaction Totale
Avant réaction : C 0 0
Après réaction : 0 C C
(OH-) = C pOH = - log C pH = 14 + log C
Seule NaOH correspond à ce cas.
* Pour une base faible partiellement dissociée :
B + H2O <----> A + OH- Réaction équilibrée
Avant réaction : C 0 0
Après réaction : C-x x x
La constante Kb de cet équilibre est Kb = (A) * (OH-) / (B)
Si on multiplie nominateur et dénominateur par (H3O+)
Kb = (A) Ke / (B) (H3O+) = Ke / Ka
Soit la relation fondamentale Ka * Kb = Ke.
La force d'une base est ainsi reliée à la force de son acide conjugué.
A une base relativement forte correspond un acide conjugué relativement faible et vice-versa.
On peut donc n'utiliser que le pKa pour caractériser à la fois l'acide et la base d'un couple.
La notion de Kb est donc superflue et ne sera pratiquement jamais utilisée.
Kb = Ke / Ka = x2 / (C-x)
Ka = Ke (C-x) / x2
A part pour NaOH on constate que (OH-) = x <<< C
Ka = Ke C / x2
x2 = Ke C / Ka
2 log x = log Ke + log C - log Ka
2 pOH = pKe - log C - pKa
2 (14 - pH) = pKe - log C - pKa
28 - 2 pH = 14 - log C - pKa
pH = 7 + 1/2 (logC + pKa) Approximation Classique
Nous allons utiliser cette approximation pour déterminer pKa :
pKa = 2 pH -14 - log C
pour CH3COONa : pKa = (2*8,4) - 14 + 2 = 4,8
pour NH3 : pKa = (2*10,6) - 14 + 2 = 9,2
On retrouve bien entendu les mêmes valeurs que précédemment.
Conclusion :
On trouve le même classement que précédemment, mais de plus les valeurs de pKa permettent de trouver la règle de classement des acides et bases faibles :
Plus pKa est petit et plus l'acide du couple est fort.
Plus pKa est grand et plus la base du couple est forte.
A un acide relativement fort correspond une base relativement faible et inversement.
ANNEXE 2 :
La réaction de dosage est :
NH3 + H3O+ <----> NH4+ + H2O
1) La constante de cet équilibre est K = (NH4+) /(NH3) (H3O+)
C'est l'inverse de Ka, comme Ka = 10-9,25 pour ce couple, on a donc K= 109,25 cette valeur extrêmement élevée permet de considérer la réaction comme totale.
NH3 + H3O+ ----> NH4+ + H2O
2) L'indice b sera utilisé pour la base NH3. L'indice a pour l'acide HCl.
On mélange les deux réactifs pour que la réaction se fasse.
Considérons le nombre de moles utilisé :
Nb = Cb * Vb et Na = Ca * Va
Selon les quantités mise en jeu on va distinguer trois cas :
a) Nb > Na : la base est en excès.
b) Nb = Na : Aucun des réactif n'est en excès, on est dans les proportions stoechiométriques. C'est par définition le point équivalent du dosage.
c) Na > Nb : l'acide est en excès.
3) Détermination du point équivalent :
Na = Nb
Ca * Veq = Cb * Vb Relation fondamentale qui permettra la détermination de Cb si Ca, Vb et Veq sont connus.
4) Détermination de l'équation de la courbe de titrage :
a) Avant l'ajout d'acide : Va = 0
On est en présence d'une solution d'ammoniaque base faible donc :
pH = 7 + 1/2 (logC + pKa) Approximation Classique
Exemple : Si C = 0,1 M pH = 11,1
b) Avant le point équivalent : 0 < Va < Veq
NH3 + H3O+ ----> NH4+ + H2O
Avant réaction Nb Na 0
Après réaction Nb - Na 0 Na
On est en présence d'un mélange d'une base faible et de son acide conjugué. La définition du pKa du couple conduit a :
pH = pKa + log ((Base) / (Acide))
On a : (Base) = (Nb-Na)/ (Va + Vb) et (Acide) = Na /(Va + Vb)
pH = pKa + log ((Nb-Na)/Na)
pH = pKa + log ((CbVb-CaVa)/CaVa)
On définit le rapport de titrage R = CaVa/CbVb
pH = pKa + log ((CbVb-RCbVb)/(RCbVb))
pH = pKa + log ((1-R)/R)
Cette expression est valable jusqu'au point équivalent (non compris) pour lequel R = 1. Remarquons que pour R = 0,5, pH = pKa.
exemples :
R 0,1 0,2 0,4 0,5 0,6 0,8 0,9 0,95
1-R 0,9 0,8 0,6 0,5 0,4 0,2 0,1 0,05
(1-R)/R 9 4 1,5 1 0,67 0,25 0,11 0,053
log (1-R)/R 0,95 0,6 0,18 0 -0,17 -0,60 -0,96 -1,28
pH 10,2 9,9 9,4 9,3 9,1 8,7 8,3 8
Cette partie de la courbe présente un point d'inflexion à la demi-équivalence (R=0,5). Elle est pratiquement horizontale autour de ce point pour lequel on a : pH = pKa. C'est la zone tampon pour laquelle le pH varie très peu avec l'ajout d'acide.
c) Au point équivalent : Va = Veq ; Na = Nb et R = 1
NH3 + H3O+ ----> NH4+ + H2O
Avant réaction Nb Nb 0
Après réaction 0 0 Nb
On est en présence d'une solution de NH4Cl acide faible.
pH = 1/2 (pKa - log C) Approximation classique
On a C = Cb* Vb / (Vb + Veq)
Exemple : Si Cb=0,1M ; Vb=10 ml ; Cb = 0,1 M
Veq = 10 ml
C = 0,1 * 10 / 20= 0,5 M
pH = 0,5 * (9,25 + 0,3) = 4,8
d) Après le Point Equivalent : Va > Veq ; R > 1
L'acide est en excès Na > Nb
NH3 + H3O+ ----> NH4+ + H2O
Avant réaction Nb Na 0
Après réaction 0 Na - Nb Nb
(H3O+) = (CaVa-CbVb)/ (Va + Vb)
R = CaVa/CbVb Va = R CbVb/Ca Va + Vb = (RCb/Ca + 1)Vb
Si de plus Ca = Cb
(H3O+) = (R-1) Cb / (R+1)
pH = - log Cb + log ((R+1)/(R-1))
Exemple : Si Cb = 0,1 M
R 1,05 1,1 1,2 1,4 1,6 1,8 2
R+1 2,05 2,10 2,20 2,40 2,60 2,80 3
R-1 0,05 0,10 0,20 0,40 0,60 0,80 1
R+1/R-1 41,00 21,00 11,00 6,00 4,33 3,50 3
log(R+1/R-1) 1,61 1,32 1,04 0,78 0,64 0,54 0,48
pH 2,61 2,32 2,04 1,78 1,64 1,54 1,48
