LE MODELE DE LEWIS DE LA LIAISON CHIMIQUE
Nature de la liaison chimique :
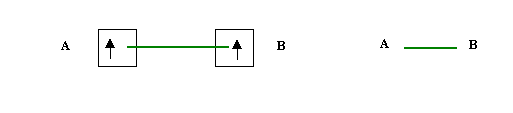
Dans le modèle de Lewis, la liaison chimique entre deux atomes résulte de la mise en commun d'un doublet d'électrons. Il existe deux manières de former une liaison.
a) Chaque atome fournit un électron célibataire, on parle de liaison de covalence normale.

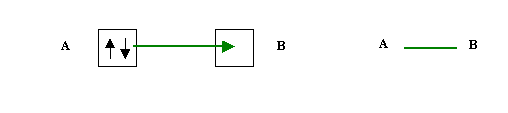
b) Un atome fournit un doublet et l'autre atome le reçoit dans une case vide, on parle alors de liaison de covalence dative ou de liaison de coordination.
En réalité ces deux types de liaisons sont totalement identiques et indiscernables.
Il peut arriver que deux atomes s'unissent entre eux par plusieurs liaisons simultanément on parle alors de liaisons multiples. Il existe seulement trois types de liaisons : Simple - Double - Triple qu'on symbolise par des traits.

Notion de Valence - Excitations des atomes :
L'obtention des schémas de Lewis moléculaires nécessite d'associer les atomes concernés par des liaisons formées selon les règles précédentes. On pourra donc créer des liaisons par appariement d'un électron célibataire d'un atome avec un électron célibataire d'un autre ou par le transfert d'un doublet d'un atome dans une case vide d'un autre. Cette construction des liaisons nécessite la connaissance des schémas de Lewis des atomes concernés. On utilise généralement la représentation de Lewis sous formes de cases quantiques. On représente ensuite les liaisons formées soit par des traits pour les liaisons de covalence normale soit par des flèches pour les liaisons de covalence datives. Les schémas de Lewis atomiques sont déduits de la configuration électronique des atomes obtenue par application des règles de Klechkowski et de Hund. La représentation obtenue correspond à l'état fondamental de plus faible énergie. Cet état fondamental ne permet pas toujours d'obtenir simplement les liaisons désirées. On sera souvent amener à modifier le schéma de Lewis atomique pour pouvoir obtenir plus facilement les liaisons voulues. Ces modifications correspondent à la création d'états excités. On utilise souvent la notion de valence d'un atome pour décrire simplement le nombre de liaisons que cet atome est susceptible de faire. La valence correspond le plus souvent au nombre d'électrons célibataires présents sur la couche de valence de l'élément étudié. Dans le modèle de Lewis se sont ces électrons célibataires qui formeront le plus souvent les liaisons chimiques en s'associant avec un autre électron célibataire d'un autre atome. Le doublet ainsi constitué formant la liaison chimique. Pour être rigoureux on devrait aussi tenir compte des cases vides et des doublets appariés puisque ceux-ci pourront participer à la création de liaisons datives, mais il est plus facile d'utiliser (au moins dans un premier temps) uniquement les liaisons covalentes normales.
La valence d'un atome peut être modifiée par l'utilisation des niveaux excités, ce qui facilitera la formation des liaisons désirées.
Voyons quelques exemples de ces modifications de valence par excitation.
Ainsi les configurations électroniques de type s2 p1 à un seul électron célibataire pourront facilement se transformer en s1 p2 a trois électrons célibataires. La valence passant alors de 1 à 3. De même les configurations en s2 p2 de valence 2 conduiront facilement à la valence 4 par excitation en s1 p3.
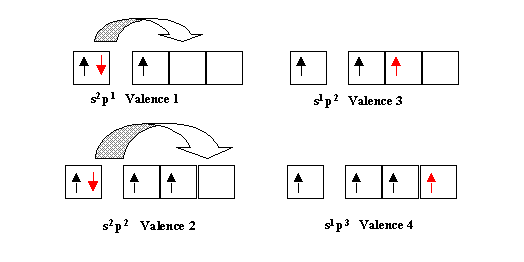
Un autre grand type d'excitation consiste à faire intervenir un niveau vide de la couche de valence (le plus souvent des cases p ou d).
Exemple des alcalino-terreux :
Ces éléments possède un doublet électronique qu'il est possible de désapparier pour permettre la création de deux liaisons de covalence normale.
A partir de la troisième période, les niveaux d vont pouvoir eux aussi intervenir et permettre d'augmenter la valence des atomes concernés.
Exemple des Halogènes (excepté le Fluor)
Les Halogènes possèdent apparemment la valence 1 mais il leur est possible d'acquérir les valences 3, 5 et 7 par excitations successives sur leurs niveaux d.
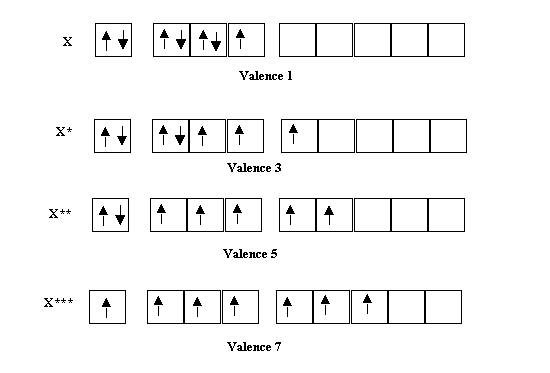
Remarque : Les états excités sont signalés par des étoiles * placées en exposant. Le nombre d'étoiles correspond au nombre d'excitations.
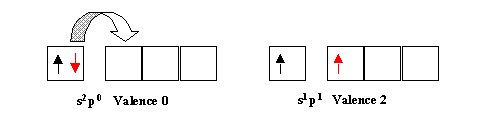
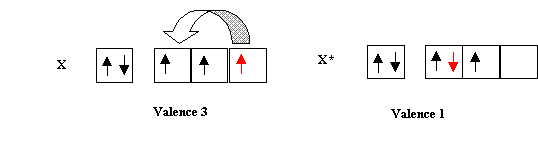
Toutes les excitations envisagées jusqu'ici avaient pour effet d'augmenter la valence des atomes. Il est quelquefois intéressant de diminuer celle-ci. Cela est possible par le mécanisme inverse. Au lieu de désapparier des doublets pour obtenir des électrons célibataires, il est possible d'apparier des électrons célibataires pour obtenir des doublets et ainsi diminuer la valence.
Exemple :
Technique de construction des schémas de Lewis moléculaires
Voyons sur un exemple (totalement fictif) comment on construit le modèle de Lewis d'une molécule.
Supposons qu'il existe une molécule (tout à fait hypothétique) de formule AB, entre deux atomes A et B de configurations électroniques respectives :
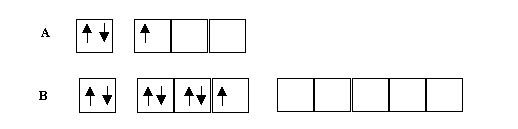
Nous supposerons ici que B possède un niveau d accessible, alors que A élément de la deuxième période n'en possède pas.
Le principe de construction consiste à associer les deux atomes par la création de liaisons de covalence (normales et/ou datives) entre eux. Il y a généralement plusieurs voies pour arriver au résultat. Bien souvent ces voies différentes conduiront à des schémas de Lewis moléculaires parfaitement identiques. Parfois deux voies conduiront à des schémas de Lewis moléculaires différents, on parlera alors de formes mésomères.
Dans cet exemple on peut envisager la démarche suivante :
Dans le schéma de Lewis moléculaire obtenu on constate que les deux atomes sont liés par une triple liaison. D'autre part, certains doublets électroniques n'ont participé à aucune liaison (doublets libres). Dans le schéma de Lewis moléculaire on ne devra pas oublier de représenter ces doublets libres qui conféreront des propriétés particulières à la molécule.
Notion de charge formelle :
Il ne faut pas croire que le schéma de Lewis moléculaire obtenu est forcément le "bon", il n'est pas encore tout à fait complet. Nous allons introduire une nouvelle notion importante : la notion de charge formelle.
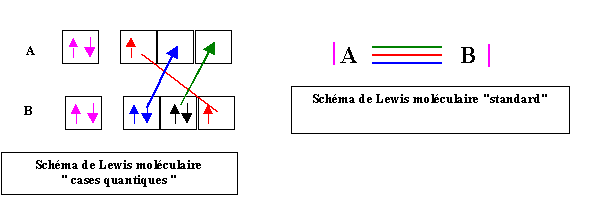
Si on examine le schéma de Lewis moléculaire représenté sous forme de cases quantiques, on constate qu'à cause des liaisons datives l'atome B à "donné" deux électrons a l'atome A. L'atome B a donc "perdu" 2 électrons, et porte donc deux charges positives. Inversement l'atome A a reçu deux électrons et porte donc deux charges négatives. En réalité ces charges sont fictives et n'existent que sur le papier, mais on ne doit pas oublier de les faire figurer sur le schéma de Lewis moléculaire.
On représentera donc celui-ci de la manière suivante :
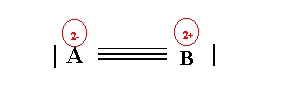
Il est possible retrouver ces charges partielles à partir du schéma de Lewis moléculaire "standard". Pour cela on répartit équitablement les électrons des doublets de liaisons entre les deux atomes puis on compte les électrons de chacun. Dans notre exemple A possède 5 électrons (le doublet libre et trois électrons de liaison) et il en est de même pour B. Or initialement l'atome A ne possédait que 3 électrons, il semble donc avoir gagné deux électrons (soit A2-). Inversement l'atome B qui en possédait initialement 7 semble en avoir perdu deux (soit B2+).
Si on a des problèmes pour voir ces charges formelles une règle simple permet leur calcul à priori.
q = n - l - 2e
n = nombre d'électron de la couche de valence de l'atome considéré dans son état normal isolé.
l = nombre de liaisons formé par l'atome considéré dans la molécule étudiée.
e = nombre de doublets libres pour l'atome considéré dans la molécule étudiée.
Ici par exemple qA = 3 - 3 - 2 = - 2 et qB = 7 - 3 - 2 = + 2
Voyons maintenant une autre manière de construire cette molécule.
On peut envisager la démarche suivante faisant intervenir des états excités.
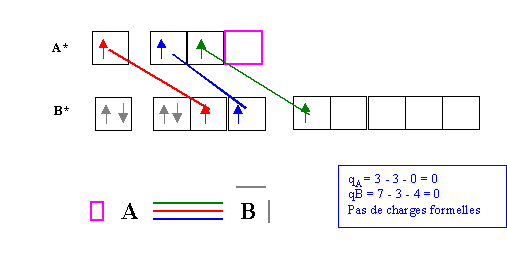
Dans ce nouveau schéma de Lewis moléculaire les atomes A et B sont toujours liés par une triple liaison mais ici A possède une case quantique vide et B possède deux doublets électroniques libres. A possède 3 électrons et B en possède 7, il n'y a donc pas de charges formelles.
Remarque : Par convention on représente les cases quantiques vides des niveaux p, mais jamais les cases quantiques vides des niveaux d (car il y en aurait trop !). Cela ne signifie pas que les cases quantiques vides de type d n'interviennent pas dans la chimie des composés en possédant ; au contraire (voir complexes des métaux de transition par exemple).
Envisageons une dernière possibilité (encore plus hypothétique) en ajoutant une liaison dative au cas précédent.
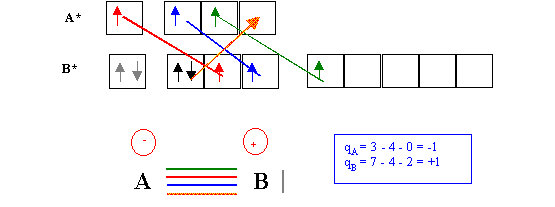
Le nouveau schéma de Lewis moléculaire obtenu comporte une quadruple liaison entre A et B. B ne possède plus qu'un doublet libre et A ne possède plus de case vide.
A possède 4 électrons (soit A-) et B en possède 6 (soit B+).
Nous avons donc obtenu trois descriptions différentes de la même molécule hypothétique. Comment choisir entre ces trois possibilités ?
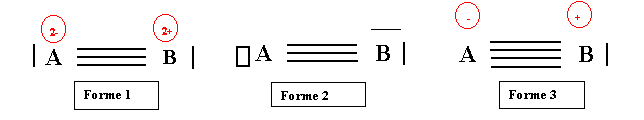
Avant de répondre à cette question, voyons s'il n'est pas possible de passer d'une forme à l'autre par simple déplacement d'électrons.
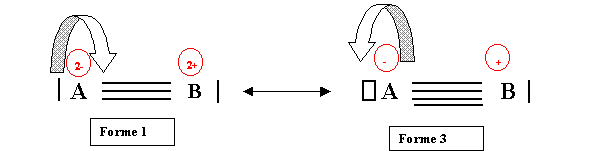
Passage de la forme 1 à la forme 3
Imaginons que le doublet libre de A se déplace pour venir entre les atomes A et B.
A perd son doublet libre et acquiert donc une case vide. La triple liaison devient quadruple. L'atome A perd un électron (et devient donc A-) puisque son doublet propre devient un doublet partagé. Inversement B gagne un électron et devient donc B+. On obtient donc bien la forme 3. Le processus inverse assure le passage de la forme 3 à la forme 1.
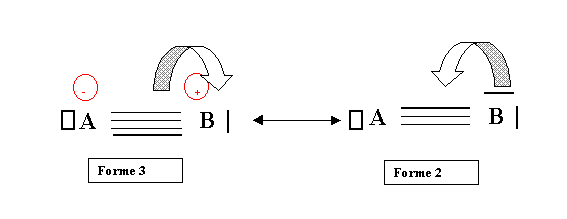
Passage de la forme 3 à la forme 2 :
Imaginons qu'un des doublets de liaison se déplace vers l'atome B. La liaison quadruple devient triple. L'atome B gagne un doublet libre. A perd un électron et B en gagne un. On obtient donc bien la forme 2. Le déplacement inverse assure le passage de la forme 2 à la forme 3.
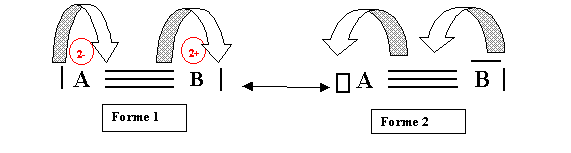
Passage de la forme 1 à la forme 2 :
Il suffit que les deux déplacements se produisent simultanément pour passer directement de la forme 1 à la forme 2. Ici aussi il suffit d'inverser le sens des flèches pour assurer le passage dans l'autre sens.
Notion de Formes Mésomères :
Les trois schémas de Lewis moléculaires peuvent donc être déduits les uns des autres par des déplacements électroniques. On dit qu'il s'agit de trois formes mésomères de la molécule AB. Ce cas de figure est fréquemment rencontré quand on a affaire à des liaisons multiples ; on parle de délocalisation des électrons. La molécule réelle n'est parfaitement décrite par aucune de ses formes mésomères. Chaque forme mésomère peut être utilisée pour décrire un aspect de la réactivité de la molécule, mais ne peut décrire à elle seule la totalité des propriétés chimiques de la molécule réelle. On dit que la molécule réelle est un hybride de toutes ses formes mésomères. On emploie souvent le mot de résonance pour décrire ce phénomène. Chaque forme mésomère est une forme limite de résonance, la molécule réelle est un hybride de résonance entre ces formes limites. Nous reviendrons sur ces notions dans des exemples réels.
Remarque : les doubles flèches utilisées ne signifient pas qu'il y ait un équilibre chimique entre les diverses formes. Ce symbolisme signifie simplement que la molécule réelle est intermédiaire entre toutes ces formes limites. De même les déplacements électroniques utilisés pour passer d'une forme à une autre ne sont pas des déplacements réels. Ils symbolisent seulement notre ignorance de leur localisation réelle. Nous verrons dans le modèle quantique que la localisation précise des électrons est de toute manière impossible.
Nous pouvons maintenant revenir à la question première.
Comment choisir entre les diverses formes mésomères ?
Toutes les formes limites n'ont pas le même pouvoir descriptif, certaines décrivent beaucoup mieux la molécule réelle que d'autres. On dit que les diverses formes n'ont pas le même poids statistique. Quelques règles simples permettent de classer les diverses formes limites selon leur poids statistique.
1) Il n'existe que des liaisons simples, doubles ou triples.
Dans notre exemple la forme 2 n'a aucune existence réelle, son poids statistique sera nul.
2) Le nombre de liaisons doit être maximal pour la forme de plus haut poids statistique. Toutefois ce nombre de liaisons ne peut excéder le nombre de liaisons maximal que puisse faire l'atome concerné. Ce nombre maximal de liaisons est prévisible, il correspond simplement aux nombre de cases quantiques dont l'atome peut disposer sur sa couche de valence. En effet, un atome peut faire une liaison soit par un électron célibataire, soit par un doublet libre si son partenaire possède une case vide, soit par une case vide si son partenaire possède un doublet libre. En définitive le nombre de liaisons possible est bien égal au nombre total de cases quantiques de la couche de valence que celles-ci soient vide, totalement occupées (doublet libre) ou à 1/2 occupées (électron célibataire).
En résumé :
Pour un atome de la première période (H, He) le nombre de liaison maximal est de 1.
Pour un atome de la deuxième période le nombre de liaison maximal est de 4.
Pour les atomes des autres périodes le nombre de liaisons pourra être plus élevé grâce aux possibilités d'excitations sur les niveaux d (9 liaisons sont théoriquement possibles).
Remarque : Le nombre maximal de liaisons que peut faire un atome dépend aussi de la présence d'éventuels doublets libres. Chaque doublet libre présent comptera pour une liaison et le nombre réel de liaisons possibles sera donc diminué d'une unité par doublet libre présent.
3) Les charges formelles doivent si possible respecter l'électronégativité des éléments concernés. Les charges négatives correspondant aux atomes les plus électronégatifs.
4) Les charges doivent être réparties sur le plus grand nombre de sites possibles. Un atome portera rarement plusieurs charges. Deux atomes adjacents porteront rarement deux charges simultanément et encore plus rarement des charges de même signe.
5) Si cela est possible la règle de l'octet sera respectée pour le plus grand nombre d'atomes.
Ces règles sont avant tout des règles de bon sens et le choix de la bonne forme mésomère la plus représentative est généralement assez aisée.
Exemples d'applications à des molécules réelles :
1) Ion Nitrate NO3-
Nous avons ici affaire à un ion moléculaire polyatomique. Il faut d'abord savoir quel est l'atome central de l'édifice. En général l'atome central est précisé et souligné. Ici il s'agit de l'atome d'azote. Si l'atome central n'est pas connu, on devra envisager les diverses possibilités ce qui allonge le travail. Nous supposerons de plus que cette molécule est non cyclique.
Nous devons ensuite écrire le schéma de Lewis de chacun des atomes concernés.
Ce sera notre matériel de départ.
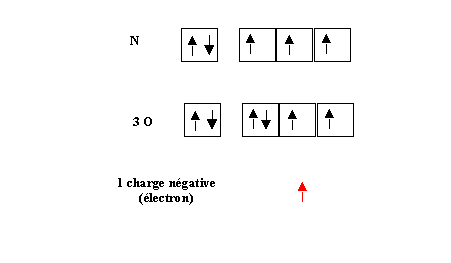
Nous allons tout d'abord attribuer l'électron supplémentaire. Nous pouvons décider arbitrairement l'attribution de cet électron à n'importe quel atome de notre choix. Mais autant procéder logiquement, l'oxygène étant plus électronégatif que l'azote c'est à lui qu'il vaut mieux attribuer l'électron supplémentaire.
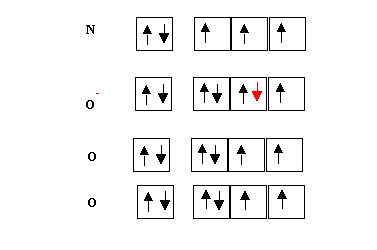
Il nous faut maintenant construire les liaisons. L'azote étant l'atome central il devra être lié aux trois atomes d'oxygène, il possède 3 électrons célibataires alors que les oxygènes en possèdent 5. Comme le modèle de Lewis exige des appariements d'électrons il ne doit normalement rester aucun électron célibataire (nous verrons plus tard que cela n'est pas toujours vrai dans le cas particulier des radicaux). Comme l'azote et l'oxygène sont des éléments de la deuxième période, ils ne possèdent pas de niveaux d et on ne peut donc augmenter leur valence par excitation. Il nous reste donc la solution de diminuer la valence d'un des atomes d'oxygène.
On peut alors former trois liaisons de covalence normale et une liaison de coordination. Il ne reste plus qu'a représenter le schéma de Lewis moléculaire standard de cette molécule, sans oublier d'y faire figurer les charges formelles. L'atome d'azote ayant perdu un électron portera une charge positive, et deux des atomes d'oxygène ayant gagné un électron porteront une charge négative.
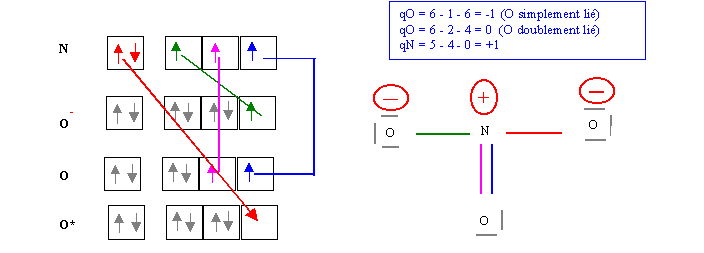
Il reste à envisager l'existence d'éventuelles formes mésomères. On pourrait pour cela envisager d'autres constructions possibles de cette molécule mais il est plus simple d'envisager des déplacements électroniques.
Les seuls doublets susceptibles de se déplacer sans provoquer une cassure de la liaison sont les doublets libres ou les doublets appartenant à des liaisons multiples.
Envisageons une première possibilité en faisant se rabattre un doublet libre de l'oxygène pour former une double liaison.
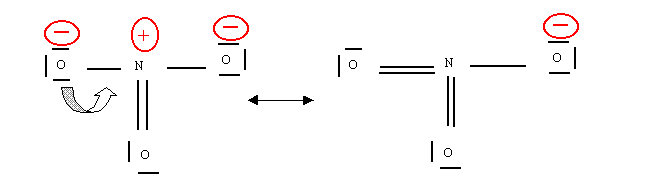
Cette nouvelle forme peut paraître séduisante à première vue puisqu'elle augmente le nombre de liaisons et fait disparaître deux charges, tout en respectant l'électronégativité. Elle est néanmoins impossible puisque dans ce cas l'atome d'azote ferait 5 liaisons ce qui lui est interdit de par son appartenance à la deuxième période.
On ne peut donc laisser subsister cette cinquième liaison. Il est possible d'éviter ce problème si on envisage que le doublet appartenant à l'autre liaison double se rabatte simultanément sur l'autre atome d'oxygène.
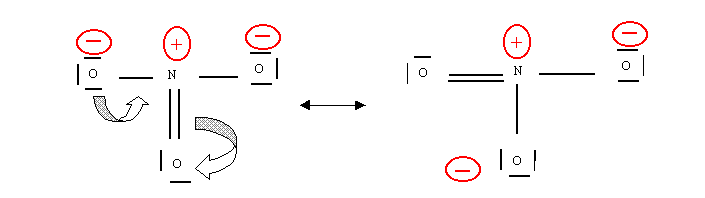
On voit que la forme obtenue est en réalité identique à la première, deux oxygènes ayant simplement échangé leurs rôles. On peut donc prévoir une troisième forme ou ce serait le troisième oxygène qui serait doublement lié à l'azote. Finalement en tenant compte de ces trois formes les trois oxygènes sont indiscernables et les trois liaisons sont identiques entre elles intermédiaire entre des simples liaisons et des doubles liaisons. On résume souvent ces observations par le schéma suivant qui essai d'être représentatif de la molécule réelle.
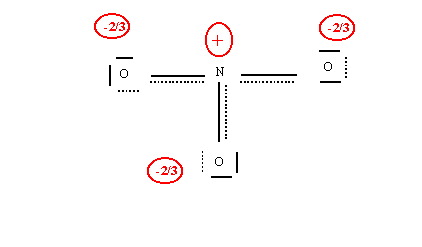
Dans ce formalisme, les traits pointillés représente les doublets susceptibles d'être délocalisés. Les liaisons ne sont ni doubles ni simples mais intermédiaires entre les deux. Nous verrons que cela se traduit expérimentalement par une longueur de liaison intermédiaire entre celles des simples et des doubles. Les doublets libres de l'oxygène indiqués en pointillés sont le plus souvent omis dans ce type de schéma. La charge fractionnaire des oxygènes figure simplement que deux charges négatives sont réparties sur 3 centres identiques.
Maintenant, il reste à vérifier que cette forme respecte bien les diverses règles énoncées plus haut.
L'azote fait 4 liaisons ce qui est conforme à sa période. Les charges sont bien réparties, aucun atomes ne porte de charges multiples et l'électronégativité est respectée. Les trois atomes sont entourés de 4 doublets et la règle de l'octet est donc vérifiée pour tous. Tous ces indices font supposer que cette structure de Lewis est correcte et bien représentative de la molécule (haut poids statistique). On peut alors se demander si on n'aurais pas pu trouver d'autre structure si on avait procédé différemment.
Voici une autre construction dans laquelle on attribue l'électron célibataire à l'atome d'azote et on excite deux oxygènes. On obtient la même structure que précédemment.
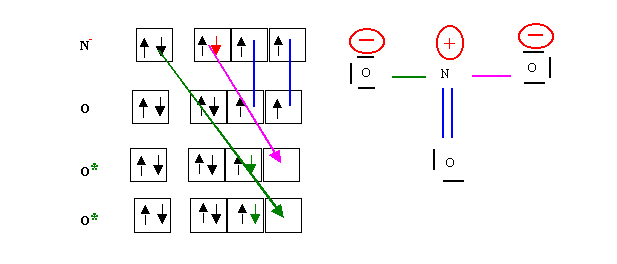
Cela montre que la façon dont on construit la molécule à peu d'importance et qu'on est libre de faire ce que l'on veut des matériaux de départ. Le seul risque encouru est en fait de tomber sur une forme mésomère très peu représentative, mais on pourra toujours se débrouiller pour la modifier par des déplacements électroniques pour obtenir une forme mésomère plus représentative.
Cette remarque est à la base d'une technique plus rapide d'obtention des structures de Lewis.
Méthodes rapides de détermination des schémas de Lewis moléculaires
La méthode que nous avons détaillée présente le grand avantage de la simplicité et de la clarté, mais elle présente l'inconvénient d'être un peu longue. Il est possible de déterminer beaucoup plus rapidement le schéma de Lewis moléculaire en utilisant les règles suivantes :
1) On suppose que l'atome central peut utiliser tous les électrons présents sur sa couche de valence pour contracter des liaisons avec les atomes latéraux. Cela revient a supposer qu'il existe un hypothétique état excité dans lequel tous les électrons de l'atome central sont célibataires. On pourra alors construire la molécule uniquement avec des liaisons de covalence normales. On compte donc tous les électrons de la couche de valence de l'atome central. Soit C ce nombre.
2) Dans le cas des ions moléculaires la charge de l'ion est supposée être celle de l'atome central. On ajoute donc autant d'électrons à l'atome central qu'il y a de charges négatives. Inversement on enlève autant d'électrons à l'atome central qu'il y a de charges positives. On ajoute (ou enlève) donc la charge Q de l'ion au nombre C trouvé précédemment. Soit N le nombre trouvé. N = C +/- Q
3) On suppose que les atomes latéraux n'utilisent que leurs électrons célibataires pour se lier à l'atome central. Cela revient à dire qu'ils s'unissent à lui par une liaison simple s'il possède 1 électron célibataire, double s'ils en possèdent 2 et triple s'ils en possèdent 3.
4) Sur les hypothèses précédantes on construit un premier schéma de Lewis moléculaire, faisant apparaître les diverses liaisons simples ou multiples unissant l'atome central aux autres atomes.
5) On dénombre ensuite les électrons appartenant à l'atome central engagés dans des liaisons. Ce nombre est égal au nombre total des liaisons puisqu'on a supposé qu'il n'y avait que des liaisons de covalence normales dans lesquelles chaque atome fournit un électron. Soit L le nombre trouvé.
6) On retranche ensuite le nombre total des électrons de liaison L du nombre total d'électrons de l'atome central N. Le nombre E obtenu correspond au nombre d'électrons de l'atome central non utilisés pour des liaisons. E = N - L. Il suffit de diviser ce nombre par deux pour obtenir le nombre de doublets libres de l'atome central.
7) On complète ensuite le schéma de Lewis moléculaire écrit précédemment en y faisant figurer les doublets libres de l'atome central ainsi que ceux des atomes latéraux. On y fait aussi figurer les éventuelles charges formelles.
8) Le schéma obtenu correspond souvent à une forme mésomère de faible poids statistique, voire à une forme impossible. On corrigera donc le schéma obtenu par des déplacements électroniques judicieux pour obtenir une forme plus représentative à haut poids statistique.
Pour illustrer cette méthode nous allons l'appliquer au cas de NO3- traité précédemment.
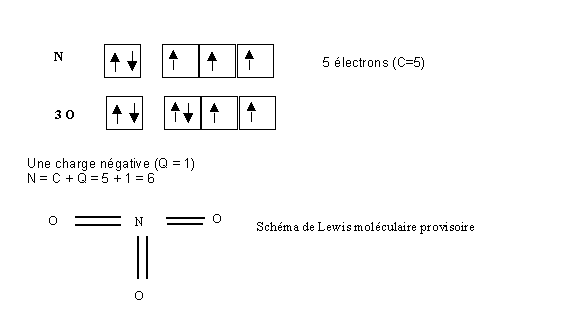
Le nombre d'électrons engagé dans des liaisons L est de 6, puisqu'il y a 6 liaisons et que chaque atome y contribue à égalité. L'atome d'azote utilise donc tous ses électrons pour faire des liaisons et ne possède donc pas de doublets libres E = N - L = 6 - 6 = 0
Il nous suffit donc d'ajouter les doublets libres des atomes d'oxygène et à faire figurer les charges
formelles pour obtenir la structure de Lewis moléculaire complète.
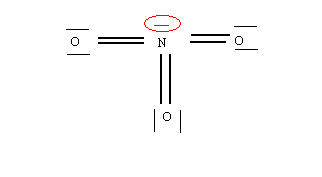
La structure obtenue par cette technique possédera toujours un maximum de liaisons.
Ici on obtient 6 liaisons autour de l'azote, ce qui est impossible puisqu'en tant qu'élément de la deuxième période il ne peut en avoir que 4 au maximum. De plus l'électronégativité n'est pas respectée puisque O est plus électronégatif que N c'est O qui devrait porter la charge négative. Toutes ces raisons conduisent à rejeter cette structure et essayer de la modifier. Cela est possible par des déplacements électroniques judicieusement choisis. Puisque nous avons deux liaisons en trop, nous allons les supprimer par rabattement des doublets de liaison vers les oxygènes.
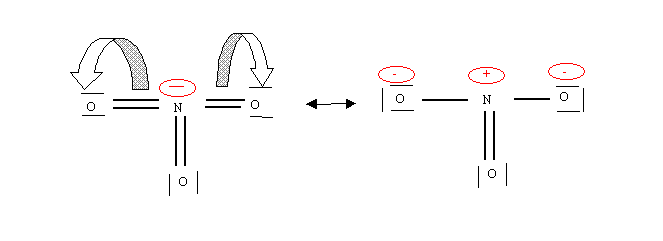
Nous retrouvons bien ainsi, la structure établie précédemment.
Cette technique rapide est efficace, mais il est néanmoins plus prudent de ne l'utiliser qu'a titre de vérification, au moins dans un premier temps jusqu'à ce que le modèle de Lewis soit bien maîtrisé. Le schéma sous forme de cases quantiques étant bien plus parlant et permettant de mieux comprendre la construction de la molécule, il est important de le représenter, même si l'on n'utilisera par la suite que les schémas "standards". Ces schémas seront très utilisés pour comprendre la réactivité des molécules. Ils sont en particulier indispensables pour décrire les mécanismes réactionnels. Vous serez donc amené à les manipuler très souvent et il est important d'avoir bien compris leur "construction", avec de l'habitude vous pourrez très rapidement imaginer le schéma de Lewis moléculaire de n'importe quelle molécule "à l'instinct" mais il sera préférable de vérifier votre hypothèse avec les techniques vues ici pour éviter des erreurs. Ce modèle très simple ne permet pas d'expliquer toutes les propriétés moléculaires, il est beaucoup trop "simpliste" pour cela. Un modèle beaucoup plus complexe appelé modèle quantique à été développé qui rend mieux compte de la réalité moléculaire. Nous étudierons les principes de base de ce modèle quantique un peu plus tard. Le modèle quantique est toutefois mathématiquement très complexe et son utilisation courante est de ce fait très difficile. Le modèle de Lewis est donc toujours (et sans doute pour longtemps encore) très utilisé par les chimistes du monde entier et compris par tous. Il constitue un langage commun et permet une description simple de beaucoup de faits chimiques. Il est donc indispensable de le maîtriser. Pour terminer nous allons traiter un autre exemple celui de l'ion sulfate, en T.D de nombreux autres exemples seront étudiés…
Remarque : Il existe une troisième technique encore plus rapide que celle-ci. On se contente de dénombrer tous les électrons des couches de valence des atomes concernés. On ajoute la charge pour un anion ou on enlève la charge pour un cation. On divise par deux le nombre obtenu, on obtient ainsi le nombre total de doublets. On répartit ensuite ces doublets entre liaisons et doublets libres pour obtenir le schéma de Lewis moléculaire. Le problème avec cette technique est qu'elle n'est facilement utilisable qu'avec une longue pratique et une grande habitude qui seule peut guider dans l'attribution correcte des doublets. Cette technique est donc déconseillée aux débutants. Elle peut par contre constituer un bon moyen de vérification du résultat obtenu. Voyons ce qu'elle donnerait ici.
N : 5 électrons
3 O : 6 électrons * 3 = 18 électrons
1 Charge négative : 1 électron
Soit un total de 24 électrons soit 12 paires.
Le problème est alors de répartir ces paires entre les divers atomes…
La structure établie présente bien un total de 12 paires : 4 doublets de liaisons et 8 doublets libres.
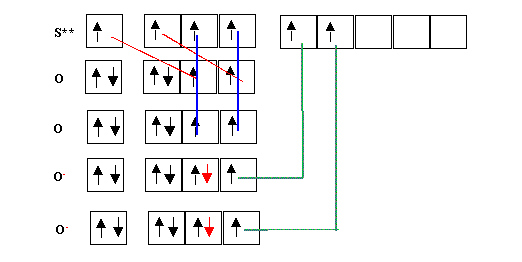
Cas de l'ion Sulfate SO42-
Nous allons ici utiliser les méthodes rapides puis vérifier notre résultat par la première méthode.
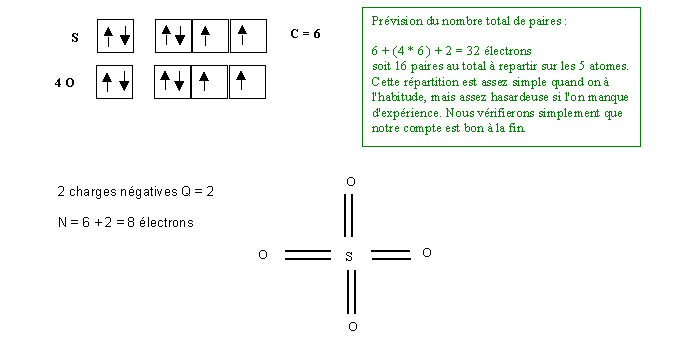
Il y a 4 double liaisons, soit 8 liaisons au total. L = 8
E = N - L = 8 - 8 = 0
Le soufre ne possède donc pas de doublets libres.
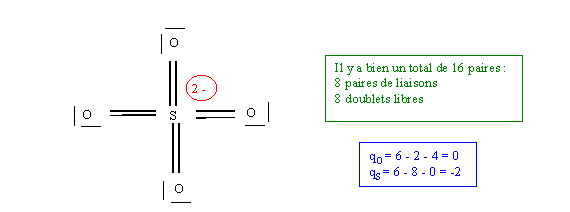
Cette structure possède 8 liaisons, cela n'est pas impossible puisque S est de la troisième période. L'atome de soufre porte deux charges négatives (8 électrons au lieu de 6 ) ce qui est beaucoup, de plus O est plus électronégatif que S et devrait donc être porteur des charges négatives. Nous allons donc "améliorer" cette structure en transférant des doublets de liaisons vers O, ce qui enlèvera les charges négatives de S pour les donner aux oxygènes.
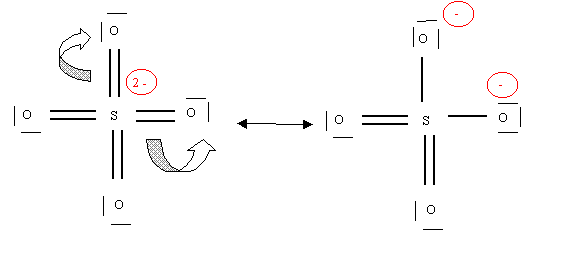
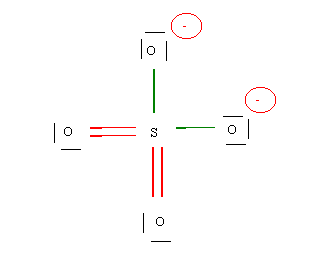
La structure obtenue est en réalité multiple puisque les oxygènes peuvent échanger leur rôles.
Il existe en fait 6 formes équivalentes qu'on peut représenter schématiquement ainsi :
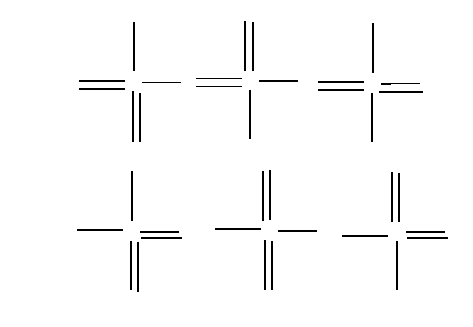
La molécule réelle sera donc un hybride de résonance qu'on pourra représenter ainsi :
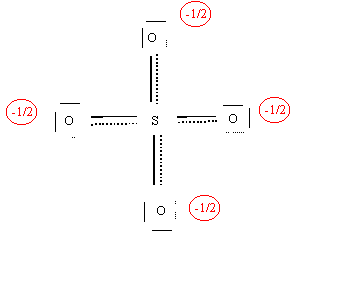
Remarque : Il s'agit là de la forme mésomère la plus représentative de la molécule. D'autre formes de poids statistique moindre peuvent aussi exister.
Par exemple une forme avec 4 simples liaisons
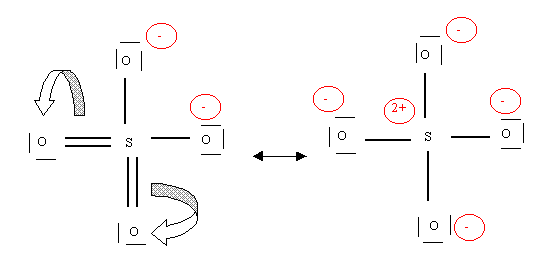
Ou une forme avec 4 liaisons doubles
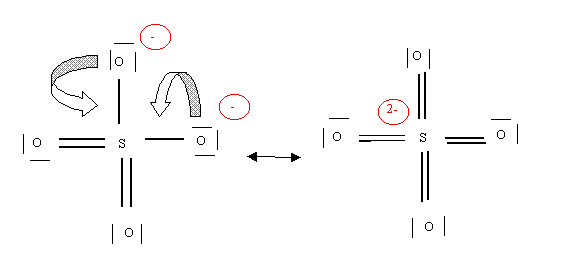
Ces formes limites n'auront qu'un faible poids statistique en raison essentiellement des deux charges portées par l'atome de soufre. Elles contribuent néanmoins à décrire la molécule en montrant que les liaisons sont toutes identiques entre elles et intermédiaires entre des liaisons simples et doubles.
Il ne nous reste plus qu'a construire le schéma de Lewis sous forme de cases quantiques à titre de vérification. Nous ne le ferons que pour la forme la plus représentative.
Les deux exemples que nous venons de traiter n'impliquait pas la présence de doublets libres sur l'atome central. Nous allons étudier maintenant un tel cas de figure.
La molécule d'Ozone O3
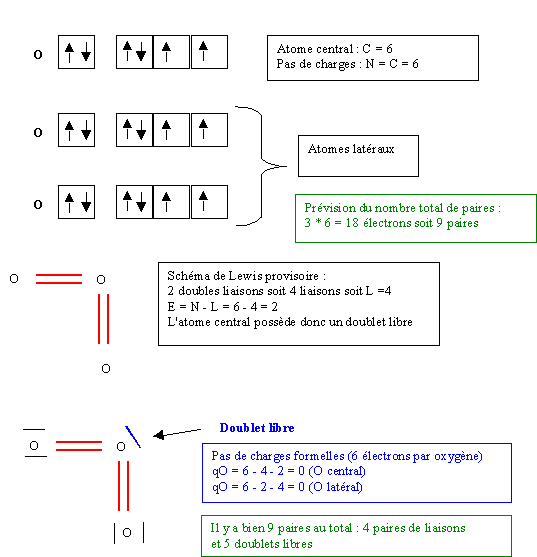
Cette structure paraît à première vue satisfaisante mais en réalité elle est impossible car le doublet libre comptant comme une liaison supplémentaire l'atome d'oxygène central porterait 5 liaisons ce qui lui est interdit par son appartenance à la deuxième période. Pour remédier à ce problème il suffit de rabattre une des liaisons vers un des oxygènes latéraux.
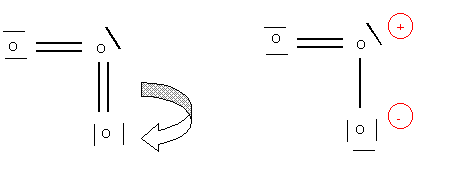
Cette forme est en réalité double puisque les oxygènes latéraux peuvent échanger leurs rôles.
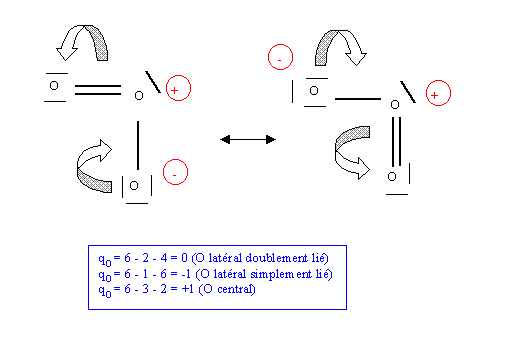
Soit la représentation schématique de la molécule réelle :
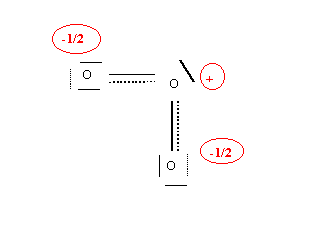
Et la construction sous forme de schéma de Lewis "cases quantiques" :
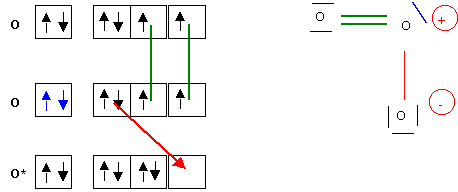
QUELQUES APPLICATIONS PRATIQUES DU MODELE DE LEWIS :
Détermination des nombres d'oxydation des atomes :
La connaissance du schéma de Lewis moléculaire permet de déterminer facilement le nombre d'oxydation d'un atome dans une structure complexe. Les règles habituellement utilisées pour cette détermination (voir cours sur 'oxydoréduction) dérivent d'ailleurs directement du modèle de Lewis.
Démarche à suivre :
Exemple d'application
Acide acétique : CH3COOH
Le schéma de Lewis de cette molécule est bien connu.
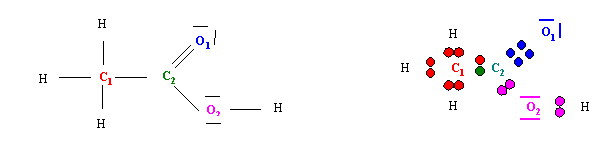
Calculons les nombres d'oxydation de C1, C2, O1 , O2 et H.
Les électrons sont symbolisés par des points de la couleur de l'atome a qui ils sont attribués en fonction des électronégativités respectives. C est plus électronégatif que H, O est plus électronégatif que C et que H. Il ne reste plus qu'a compter les électrons de chaque atome. C1 possède 7 électrons. C2 possède un seul électron. O1 et O2 possèdent chacun 8 électrons. Les atomes d'Hydrogène ne possèdent aucun électron. Il suffit ensuite de comparer avec le nombre normal d'électrons de chaque atomes pour trouver les nombres d'oxydation. C possède normalement 4 électrons de valence, O possède normalement 6 électrons de valence et H possède normalement 1 électron de valence.
C1 a gagné 3 électrons son nombre d'oxydation sera 4 - 7 = -3 à C (- III)
C2 a perdu 3 électrons son nombre d'oxydation sera 4 - 1 = 3 à C (+ III)
O1 et O2 ont gagnés chacun 2 électrons leur nombre d'oxydation sera 6 - 8 = -2 à O (-II)
Les atomes d'hydrogène ont chacun perdu 1 électron leur nombre d'oxydation sera 1- 0 =1 à H (+I)
Quelques molécules types :
Acide de Lewis : Toute molécule possédant une case quantique vide sera appelée acide de Lewis
Exemple : AlCl3
Base de Lewis : Toute molécule possédant un doublet libre sera appelée base de Lewis
Exemple : NH3, H2O
Les acides de Lewis seront avides d'électrons (pour compléter leur couche de valence) on dira que ce sont des électrophyles.
Les bases de Lewis seront au contraire des nucléophyles en raison de leur affinité pour les charges positives (noyaux).
Les bases de Lewis feront facilement des liaisons de coordination avec les acides de Lewis. Ce type de réactions expliquera non seulement les réactions acido-basiques classiques mais aussi la formation des complexes. Nous y reviendrons ultérieurement.
Radicaux : On appellera radicaux toutes les molécules qui possèdent un nombre impair d'électron sur leurs couches de valence. Ce type de molécules n'est pas prévu par la théorie de Lewis et sont généralement des composés instables et très réactifs. Nous en verrons des exemples en Travaux Dirigés. L'électron célibataire est symbolisé par un point.
Rupture des liaisons de covalence :
La liaison entre deux atomes peut être rompue sous l'action de la chaleur ou celle de radiations lumineuses. On observe deux processus différents :
Rupture homolythique : Chaque atome prend un des électrons du doublet de liaison. Ce processus photochimique est l'inverse de celui de la formation des liaisons de covalence normale. Les produits obtenus sont des radicaux.
H - Cl à H. + Cl.
Rupture hétérolythique : Un atome prend le doublet de liaison, et l'autre se retrouve avec une case vide. Ce processus thermique est l'inverse de celui de la formation des liaisons de coordination. Les produits obtenus sont des ions.
H - Cl à H+ + Cl-
Conclusion :
Ce modèle très simple ne permet pas d'expliquer toutes les propriétés moléculaires, il est beaucoup trop "simpliste" pour cela. Un modèle beaucoup plus complexe appelé modèle quantique à été développé qui rend mieux compte de la réalité moléculaire. Nous étudierons les principes de base de ce modèle quantique un peu plus tard. Le modèle quantique est toutefois mathématiquement très complexe et son utilisation courante est de ce fait très difficile. Le modèle de Lewis est donc toujours (et sans doute pour longtemps encore) très utilisé par les chimistes du monde entier et compris par tous. Il constitue un langage commun et permet une description simple de beaucoup de faits chimiques. Il est donc indispensable de bien le maîtriser.