
INTERACTIONS DE FAIBLES ENERGIES
Nous avons vu jusqu'à présent que les atomes interagissaient entre eux pour former des liaisons chimiques et donc des molécules. Nous allons maintenant envisager des interactions entre les molécules elles même.
Rappels sur les trois états de la matière :
Le même corps peut exister sous trois états différents selon les conditions de température et de pression (voir cours de thermodynamique). Ces trois états étant l'état solide, l'état liquide et l'état gazeux. Rappelons brièvement les propriétés particulières de ces trois états :
Etat Solide : Un solide possède un volume et une forme qui lui sont propres.
Etat Liquide : Un liquide possède un volume qui lui est propre, en revanche il prend la forme du récipient qui le contient et ne possède donc pas de forme propre.
Etat Gazeux : Un gaz ne possède ni forme ni volume propre. Comme un liquide il prend la forme du récipient qui le contient mais il occupe de plus tout l'espace mis à sa disposition.
Ces différences de comportement peuvent être interprétées par des interactions entre molécules :
- A l'état gazeux les molécules sont pratiquement indépendantes les unes des autres, il n'y donc pas d'interactions entre elles. C'est le modèle du gaz parfait étudié en thermodynamique. Les molécules étant parfaitement indépendantes pourront se déplacer librement, elles occuperont donc tout le volume qui leur sera offert et le gaz occupera totalement la forme et le volume du récipient qui le contiendra. L'état gazeux correspond donc à une liberté totale (entropie élevée).
- A l'état liquide, une certaine liberté est laissée aux molécules mais il existe des interactions entre elles. Ces interactions font que les molécules ne sont plus entièrement libres, le liquide possède une certaine cohésion qui va lui conférer un volume propre. Le liquide n'occupera donc pas tout le volume qui lui est offert, en revanche il épousera la forme du récipient qui le contient car il conserve sa propriété de fluidité (le liquide coule). Il possédera une surface libre horizontale si son volume propre est inférieur à celui du récipient qui le contient. Cet état liquide possède donc une entropie plus faible que l'état gazeux soit une organisation plus grande et un état plus ordonné.
- Enfin, l'état solide correspond à des interactions plus fortes qui vont diminuer encore la liberté des molécules. Le solide ne coulera donc pas et possédera une forme propre. Il existe néanmoins encore une certaine liberté des molécules qui pourront se déplacer légèrement les unes par rapports aux autres, le solide pourra donc par exemple se dilater si sa température augmente.

Effet de la température :
La température correspond à l'énergie cinétique moyenne des molécules. Si l'on chauffe un solide on communique une énergie cinétique supérieure aux molécules qui vont se déplacer et donc s'écarter les unes des autres, cela correspond à la dilatation du solide. A une certaine température les molécules acquièrent une énergie cinétique suffisante pour vaincre la plupart des forces d'attractions intermoléculaires et on passe brusquement à l'état liquide. Cette température critique est le point de fusion du solide. En continuant le chauffage, le liquide va à son tour se dilater. Quand l'énergie cinétique sera suffisante pour vaincre toutes les interactions intermoléculaires du liquide on va passer brusquement à l'état gazeux, cela correspond au point d'ébullition du liquide. On voit donc que les températures de changement d'état sont des mesures des interactions intermoléculaires. Les corps possédant des températures de changement d'état peu élevées correspondent à des corps pour lesquels les interactions intermoléculaires sont faibles. Inversement les corps pour lesquels les interactions moléculaires seront importantes auront des températures de changement d'état plus élevées. Il faut nuancer cela en considérant la masse des molécules, il est évidant que déplacer une grosse molécule nécessitera une plus grande énergie que le déplacement d'une molécule plus légère. La masse molaire est donc un facteur important, on constate que pour des molécules d'une même série c'est à dire possédant des propriétés proches le point d'ébullition augmente régulièrement avec la masse molaire.
Nature des interactions intermoléculaires - Forces de Van der Waals
Les forces responsables de la cohésion des liquides et des solides sont des forces d'attraction intermoléculaires ces forces sont désignées sous le nom générique de forces de Van der Waals. Elles sont néanmoins de différentes natures et nous allons en distinguer plusieurs sortes.
1) Interactions entre dipôles permanents - Forces de Keesom
Nous avons vu que certaines molécules possédaient un moment dipolaire permanent. Il va exister entre ces molécules des interactions électrostatiques importantes en raison de la présence de charges électriques localisées. Ces interactions entre dipôles permanents ont reçu le nom de Forces de Keesom. Les molécules présentant ce type d'interactions auront tendance à s'orienter les unes par rapport aux autres de façon à ce que leurs pôles respectifs s'attirent les uns les autres. Pour vaincre ces attractions intermoléculaires il faudra fournir une énergie supplémentaire et les corps de ce type auront des températures de changement d'état plus élevées pour des masses molaires du même ordre de grandeur. Par exemple, le butane (CH3 - CH2 - CH2 - CH3) et l'acétone (CH3-CO-CH3) ont des masses molaires identiques mais des points d'ébullitions et de fusion très différents.
Butane : Tf = - 138 °c - Teb = - 0,5 °C
Acétone : Tf = - 95°c - Teb = + 56 °C
Cela provient du fait que l'acétone possède une liaison C=O fortement polarisée alors que le butane n'en possède pas, les électronégativité de C et H étant pratiquement identiques.
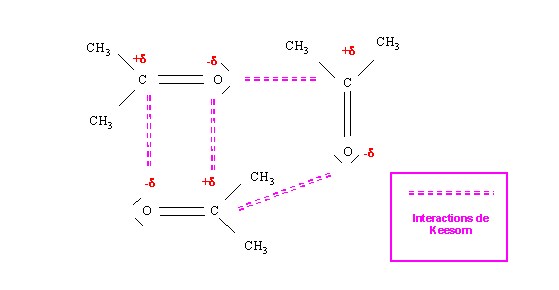
Ce type d'interactions est très courant et influe fortement sur les propriétés moléculaires.
Un type particulier d'une grande importance tant pratique que théorique de cette forme d'interaction, a reçut le nom de liaison Hydrogène.
LIAISON HYDROGENE :
Liaison Hydrogène Intermoléculaire :
Cette interaction de type Keesom se rencontre dans les molécules comportant des atomes d'hydrogène liés à des atomes très électronégatifs F, O et N essentiellement. Dans ce cas les interactions sont si fortes, que l'ordre de grandeur de l'énergie associée atteint de 10 à 30 KJmol-1 ce qui les rapprochent des liaisons de covalence (100 KJmol-1) et justifie leur nom de liaison hydrogène. On peut alors parler de véritables associations intermoléculaires qui peuvent même subsister à l'état gazeux. L'existence de liaisons hydrogène va entraîner des modifications importantes des propriétés moléculaires. Un des aspects le plus spectaculaire étant la forte élévation des températures de changements d'états comme le montre les exemples suivants.
Composés hydrogénés des éléments des colonnes 14,15,16 et 17 :
Colonne |
Masse Molaire |
Point de Fusion TF (en °C sous P =1 atm) |
Point d'Ebullition TEb (en °C sous P =1 atm) |
|
17 |
HF |
20 |
-83 |
19 |
17 |
HCl |
36.5 |
-114 |
-85 |
17 |
HBr |
81 |
-87 |
-67 |
17 |
HI |
128 |
-51 |
-35 |
16 |
H2O |
18 |
0 |
100 |
16 |
H2S |
34 |
-85 |
-60 |
16 |
H2Se |
81 |
-66 |
-42 |
16 |
H2Te |
129 |
-49 |
-2 |
15 |
NH3 |
17 |
-77 |
-33 |
15 |
PH3 |
34 |
-134 |
-88 |
15 |
AsH3 |
78 |
-117 |
-62 |
15 |
SbH3 |
125 |
-91 |
-18 |
14 |
CH4 |
16 |
-182 |
-161 |
14 |
SiH4 |
32 |
-185 |
-112 |
14 |
GeH4 |
76.5 |
-166 |
-88 |
14 |
SnH4 |
123 |
-150 |
-52 |

Les représentations graphiques montrent que les composés NH3, H2O et HF présentent des températures de changement d'état anormalement élevée par rapport à leurs homologues de la même colonne de la classification périodique. Ainsi sans les fortes interactions de Keesom l'eau devrait être gazeuse à température ambiante ce qui n'aurait pas permis à la vie de se développer sur terre. Une autre implication importante des liaisons Hydrogène est qu'elles sont responsables de la structure tridimensionnelle en hélice des brins d'ADN.
On représente généralement les liaisons Hydrogène par des traits pointillés de la manière suivante :

Les atomes A et B sont forcément très électronégatifs (en général F, O ou N). Les atomes participant ont de telles liaisons sont alignés. L'énergie des liaisons hydrogène étant beaucoup plus faible que celles des liaisons covalentes normales leur longueur sera sensiblement plus élevée de l'ordre de 2 à 3 Å.

Les liaisons Hydrogène sont présentes dans de nombreux composés comme les alcools, les aldéhydes, les acides carboxyliques, les amides etc. Dans ces deux derniers cas on obtient des dimères suffisamment stables pour subsister même à l'état gazeux.

Liaisons Hydrogènes Intramoléculaires
Un cas particulier important est la liaison Hydrogène intramoléculaire qui peut se produire si la géométrie moléculaire est favorable. La liaison Hydrogène se fait alors entre deux atomes appartenant à la même molécule. Cette liaison Hydrogène intramoléculaire modifie comme sa consœur intermoléculaire les propriétés physiques mais elle agit en sens inverse. Les molécules étant mieux individualisées les températures de fusion et d'ébullition seront anormalement abaissées.

2) Interactions dipôle permanent - dipôle induit : Forces de Debye
Ces interactions se produisent entre des molécules possédant un moment dipolaire permanent et des molécules non polaires. Le champ électrique produit par le dipôle permanent déforme le nuage électronique de la molécule non polaire et provoque chez celle-ci l'apparition d'un dipôle induit. Toute molécule non polaire placée dans un champ électrique E se polarise avec l'apparition d'un moment dipolaire induit d'intensité m = a E. Le facteur de proportionnalité a est la polarisabilité de la molécule.
Interactions entre dipôles instantanés : Forces de dispersion de London
Le dihydrogène ou les gaz rares sont totalement apolaires et on arrive pourtant à les liquéfier ou les solidifier, il existe donc des interactions entre molécules (atomes pour les gaz rares) ne faisant apparemment pas intervenir de dipôles permanents comme les forces précédantes. Les interactions de ce type sont appelées forces de London. Pour comprendre leur origine il faut utiliser le modèle quantique de l'atome. Dans ce modèle on ne peut attribuer une position déterminée aux électrons ceux-ci se déplacent en permanence. Il y a apparition de dipôles si les barycentres des charges positives et négatives sont différents. Pour les molécules non polaires ces barycentres sont confondus en moyenne et le moment dipolaire permanent est nul. Mais à un instant donné à cause du caractère aléatoire du mouvement électronique ces barycentres ne sont pas confondus et il existe donc un dipôle instantané pour chaque molécule. Ce dipôle instantané va d'ailleurs en induire sur les molécules proches. Il existera donc des interactions électrostatiques instantanées qui vont donner une cohésion au liquide ou au solide. Ce type de force est d'ailleurs présent pour toutes les molécules et viendra toujours se superposer au deux précédants.
Conclusion :
Nous avons ici fait un survol rapide des interactions existant entre molécules.
Ces interactions permettent d'expliquer un grand nombre de faits chimiques tels que la solvatation des ions, la formation de complexes aqueux, la modification de certaines propriétés chimiques (constantes d'acidité etc.), la stabilité de certains composés et bien d'autres encore...
Vous aurez certainement l'occasion de les rencontrer lors de l'étude de la chimie organique ou de la chimie minérale.