QUELQUES PROPRIETES MOLECULAIRES
ASPECT ENERGETIQUE DES LIAISONS :
Nous avons jusqu'à présent admis l'existences de liaisons entre atomes conduisant à la formation de molécules stables. Voyons à présent l'aspect énergétique de ces liaisons.
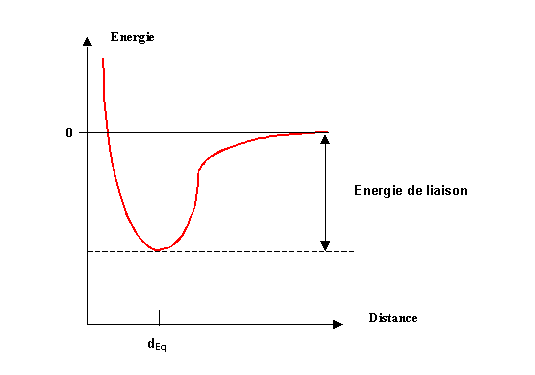
Un principe de base de la mécanique veut qu'un système soit stable si son énergie est minimale.
L'existence des molécules est une réalité avérée expérimentalement. Les atomes à l'état libre sont très rarement stables (mis à part les gaz rares). Les molécules sont donc plus stables que les atomes séparés et elles n'existent d'ailleurs que pour cette raison. Lors de l'établissement d'une liaison les deux atomes concernés vont se rapprocher l'un de l'autre et simultanément leur énergie potentielle va décroître. Les atomes ne vont pouvoir se rapprocher indéfiniment car leurs noyaux chargés positivement vont finir par se repousser, l'énergie potentielle va alors croître. Il existe donc une distance d'équilibre pour laquelle l'énergie sera minimale, cette distance d'équilibre correspondra à la distance de liaison. On se trouve alors dans un puits de potentiel correspondant à une stabilité maximale. On peut résumer cela par un schéma énergétique.

L'énergie de la liaison correspond à ce puits de potentiel. Par convention on prend l'origine des énergies quand les deux atomes sont situés à une distance infinie l'un de l'autre. L'énergie de liaison est alors négative. Cette énergie correspond indifféremment soit à l'énergie libérée par la formation de la liaison soit à l'énergie qu'il faudra fournir pour casser celle-ci.
Ces énergies de liaison sont accessibles expérimentalement, leur ordre de grandeur est la centaine de KJmol-1. Comme pour la longueur de liaison, cette énergie dépend de l'environnement et n'a pas une valeur rigoureusement constante. Des tables ont été établie donnant les valeurs moyennes de ces énergies de liaison (voir cours de thermodynamique).
Quelques valeurs d'énergies moyennes de liaison (en KJ mol-1):
| Liaison | Energie | Liaison | Energie | Liaison | Energie | Liaison | Energie | Liaison | Energie | Liaison | Energie |
| H-H | 436 | C-H | 415 | N-H | 391 | O-H | 463 | F-F | 158 | CC(3) | 812 |
| H-F | 563 | C-C | 344 | N-N | 159 | O-O | 143 | Cl-Cl | 243 | CO(2) | 724 |
| H-Cl | 432 | C-Cl | 328 | N-O | 175 | O-F | 212 | Br-Br | 193 | CN(2) | 614 |
| H-Br | 366 | C-N | 292 | N-F | 270 | S-H | 368 | I-I | 151 | NN(2) | 418 |
| H-I | 299 | C-O | 350 | N-Cl | 200 | S-S | 266 | CC(2) | 615 | NN(3) | 946 |
L'échelle d'électronégativité de PAULING.
Ces énergies de liaisons sont à la base de la première échelle d'électronégativité utilisée : l'échelle d'électronégativité de PAULING. La démarche de Pauling à été la suivante pour définir l'électronégativité des atomes :
Soient les réactions suivantes :
(R1) : A - A(g) à A(g) + A(g) : DR1H0 = EAA
(R2) : B - B(g) à B(g) + B(g) : DR2H0 = EBB
(R3) : A - B(g) à A(g) + B(g) : DR3H0 = EAB
(R4) : A - A(g) + B - B (g) à 2 A - B(g) : DR4H0 = 2 EAB - EAA - EBB
Les enthalpies des réactions (R1), (R2) et (R3) correspondent à la définition des énergies de liaisons EAA, EBB et EAB. L'enthalpie de la réaction (R4) est calculable à partir de ces énergies de liaisons (voir cours de thermodynamique).
La réaction (R4) peut être obtenue par combinaison linéaire des réactions (R1), (R2) et (R3) :
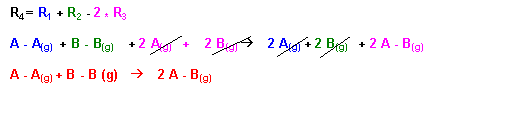
Soit pour les enthalpies la relation équivalente :
DR4H0 = DR1H0 + DR2H0 - 2 DR3H0
DR4H0 = 2 EAB - EAA - EBB = EAA + EBB - 2 EAB
4 EAB = 2 EAA + 2 EBB
Soit : EAB = 1/2 (EAA + EBB)
Dans la pratique cette relation n'est pas vérifiée et Pauling a constaté que l'énergie d'une liaison A - B était presque toujours supérieure à la valeur calculée par cette relation.
Pauling a postulé que l'écart entre ces valeurs était proportionnel au carré de l'écart des électronégativités de A et B :
EAB - 1/2 (EAA + EBB) = k * ( XA - XB)2
Le facteur de proportionnalité k est posé égal à l'unité si les énergies sont exprimées en eV/atome.
Soit (XA - XB)2 = EAB - 1/2 (EAA + EBB)
L'écart des électronégativité entre deux atomes est donc calculable en prenant la racine carrée de la différence entre l'énergie de liaison AB et la moyenne des énergies de liaisons AA et BB.
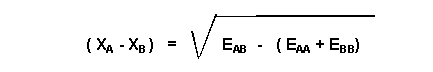
Dans la pratique on utilise la moyenne géométrique à la place de la moyenne arithmétique.
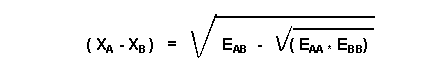
Pauling à ensuite posé comme référence que l'électronégativité du Fluor était égale à 4.
On peut ensuite de proche en proche déterminer l'électronégativité de tous les autres atomes.
Remarque : En raison du carré on obtient la valeur absolue de XA -XB. D'autre renseignements seront nécessaires pour savoir quel est l'atome le plus électronégatif des deux.
LIAISONS POLARISEES - MOMENT DIPOLAIRES - IONICITE DES LIAISONS
Quand une liaison est formée entre deux atomes différents, le doublet d'électrons a tendance à se rapprocher de l'atome le plus électronégatif. La liaison n'est pas symétrique, l'atome le plus électronégatif reçoit un excès d'électrons et acquièr donc une charge négative. Inversement l'autre atome perd des électrons et acquier une charge positive. La molécule est alors un dipôle électrique, on dit que la liaison est polarisée.
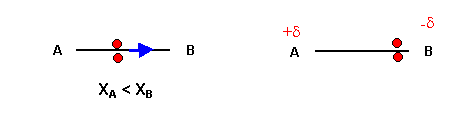
Remarque : La charge d doit normalement être exprimée en Coulombs (C), en pratique on utilise très souvent comme unité la charge e de l'électron (soit 1,6 10-19 C). Les charges d (exprimées en unité e) ne sont pas des charges entières, ces charges sont totalement différentes des charges formelles des schémas de Lewis moléculaires et ne doivent pas être confondues avec elles.
La liaison polarisée possède un moment dipolaire m.
Ce moment dipolaire est une grandeur vectorielle caractérisé par :
- direction : celle de la liaison
- sens : du pôle + vers le pôle -.
- Norme ou intensité : m = q * d (q = charge électrique, d = distance séparant les 2 charges)
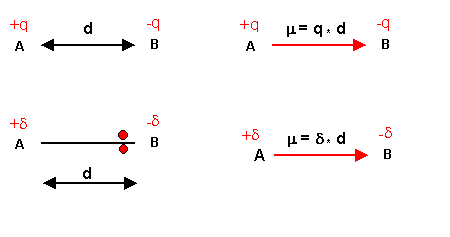
L'unité internationale du moment dipolaire est le Coulomb.mètre (C.m). En pratique on utilise souvent une unité plus adaptée le Debye (D). La conversion est la suivante : 1 D = 3,33 10-30 C.m.
Pour les molécules polyatomique les moments dipolaires des liaisons s'ajoutent vectoriellement.
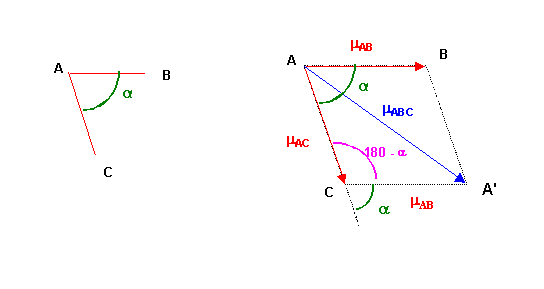
Théorème de Pythagore généralisé : Triangle ACA'
mABC2 = mAB2 + mAC2 - 2 mAB mAC cos (180 - a)
mABC2 = mAB2 + mAC2 + 2 mAB mAC cos a
On peut ainsi calculer à priori le moment dipolaire global d'une molécule si l'on connaît les moments dipolaires partiels associés à chaque liaison ou inversement calculer les moments dipolaires de liaisons si on connaît le moment dipolaire global.
Remarque : Cette méthode est assez approximative. D'une part les moments dipolaires de liaisons donnés par les tables ne sont que des valeurs moyennes, d'autre part l'environnement influe sur leur leurs valeurs. Ainsi la présence de doublets libres modifie parfois sensiblement la valeur des moments dipolaires globaux, en effet le doublet libre possède lui aussi son propre moment dipolaire partiel et il faudrait normalement en tenir compte dans le calcul du moment global. Dans la pratique on néglige cet effet et on ne tient pas compte des doublets libres ce qui peut parfois modifier sensiblement le résultat.
Influence de la géométrie moléculaire sur les moments dipolaires globaux :
La présence de liaisons polarisées n'implique pas l'existence d'un moment dipolaire global de la molécule, en effet les moments dipolaires des liaisons peuvent s'annuler les uns les autres pour des raisons géométriques. Nous allons voir quelques cas de telles situations :
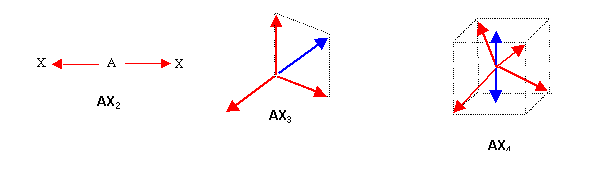
Les molécules linéaires symétriques de type AX2 ne posséderont pas de moment dipolaire puisque les moments des liaisons s'annulent mutuellement. Il en sera de même pour les molécules symétriques de type AX3 ou AX4. On peut assez facilement le voir graphiquement. On peut aussi le vérifier par le calcul.
Effet Inductif :
La présence d'une liaison polarisée dans une molécule polyatomique à des effets qui se manifestent a assez longue distance. Cet effet de propagation de la polarisation est appelé effet inductif et est très utilisé en chimie organique pour expliquer certaines propriétés des molécules. Cet effet inductif se manifeste jusqu'à deux ou trois liaisons plus loin en s'atténuant avec la distance. Des atomes éloignés sont donc affectés comme le montre la figure.
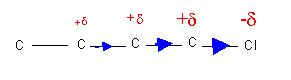
Ionicité des liaisons :
- Une liaison entre deux atomes identiques ne sera pas polarisée (sauf effet important de l'environnement), cette liaison sera purement covalente et ne possédera, ni moment dipolaire, ni charges partielles.
- Une liaison entre deux atomes d'électronégativités très différentes sera au contraire très polarisée et présentera un fort moment dipolaire et des charges partielles importantes. A la limite la charge partielle pourra atteindre la valeur 1 qui correspond au transfert total du doublet électronique d'un atome sur l'autre. On obtient alors deux ions, on a affaire à une liaison purement ionique.
-Si l'électronégativité des atomes impliqués dans la liaison est peu différente on aura bien évidemment une situation intermédiaire.
On exprime l'ionicité d'une liaison par son pourcentage d'ionicité.
Sa détermination nécessite la connaissance du moment dipolaire de liaison et de la longueur de celle-ci.
Il se calcule de la manière suivante :
m = q * d
q = d = m / d
Si d = e = 1,6 10-19 C la liaison est purement ionique.
Le rapport d /e mesure directement le pourcentage d'ionicité de la liaison, par exemple si d / e = 0,5 on dira que la liaison est ionique à 50 %.
%IAB = 100 * m(C.m) /d(m) / e(C)
%IAB = 20.8 * m(D)/d(Å)
Des formules théoriques ou empiriques ont été proposées pour relier le pourcentage d'ionicité à l'écart des électronégativités :
Formule théorique de Pauling : %IAB = 100 ( 1 - exp(- (DX)2/4))
Formule empirique : %IAB = 16 DX + 3,5 (DX)2
La formule empirique donne des résultats en assez bon accord avec les valeurs obtenues à partir des moments dipolaires et des longueurs de liaisons.
Liaison |
dAB (Å) |
m (D) |
DX |
%IAB (m et d) |
%IAB(Empirique) |
%IAB(Pauling) |
H - I |
1,61 |
0,38 |
0,4 |
5 |
7 |
4 |
H - Br |
1,41 |
0,79 |
0,7 |
12 |
13 |
12 |
H - N |
1,01 |
1,31 |
0,9 |
27 |
17 |
18 |
H - Cl |
1,27 |
1,07 |
0,9 |
18 |
17 |
18 |
H - O |
0,96 |
1,51 |
1,4 |
33 |
29 |
39 |
H - F |
0,92 |
1,82 |
1,9 |
41 |
43 |
59 |
Conclusion :
Nous avons étudié ici le modèle de la liaison covalente (partage d'un doublet d'électron entre deux atomes), mais nous voyons par le biais de la polarité des liaisons qu'on peut tendre vers un autre modèle de liaison dans lequel le transfert du doublet d'électron d'un atome vers l'autre est total. La liaison sera alors purement ionique. Ce modèle de la liaison ionique ne sera pas traité ici. Il s'appliquera particulièrement aux sels (NaCl, KCl etc.). Il existe enfin un troisième modèle de liaison qui s'applique aux métaux, le modèle de la liaison métallique. En fait ces trois modèles ne sont que des cas limites, utilisés pour décrire simplement le phénomène "unitaire" de la liaison chimique.