P.C.E.M - Physico-chimie des
solutions
S_7 CINETIQUE OXYDOREDUCTION
Etude cinétique de la décomposition de l'eau oxygénée (H2O2)
On donne les
potentiels de référence des couples d'oxydoréduction suivants :
Couple H2O2
/ H2O E0 = 1,8 V - Couple O2 / H2O2
E0 = 0,7 V - Couple MnO4- / Mn2+ E0=1,5
V
![]() On rappelle le schéma de Lewis d'eau oxygénée (H2O2)
:
On rappelle le schéma de Lewis d'eau oxygénée (H2O2)
:
1)
Pour la
molécule d'eau oxygénée (H2O2), les nombres d'oxydation
des atomes d'oxygène sont :
Réponse A : (+ I) et (+ I)
Réponse B : (- II) et (- II)
Réponse C : (- II) et (- I)
Réponse D : (- I) et (- I)
Réponse E : ( 0 ) et ( 0 )
2)
On étudie, à T
= 300 K, la cinétique de la réaction de décomposition de l'eau oxygénée (H2O2)
:
H2O2
= H2O + 1/2 O2
L'évolution
de la concentration de l'eau oxygénée (H2O2) au cours du
temps est suivie par manganimétrie en milieu acide (pH=0), en titrant 10 mL de
solution d'eau oxygénée par une solution 0,02 mol.L-1 de
permanganate de potassium ( K+ - MnO4- ).
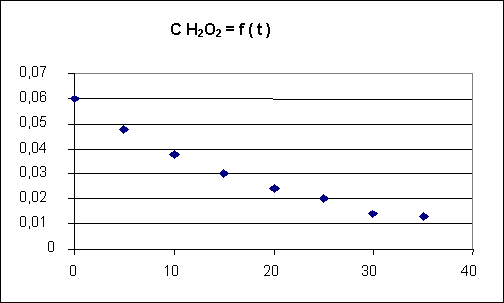
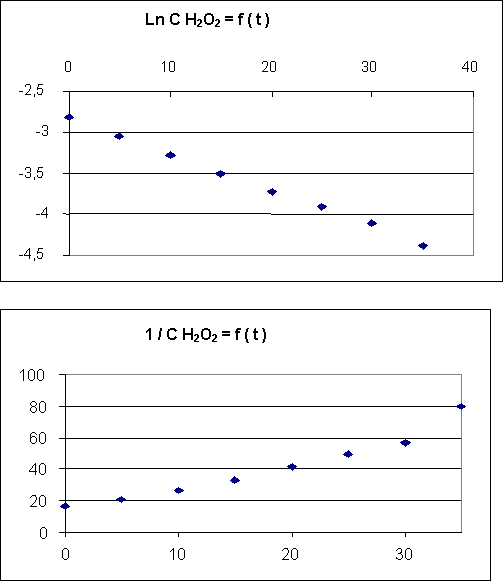
On obtient les
résultats et les représentations graphiques suivants :
|
t (min) |
CH2O2 (mol.L-1) |
LnCH2O2 |
1/CH2O2 (L.mol-1) |
|
0 |
0,060 |
-2,81 |
16,67 |
|
5 |
0,048 |
-3,04 |
20,83 |
|
10 |
0,038 |
-3,27 |
26,32 |
|
15 |
0,030 |
-3,51 |
33,33 |
|
20 |
0,024 |
-3,73 |
41,67 |
|
25 |
0,020 |
-3,91 |
50,00 |
|
30 |
0,015 |
-4,05 |
57,14 |
|
35 |
0,013 |
-4,38 |
80,00 |

2-1)
Pour le
titrage des 10 mL de la solution initiale d'eau oxygénée ( t = 0 - C0
= 0,060 mol.L-1 ) par la solution de KMnO4 0,02 mol.L-1, il a fallu verser
pour atteindre le point équivalent :
Réponse
A : 6 mL de solution de KMnO4
Réponse B : 9 mL de solution de KMnO4
Réponse
C : 12 mL de solution de KMnO4
Réponse
D : 15 mL de solution de KMnO4
Réponse
E : 25 mL de solution de KMnO4
2-2) L'ordre
de la réaction par rapport à H2O2 est :
Réponse A : ordre 0
Réponse B : ordre 1
Réponse C : ordre 2
Réponse D : ordre 3
Réponse E : aucun ordre apparent
2-3) La
constante de vitesse de la réaction est
(à 0,001 près) :
Réponse A : 0,025 min-1
Réponse B : 0,046 min-1
Réponse C : 0,025 min.L.mol-1
Réponse D : 0,046 mol.L-1.min-1
Réponse E : 0,075 mol.L-1.h-1
2- 4) Pour que
60 % de l'eau oxygénée initiale ait disparu, il faut attendre :
Réponse A : 40 min
Réponse B : 30 min
Réponse C : 20 min
Réponse D : 10 min
Réponse E : 5 min
2- 5) Si la
solution d'eau oxygénée de départ avait été 2 fois moins concentrée :
Réponse A : La constante de vitesse aurait été multipliée par 2
Réponse B : La constante de vitesse aurait été divisée par 2
Réponse C : La constante de vitesse n'aurait pas été modifiée
Réponse D : La constante de vitesse aurait été multipliée par ln(2) (soit 0,69)
Réponse E : La constante de vitesse aurait été divisée par ln(2) (soit 0,69)