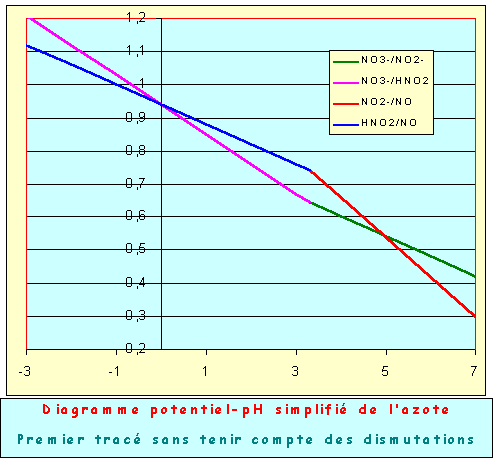
DIAGRAMME POTENTIEL-pH SIMPLIFIE DE L'AZOTE
Tracer le diagramme de Pourbaix (diagramme Potentiel-pH) du système de l’azote. aux états d’oxydation N(V) N(III) et N(II). Pour une concentration totale d’azote dissous 0,1 M et PNO=1 bar.
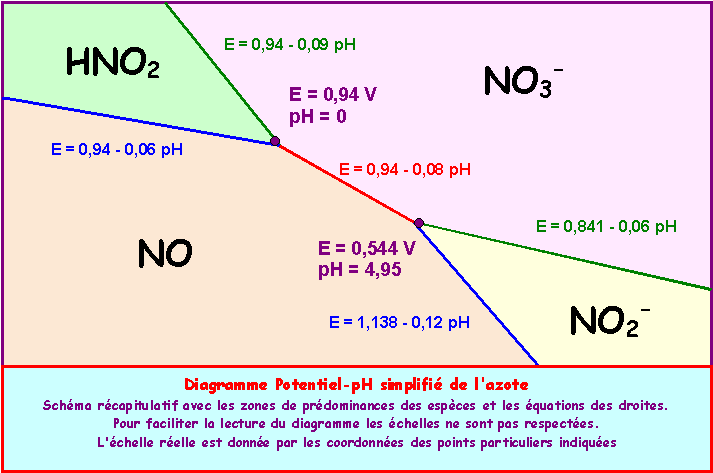
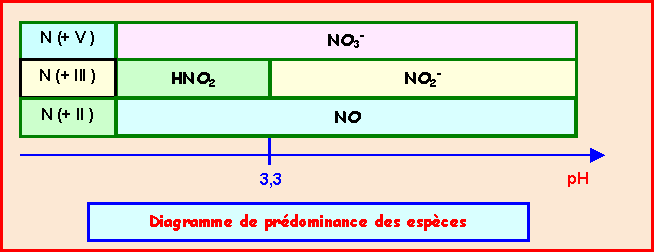
HNO2 / NO : E0 = 1,00 v - NO3- / HNO2 : E0 = 0.94 V - HNO2 / NO2- : pKa = 3,3
Corrigé : Ce corrigé présente plusieurs méthodes différentes pour obtenir le résultat désiré. Chaque méthode présente ses avantages et ses inconvénients propres. Il n'y a pas de règle générale imposée et chacun est libre d'utiliser la méthode qui lui semble convenir le mieux.
espèce |
HNO2 |
NO |
NO3- |
NO2- |
Nombre d'oxydation |
+ III |
+ II |
+ V |
+III |

Système N (+III) / N (+ II)
HNO2 + H+ + 1 e- = NO + H2O
E = E0 + 0,06 log {[HNO2] [H+] / PNO }
E = E0 + 0,06 log {[HNO2] / PNO } + 0,06 log [H+]
E = E0 + 0,06 log {[HNO2] / PNO } - 0,06 pH
[HNO2] = 0,1 mol.L-1 - PNO = 1 bar - E0 = 1,00 V
E = 1,00 + 0,06 log{ 0,1 / 1 } - 0,06 pH
E = 0,94 - 0,06 pH
NO2- + 2 H+ + 1 e- = NO + H2O
E = E0 + 0,06 log {[NO2-] [H+]2 / PNO }
E = E0 + 0,06 log {[NO2-] / PNO } + 0,06 log [H+]2
E = E0 + 0,06 log {[NO2-] / PNO } - 0,12 pH
[NO2-] = 0,1 mol.L-1 - PNO = 1 bar
E = E0 - 0,06 - 0,12 pH
Détermination de E0 :
(2) HNO2 + H3O+ + 1 e- = NO + 2 H2O
(3) NO2- + 2 H3O+ + 1 e- = NO + 3 H2O
(3) = (2) - (1)
DG03 = DG02 - DG01
- F E03 = - F E02 + RT ln Ka
E03 = E02 - RT/F ln Ka
E03 = E02 - 2,3 RT/F log Ka
E03 = E02 + 0,06 pKa
E03 = 1,00 + 0,06 * 3,3 = 1,198 V
On a trouvé précédemment : E = 0,94 - 0,06 pH
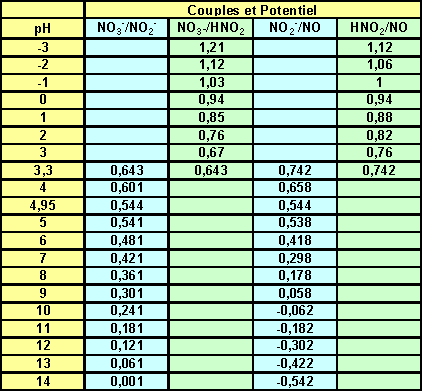
Soit E = 0,742 V pour pH = 3,3
E = E0 - 0,06 - 0,12 pH
E0= E + 0,06 + 0,12 pH
E0= 0,742 + 0,06 + 0,12 *3,3 = 1,198 V
Soit finalement : E = 1,198 - 0,06 - 0,12 pH
E = 1,138 - 0,12 pH
Par unicité du potentiel :
On garde le même couple HNO2/NO mais on remplace HNO2 par son expression en fonction de l'espèce majoritaire pour pH > 3,3 soit NO2-.
On a pH = pKa + log [NO2-] / [HNO2]
pH = pKa + log [NO2-] - log [HNO2]
log [HNO2] = pKa + log [NO2-] - pH
HNO2 + H+ + 1 e- = NO + H2O
E = E0 + 0,06 log {[HNO2] [H+] / PNO }
E = E0 + 0,06 log {[HNO2] / PNO } + 0,06 log [H+]
E = E0 + 0,06 log {[HNO2] - log PNO } - 0,06 pH
E = E0 + 0,06 pKa + 0,06 log [NO2-] - 0,06 pH - log PNO - 0,06 pH
E = E0 + 0,06 pKa + 0,06 log [NO2-] - log PNO - 0,12 pH
E = 1,00 + 0,06 *3,3 + 0,06 log 0,1 - log 1 - 0,12 pH
E = 1,138 - 0,12 pH
On retrouve bien la même expression.
Système N (+V) / N (+ III)
NO3- + 3 H+ + 2 e- = HNO2 + H2O
E = E0 + 0,06 log { [NO3-] [H+]3 / [HNO2] }
E = E0 + 0,06 log { [NO3-] / [HNO2] } + 0,09 log [H+]
E = E0 + 0,06 log { [NO3-] / [HNO2] } - 0,09 pH
[HNO2] = 0,05 mol.L-1 - [HNO2] = 0,05 mol.L-1 - E0 = 0,94 V
E = 0,94 - 0,09 pH
NO3- + 2 H+ + 2 e- = NO2- + H2O
E = E0 + 0,03 log { [NO3-] [H+]2 / [NO2-] }
E = E0 + 0,03 log { [NO3-] / [NO2-] } + 0,03 log [H+]2
E = E0 + 0,03 log { [NO3-] / [NO2-] } - 0,06 pH
[NO3-] = 0,05 mol.L-1 - [NO2-] = 0,05 mol.L-1
E = E0 - 0,06 pH
Détermination de E0 :
(2) NO3- + 3 H3O+ + 2 e- = HNO2 + 4 H2O
(3) NO3- + 2 H3O+ + 2 e- = NO2- + 3 H2O
(3) = (2) + (1)
DG03 = DG02 + DG01
- 2 F E03 = - 2 F E02 - RT ln Ka
E03 = E02 + RT/2F ln Ka
E03 = E02 + 2,3 RT/2F log Ka
E03 = E02 - 0,03 pKa
E03 = 0,94 - 0,03 * 3,3 = 0,841 V
On a trouvé précédemment : E = 0,94 - 0,09 pH
Soit E = 0,643 V pour pH = 3,3
E = E0 - 0,06 pH
E0= E + 0,06 pH
E0= 0,643 + 0,06 *3,3 = 0,841 V
Soit finalement : E = 0,841 - 0,06 pH
Par unicité du potentiel :
On garde le même couple NO3- / HNO2 mais on remplace HNO2 par son expression en fonction de l'espèce majoritaire pour pH > 3,3 soit NO2-.
On a pH = pKa + log [NO2-] / [HNO2]
pH = pKa + log [NO2-] - log [HNO2]
log [HNO2] = pKa + log [NO2-] - pH
NO3- + 3 H+ + 2 e- = HNO2 + H2O
E = E0 + 0,03 log { [NO3-] [H+]3 / [HNO2] }
E = E0 + 0,03 log { [NO3-] / [HNO2] } + 0,03 log [H+]
E = E0 + 0,03 log { [NO3-] - 0,03 log [HNO2] } + 0,03 log [H+]
E = E0 + 0,03 log { [NO3-] - 0,03 log [HNO2] } - 0,03 pH
E = E0 + 0,03 log { [NO3-] - 0,03 pKa - 0, 03 log [NO2-] - 0,06 pH
Sur la frontière on a [NO3-] = [NO2-] = 0,05 mol.L-1
E = E0 - 0,03 pKa - 0,06 pH
E = 0,94 - 0,03 *3,3 - 0,06 pH
E = 0,841 - 0,06 pH
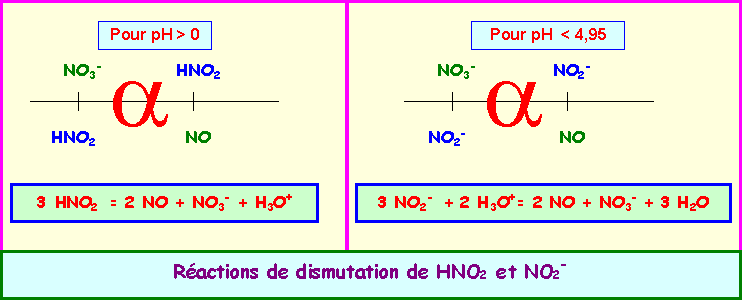
Phénomènes de dismutation
Dismutation de HNO2 :
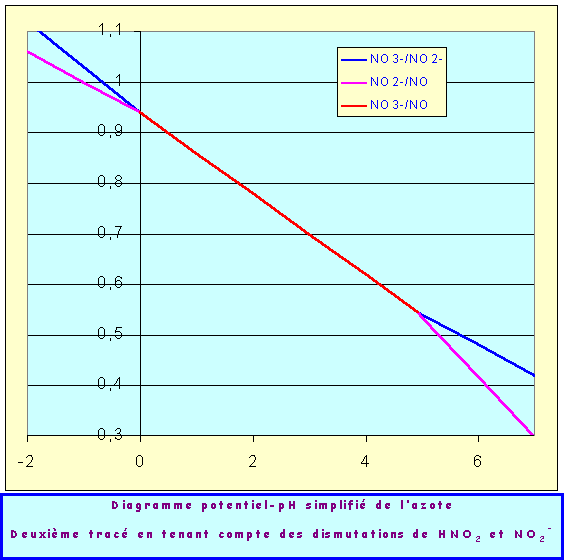
Un examen attentif du premier tracé obtenu montre que des phénomènes de dismutation vont se produire. En effet, on voit facilement que la courbe bleue représentant le couple HNO2/NO est pour des pH > 0 placée au dessus de la courbe rose représentant le couple NO3-/HNO2. Cela signifie que pour de tels pH HNO2 peut réagir sur lui même pour donner NO3- et NO. C'est le phénomène de dismutation, pour de tels pH HNO2 est thermodynamiquement instable et ne peut exister.
Le calcul du pH pour lequel ce phénomène intervient se fait en écrivant l'égalité des potentiels de Nernst des deux couples.
HNO2 + H+ + 1 e- = NO + H2O : E = 0,94 - 0,06 pH
NO3- + 3 H+ + 2 e- = HNO2 + H2O : E = 0,94 - 0,09 pH
0,94 - 0,06 pH = 0,94 - 0,09 pH
0,03 pH = 0
pH = 0 et E = 0,94 V
La réaction de dismutation de HNO2 s'écrit :
2 * [ HNO2 + H+ + 1 e- = NO + H2O ]
HNO2 + H2O = NO3- + 3 H+ + 2 e-
2 HNO2 + 2 H+ + 2 e- + HNO2 + H2O = 2 NO + 2 H2O + NO3- + 3 H+ + 2 e-
3 HNO2 = 2 NO + H2O + NO3- + H+
3 HNO2 = 2 NO + NO3- + H3O+
Dismutation de NO2-
De même, pour pH < 4,95, la courbe verte représentant le couple NO3-/NO2-. est placée au dessous de la courbe rouge représentant le couple NO2-/NO Cela signifie que pour de tels pH NO2- peut réagir sur lui même pour donner NO3- et NO. C'est le phénomène de dismutation, pour de tels pH NO2- est thermodynamiquement instable et ne peut exister.
Le calcul du pH pour lequel ce phénomène intervient se fait en écrivant l'égalité des potentiels de Nernst des deux couples.
NO3- + 2 H+ + 2 e- = NO2- + H2O : E = 0,841 - 0,06 pH
NO2- + 2 H+ + 1 e- = NO + H2O : E = 1,138 - 0,12 pH
0,841 - 0,06 pH = 1,138 - 0,12 pH
0,12 pH - 0,06 pH = 1,138 - 0,841
0,06 pH = 0,297
pH = 0,297/0,06 = 4,95
pH = 4,95 et E = 0,544 V
La réaction de dismutation de NO2- s'écrit :
NO2- + H2O = NO3- + 2 H+ + 2 e-
2* [ NO2- + 2 H+ + 1 e- = NO + H2O ]
NO2- + H2O + 2 NO2- + 4 H+ + 2 e- = NO3- + 2 H+ + 2 e- + 2 NO + 2 H2O
3 NO2- + 2 H+ = NO3- + 2 NO + H2O
3 NO2- + 2 H3O+ = NO3- + 2 NO + 3 H2O
Deuxième tracé tenant compte des dismutations de HNO2 et NO2- :
Pour des valeurs de pH comprises entre 0 et 4,95 l'azote ne peut donc exister avec le degré d'oxydation intermédiaire N(III) ; dans ce domaine de pH on doit considérer le système N(V)/N(II) soit NO3-/NO.
NO3- + 4 H3O+ + 3 e- = NO + 6 H2O
E = E0 + 0,02 log { [NO3-] [H3O+]4 / PNO }
E = E0 + 0,02 log { [NO3-] / PNO } + 0,02 log [H3O+]4
E = E0 + 0,02 log { [NO3-] / PNO } + 0,08 log [H3O+]
E = E0 + 0,02 log { [NO3-] / PNO } - 0,08 pH
[NO3-]=0,1 et PNO = 1 bar
E = E0 - 0,02 - 0,08 pH
Détermination du E0
(2) HNO2 + H+ + 1 e- = NO + H2O (E02 = 1,00 V)
(3) NO3- + 4 H+ + 3 e- = NO + 2 H2O (E03= ?)
(3) = (1) + (2)
DG03 = DG01 + DG02
- 3 F E03 = - 2 F E01 - F E02
3 E03 = 2 E01 + E02
E03 = 1/3 {2 E01 + E02}
E03 = 1/3 {2*0,94 + 1,00} = 0,96 V
E = E0 - 0,02 - 0,08 pH
E0= E + 0,02 + 0,08 pH
E0= 0,94 + 0,02 + 0,08 *0 = 0,96 V
E0= 0,544 + 0,02 + 0,08 *4,95 = 0,96 V
Finalement on trouve donc :
E = E0 - 0,02 - 0,08 pH
E = 0,96 - 0,02 - 0,08 pH
E = 0,94 - 0,08 pH
La nouvelle droite joint simplement les deux points d'intersections des courbes tracées précédemment, on aurait pu trouver directement son équation en écrivant qu'elle passe par les points de coordonnées :
{ pH = 4,95 et E = 0,544 V } et { pH = 0 et E = 0,94 V }
E = a pH + b
a = ( 0,94 - 0,544 ) / ( 4,95 - 0 ) = 0,08
b = 0,544 - 0,08*4,95 = 0,94 - 0,08*0 = 0,94
Soit E = 0,94 - 0,08 pH