L'Aluminium
Données :
Energie d'ionisation de l'atome d'Hydrogène : E0 = 2,176 10-18 J
Nombre d'Avogadro : N = 6,022 1023
Vitesse de la lumière : C = 3 108 ms-1
Charge de l'électron e = 1,6 10-19 C
Masse du proton : mp = 1,00724 u.m.a
Masse du neutron : mn = 1,00866 u.m.a
Pour l'aluminium : Z = 13 - M = 26,98 g.mol-1
Potentiels normaux d'oxydoréduction : HNO3 / NO E0 = 0,96 V
Rappel : Constantes d'écran de Slater
|
1s |
0,3 |
|
|
|
|
|
|
|
|
|
|
|
2s 2p |
0,85 |
0,35 |
|
|
|
|
|
|
|
|
|
|
3s 3p |
1 |
0,85 |
0,35 |
|
|
|
|
|
|
|
|
|
3d |
1 |
1 |
1 |
0,35 |
|
|
|
|
|
|
|
|
4s 4p |
1 |
1 |
0,85 |
0,85 |
0,35 |
|
|
|
|
|
|
|
4d |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|
|
|
|
|
4f |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|
|
|
|
5s 5p |
1 |
1 |
1 |
1 |
0,85 |
0,85 |
0,85 |
0,35 |
|
|
|
|
5d |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|
|
5f |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|
6s 6p |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,85 |
0,85 |
0,85 |
0,35 |
|
|
1s |
2s 2p |
3s 3p |
3d |
4s 4p |
4d |
4f |
5s 5p |
5d |
5f |
6s 6p |
Partie A : L'atome d'Aluminium
5-1) Calculer la charge nucléaire effective Z* pour un de ses électrons de valence.
5-2) Evaluer son énergie de première ionisation
5-3) La valeur expérimentale de cette énergie de première ionisation est de 6,0 eV. Comparez à la valeur calculée et justifier l'écart observé.
On rappelle que dans ce système on trouve un atome à chaque sommet du cube et un atome au centre de chaque face du cube.
6-1) Dessiner la maille correspondante.
6-2) La masse volumique de l'aluminium est de 2,7 g.cm-3
6-2-a) Commentez cette valeur
6-2-b) Quelle valeur peut on déduire pour le rayon de l'atome d'aluminium ?
6-4) Le rayon ionique de l'aluminium est de 0,51 pm.
6-4-a) Quelle est la nature de l'ion en question ?
6-4-b) Justifiez que cet ion soit le plus stable de l'Aluminium.
6-4-c) Justifiez le fait que le rayon ionique de Al soit très nettement inférieur à son rayon métallique.
7-1 : Quel est le nom du minerais d'aluminium ?
7-2 : Décrire très succinctement le procédé d'élaboration du métal aluminium à partir de son minerais.
Partie B :
Le chlorure d'AluminiumA l'état solide, ce composé est simplement de type ionique.
B-1 : Quelle est alors sa formule chimique ?
A l'état gazeux ou liquide à haute température, on obtient un composé de même formule mais de type covalent.
B-2 : Donner son schéma de Lewis moléculaire et prévoir sa géométrie.
Ce composé est un acide de Lewis très utilisé comme catalyseur en chimie organique lors de la réaction de Friedel et Craft.
B-3 : Rappeler le mécanisme de cette réaction en précisant le rôle du catalyseur.
A l'état liquide à basse température on obtient un composé moléculaire de formule brute Al2Cl6 dans lequel des atomes de chlore sont liés simultanément à deux atomes d'aluminium.
B-4 : Justifiez simplement la formation de cette structure et précisez sa géométrie par une représentation spatiale.
Partie C : Propriétés des solutions aqueuses de l'ion Aluminium III
C-1) L'ion alluminium (III) existe en solution aqueuse sous forme d'ion complexe de formule [ Al(H2O)6]3+ ce cation est un acide de Bronsted de pKa = 5.
Le couple acidobasique est : [ Al(H2O)6]3+ / [ AlOH(H2O)5]2+
Donner le nom des deux complexes
Calculer le pH d'une solution 10-3 mol.L-1 d'ion Al3+
Calculer le pH d'une solution 10-5 mol.L-1 d'ion Al3+
C-2) On considère maintenant simplement l'ion Al3+(aq), sans plus tenir compte de l'équilibre précédant. On donne les équilibres suivants :
Al(OH)3(s) = Al3+ (aq) + 3 OH- (aq) (Constante d'équilibre Ks)
Al(OH)4- (aq)= Al3+ (aq) + 4 OH-(aq) (Constante d'équilibre Kd)
C-2-a : Exprimer la "solubilité totale" (concentration totale des espèces solubles) de Al(III) en fonction des concentrations de Al3+ et Al(OH)4-
C-2-b : Exprimer la "solubilité totale" (concentration totale des espèces solubles) de Al(III) en fonction de la concentration de l'ion OH-, de Ks , Kd (pour une solution en présence de Al(OH)3(s)).
C-2-c : Montrer que cette expression peut se simplifier en négligeant une des deux espèces soluble par rapport à l'autre.
C-2-d : Exprimer ps = -log (s) en fonction de la concentration de pH, de pKs et de pKd
C-2-e : On donne la solubilité totale de Al(III) et son cologarithme décimal en fonction du pH
|
pH |
s |
p s |
|
4 |
1,00E-03 |
3,00 |
|
4,5 |
3,17E-05 |
4,50 |
|
5 |
1,10E-06 |
6 |
|
5,5 |
3,48E-07 |
6,5 |
|
6 |
1,00E-06 |
6,00 |
|
6,5 |
3,16E-06 |
5,50 |
|
7 |
1,00E-05 |
5,00 |
|
7,5 |
3,16E-05 |
4,50 |
Tracer la courbe ps = f (pH) et en déduire les valeurs de pKs et pKd
C-2-f : Pour quel pH la solubilité de l'ion Al(III) est-elle minimale ? Estimez cette solubilité minimale.
C-2-g: Décrire un test de reconnaissance de l'ion Aluminium (III) couramment utilisé et basé sur cette solubilité en fonction du pH.
C-2-h : Citez un autre ion présentant le même phénomène de précipitation puis redissolution quand le pH augmente.
Partie D : Oxydo-réduction
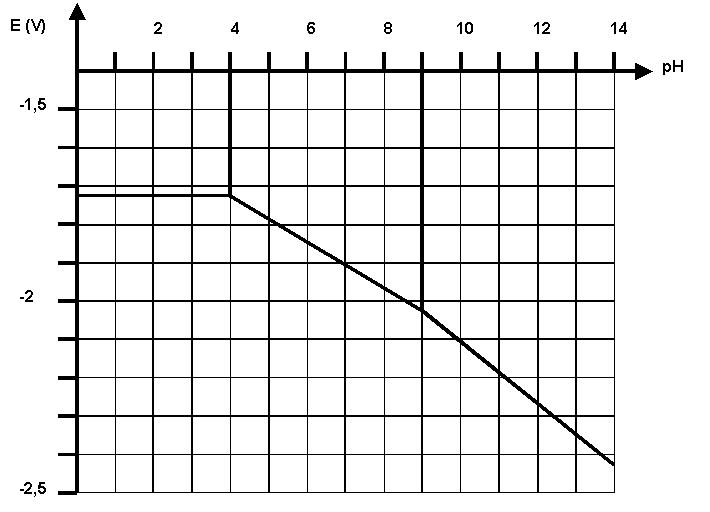
On donne le diagramme potentiel-pH de l'aluminium pour une concentration de tracé de 10-3 mol.L-1.
Les espèces retenues pour l'étude sont : Al - Al3+ - Al(OH)3 et Al(OH)4-

D-1 : Placer ces espèces sur le diagramme.
D-2 : A partir du diagramme déterminer :
D-2-a : la valeur de pKs
D-2-b : la valeur de pKd
D-2-c : la valeur des potentiels normaux d'oxydoréduction des couples :
*
Al3+ / Al*
Al(OH)3 / Al*
Al(OH)4 -/ Al
E : Corrosion de l'aluminium
E-1 : Montrez que le métal aluminium est thermodynamiquement instable quand il est en contact avec l'eau.
Ecrire les réactions qui se produisent entre le métal aluminium et l'eau en milieu :
*
Acide ( pH < 3)*
Neutre ( 6 < pH < 8)*
Basique ( pH > 11)E-2 : Quelle réaction devrait "normalement" se produire entre l'aluminium métallique et l'acide nitrique concentré ?
E-3 : En fait, l'acide nitrique concentré n'attaque pas l'aluminium. Proposez une explication.
E-4 : Cette résistance à l'oxydation permet l'utilisation de l'aluminium dans des application courantes. Citez-en quelques unes.
E-5 : Un procédé appelé anodisation de l'aluminium est utilisé industriellement pour renforcer cette résistance à la corrosion. En décrire brièvement le principe.