L'Aluminium
Données :
Energie d'ionisation de l'atome
d'Hydrogène : E0 = 2,176 10-18 J
Nombre d'Avogadro : N = 6,022 1023
Vitesse de la lumière : C = 3 108
ms-1
Charge de l'électron e = 1,6 10-19 C
Masse du proton : mp = 1,00724
u.m.a
Masse du neutron : mn = 1,00866
u.m.a
Pour l'aluminium : Z = 13 - M = 26,98 g.mol-1
Potentiels normaux d'oxydoréduction
:
HNO3 / NO E0 = 0,96 V
Rappel : Constantes d'écran de
Slater
1s
|
0,3
|
|
|
|
|
|
|
|
|
|
|
2s 2p
|
0,85
|
0,35
|
|
|
|
|
|
|
|
|
|
3s 3p
|
1
|
0,85
|
0,35
|
|
|
|
|
|
|
|
|
3d
|
1
|
1
|
1
|
0,35
|
|
|
|
|
|
|
|
4s 4p
|
1
|
1
|
0,85
|
0,85
|
0,35
|
|
|
|
|
|
|
4d
|
1
|
1
|
1
|
1
|
1
|
0,35
|
|
|
|
|
|
4f
|
1
|
1
|
1
|
1
|
1
|
1
|
0,35
|
|
|
|
|
5s 5p
|
1
|
1
|
1
|
1
|
0,85
|
0,85
|
0,85
|
0,35
|
|
|
|
5d
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
0,35
|
|
|
5f
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
0,35
|
|
6s 6p
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
0,85
|
0,85
|
0,85
|
0,35
|
| |
1s
|
2s 2p
|
3s 3p
|
3d
|
4s 4p
|
4d
|
4f
|
5s 5p
|
5d
|
5f
|
6s 6p
|
Partie
A : L'atome d'Aluminium
-
- Donner la configuration électronique
de l'aluminium.
- Z = 13 : 1s2
2s2 2p6 3s2 3p1
- Cet élément ne possède qu'un seul
isotope stable préciser sa nature (nombre de protons et
de neutrons)
- M = 26,98 g.mol-1
è A = 27 soit 13 protons
et 14 neutrons
- Calculer son énergie de cohésion en
MeV puis en MeV/nucléon
- Dm =
m"théorique" - m"réelle"
m"théorique" =
Z mp + N mn = 13 * 1,00724 + 14 * 1,00866 = 27,215 u.m.a
m"réelle"
= 26,98 u.m.a
Dm = 0,235 u.m.a = 0,235 /
N = 3,908 10-25 g = 3,908 10-28
Kg
E = Dm C2
= 3,908 10-28 * 9 1016
= 3,5175 10-11 J = 219,8 MeV =
8,14 MeV/nucléon
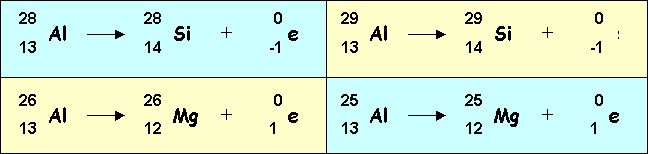
- Il possède 4 isotopes instables 25Al
; 26Al ; 28Al et 29Al.
Pour chacun de ces isotopes préciser s'il s'agit d'un
émetteur a, b+ ou b- et écrire la réaction nucléaire
correspondante.
- 25Al
: 13 protons et 12 neutrons : Manque de neutrons par
rapport à l'isotope stable, pourra se stabiliser en
transformant 1 proton en neutron, c'est à dire en
éjectant de l'électricité positive, c'est donc un
émetteur de type b+
26Al :
13 protons et 13 neutrons : Manque de neutrons par
rapport à l'isotope stable, pourra se stabiliser en
transformant 1 proton en neutron, c'est à dire en
éjectant de l'électricité positive, c'est donc un
émetteur de type b+
25Al
: 13 protons et 12 neutrons : Manque de neutrons par
rapport à l'isotope stable, pourra se stabiliser en
transformant 1 proton en neutron, c'est à dire en
éjectant de l'électricité positive, c'est donc un
émetteur de type b+
28Al
: 13 protons et 15 neutrons : Excés de neutrons par
rapport à l'isotope stable, pourra se stabiliser en
transformant 1 neutron en proton, c'est à dire en
éjectant de l'électricité négative, c'est donc un
émetteur de type b-.
29Al
: 13 protons et 16 neutrons : Excés de neutrons par
rapport à l'isotope stable, pourra se stabiliser en
transformant 1 neutron en proton, c'est à dire en
éjectant de l'électricité négative, c'est donc un
émetteur de type b-.
Par utilisation des règles
de Slater
5-1) Calculer la charge nucléaire
effective Z* pour un de ses électrons de valence.
1s2
2s2 2p6
3s2 3p1
Z* = 13 - 2*0,35
- 8*0,85 - 2 = 3,5
5-2) Evaluer son énergie de
première ionisation
E.I H = 2,176 10-18
J = 13,6 eV
E Al = 2 E1
+ 8 E2 + 3 E3
E Al+ =
2 E1 + 8 E2
+ 2 E'3
E.I.1 = E Al+
- E Al = 2 E'3 - 3 E3
E3 =
-13,6 * 3,52 / 9 = - 18,51 eV
Z* Al+
= Z*Al + 0,35 = 3,85
E'3 =
-13,6 * 3,852 / 9 = - 22,40 eV
E.I.1 =
2 E'3 - 3 E3
= 10,7
eV
5-3) La valeur expérimentale de
cette énergie de première ionisation est de 6,0 eV.
Comparez à la valeur calculée et justifier l'écart
observé.
La valeur
calculée est nettement plus élevée que la valeur
expérimentale.
Cela est dû a la très grande
facilité avec laquelle Al perd un électron pour donner
Al+.
Si on compare les schémas de
Lewis de Al et Al+, on constate
que Al+ présente une structure
particulièrement stable : 1s2
2s2 2p6
3s2 ne comportant que des
couches ou sous couches totalement remplies.
Cette structure stable explique
l'énergie d'ionisation "anormalement" faible
de Al.
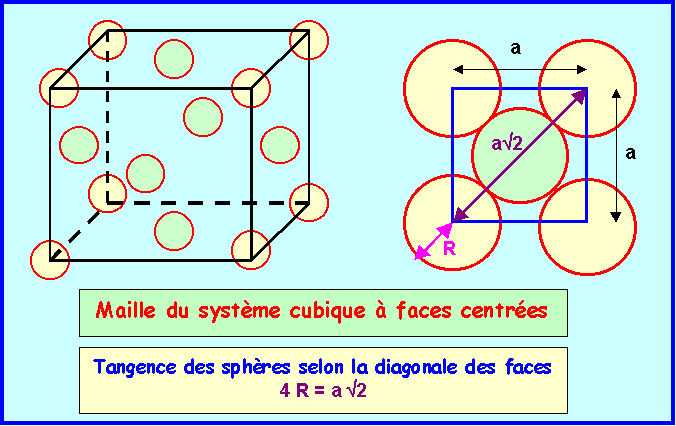
- L'aluminium métallique cristallise
dans le système cubique à face centrée.
- On rappelle que dans ce système on
trouve un atome à chaque sommet du cube et un atome au
centre de chaque face du cube.
6-1) Dessiner la maille correspondante.
6-2) La masse volumique de
l'aluminium est de 2,7 g.cm-3
6-2-a) Commentez cette valeur.
Cette valeur est
très faible, l'Aluminium est un métal très léger,
cette légèreté permet son utilisation en
aéronautique.
6-2-b) Quelle valeur peut on
déduire pour le rayon de l'atome d'aluminium ?
La tangences des sphères (voir
figure) se faisant selon la diagonale des faces on a :
4 R = a Ö 2
soit R = a Ö 2 / 4 = 0,3536 a
Si on détermine le paramètre
de la maille a, on pourra déterminer le rayon atomique
de l'aluminium.
Détermination
de a :
r
= M / V = 2,7 g.cm-3
On voit que une maille contient
4 atomes.
En effet :
* les atomes situés aux sommets
appartiennent simultanément à 8 mailles différentes
soit 8 * 1/8 = 1 atome par maille.
* les atomes situés aux centres des faces
appartiennent simultanément à 2 mailles différentes
soit 6 * 1/2 = 3 atome par maille.
Au total on a donc bien 3 + 1 =
4 atomes par mailles.
Soit une masse de 26,98 / N =
4,48 10-23 g.
Le volume de la maille est V = a3
r
= M / V è V = M / r è a3 = 4,48 10-23
/ 2,7 = 1,66 10-23 cm3
a = 2,55 10-8
cm = 2,55 10-10 m = 2,55 A°
Soit R = 0,3536 a = 0,90 A°
6-4) Le rayon ionique de
l'aluminium est de 0,51 pm.
6-4-a) Quelle est la nature de
l'ion en question ? Al3+
6-4-b) Justifiez que cet ion soit
le plus stable de l'Aluminium.
Al3+
: 1s2 2s2
2p6 : même configuration que
l'Hélium donc très stable
6-4-c) Justifiez le fait que le
rayon ionique de Al soit très nettement inférieur à
son rayon métallique.
Le rayon
atomique est sensiblement proportionnel au n2/Z*
Quand on passe
de Al à Al3+ n diminue et Z*
augmente : R diminue donc très sensiblement.
- Métallurgie de l'aluminium
7-1 : Quel est le nom du minerais
d'aluminium ?
Le minerai d'aluminium
est la bauxite. Il s'agit essentiellement d'oxyde d'aluminium
hydraté Al2O3.
7-2 : Décrire très succinctement le
procédé d'élaboration du métal aluminium à partir de son
minerais.
La bauxite est purifiée
et transformée en alumine pure Al2O3.
L'alumine est ensuite fondue en présence de cryolithe Na3AlF6.
On procède alors à une électrolyse du mélange fondu pour
obtenir l'aluminium métallique
Partie B : Le
chlorure d'Aluminium
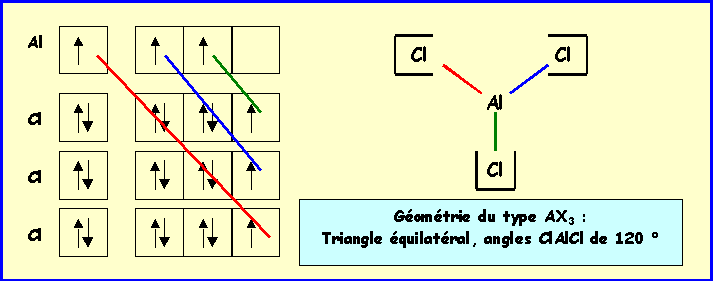
A l'état solide, ce composé est
simplement de type ionique.
B-1 : Quelle est alors sa formule chimique
? Al3+
; 3 Cl-
A l'état gazeux ou liquide à haute
température, on obtient un composé de même formule mais de
type covalent.
B-2 : Donner son schéma de Lewis
moléculaire et prévoir sa géométrie.
Ce composé est un acide de Lewis très
utilisé comme catalyseur en chimie organique lors de la
réaction de Friedel et Craft.
B-3 : Rappeler le mécanisme de cette
réaction en précisant le rôle du catalyseur.
Grâce à sa case quantique vide Al
(acide de lewis) peut former une liaison de coordination avec une
base de Lewis possédant un doublet libre. Par exemple un ion Cl-
pour donner AlCl4-.
AlCl3 pourra donc réagir avec un
composé halogéné pour donner AlCl4- et un carbocation. Le
carbocation réagira ensuite sur le noyau aromatique pour donner
une addition électrophyle.
Le proton libéré réagit ensuite avec
AlCl4- pour donner HCl
et régénérer le catalyseur.
RCl + AlCl3 = R+
+ AlCl4-
R+ + C6H6
= R-C6H5 + H+
H+ + AlCl4-
= AlCl3 + HCl
Bilan : RCl + C6H6
= R-C6H5 + HCl
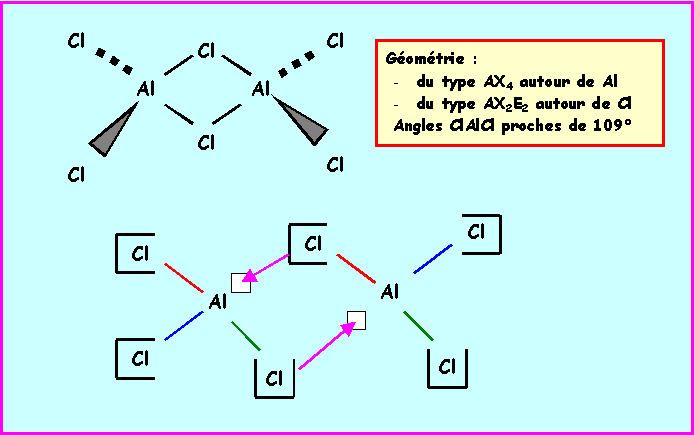
A l'état liquide à basse température on
obtient un composé moléculaire de formule brute Al2Cl6
dans lequel des atomes de chlore sont liés simultanément à
deux atomes d'aluminium.
B-4 : Justifiez simplement la formation de
cette structure et précisez sa géométrie par une
représentation spatiale.
Partie C :
Propriétés des solutions aqueuses de l'ion Aluminium III
C-1) L'ion alluminium (III) existe en
solution aqueuse sous forme d'ion complexe de formule [ Al(H2O)6]3+
ce cation est un acide de Bronsted de pKa = 5.
Le couple acidobasique est : [ Al(H2O)6]3+
/ [ AlOH(H2O)5]2+
Donner le nom des deux complexes
[ Al(H2O)6]3+
: cation hexa-aqua aluminium (III)
[ AlOH(H2O)5]2+
: cation hydroxy penta-aqua aluminium (III)
Calculer le pH d'une solution 10-3
mol.L-1 d'ion Al3+
[Al(H2O)6]3+
+ H2O = [ AlOH(H2O)5]2+
+ H3O+
Ka = [ AlOH(H2O)52+]
[H3O+] / [Al(H2O)63+]
Couple acido-basique classique qu'on
écrira plus simplement :
AH + H2O = A-
+ H3O+
Ka = [A-] [H3O+]
/ [AH]
Electroneutralité : [A-]
+ [OH-] = [H3O+]
è [A-] = [H3O+]
- [OH-]
Conservation de la matière
: [A-] + [AH] = C è [AH] = C
- [A-] = C - [H3O+]
+ [OH-]
Ka = = { [H3O+]
- [OH-] } [H3O+]
/ { C - [H3O+]
+ [OH-] }
pKa = 5 et pC = 3 : pC < pKa -1
On peut négliger la présence des ions
OH- et A-.
[A-] = [H3O+]
- [OH-] è [A-]
»
[H3O+]
[AH] = C - [A-]
è [AH] » C
Ka » = [H3O+]2
/ C
[H3O+]2
/» = Ka C
pH = 1/2 (pKa + pC)
pH = 0,5 * (5+3) = 4
Remarque :
La résolution exacte sans
approximations conduit à 4,02 < pH < 4,03
Calculer le pH d'une solution 10-5
mol.L-1 d'ion Al3+
pKa = 5 et pC = 5 : pC = pKa
On ne peut plus négliger la présence
de A-.
Ka » [H3O+]2
/ ( C - [H3O+]
)
Ka » h2 / ( C - h )
Ka ( C - h ) » h2
Ka C - Ka h » h2
h2 + Ka h - Ka
C = 0
D = Ka2
+ 4 Ka C
h = [ -Ka + Ö { Ka2
+ 4 Ka C} ] / 2
h = [ -10-5 + Ö { 10-10
+ 4 10-10} ] / 2
h = [ -10-5 + Ö { 5 10-10}
] / 2 = 6,18 10-6 mol.L-1
pH = -log h = 5,21
Remarque :
La résolution exacte sans
approximations conduit à 5,20 < pH < 5,21
C-2) On considère maintenant simplement
l'ion Al3+(aq), sans plus tenir compte de l'équilibre
précédant. On donne les équilibres suivants :
Al(OH)3(s) = Al3+
(aq) + 3 OH- (aq) (Constante d'équilibre Ks)
Al(OH)4- (aq)= Al3+
(aq) + 4 OH-(aq) (Constante d'équilibre Kd)
C-2-a : Exprimer la "solubilité
totale" (concentration totale des espèces solubles) de
Al(III) en fonction des concentrations de Al3+ et
Al(OH)4-
s = [Al3+] +
[Al(OH)4-]
C-2-b : Exprimer la "solubilité
totale" (concentration totale des espèces solubles) de
Al(III) en fonction de la concentration de l'ion OH-,
de Ks , Kd (pour une solution en présence de Al(OH)3(s)).
Présence de Al(OH)3
(s) : Ks = [Al3+] [OH-]3
è [Al3+] = Ks / [OH-]3
Présence de Al(OH)4-
: Kd = [Al3+] [OH-]4
/ [Al(OH)4-]
[Al(OH)4-]=
[Al3+] [OH-]4
/ Kd
[Al(OH)4-]=
Ks [OH-] / Kd
s = [Al3+] +
[Al(OH)4-]
s = ( Ks / [OH-]3)
+ (Ks [OH-] / Kd )
C-2-c : Montrer que cette expression peut
se simplifier en négligeant une des deux espèces solubles par
rapport à l'autre.
s = [Al3+] +
[Al(OH)4-]
En milieu "Acide" : [Al3+]
>>> [Al(OH)4-]
è s » [Al3+] = Ks / [OH-]3
En milieu "basique" : [Al3+]
<<< [Al(OH)4-]
è s » [Al(OH)4-]
= Ks [OH-] / Kd
C-2-d : Exprimer ps = -log (s) en fonction
de la concentration de pH, de pKs et de pKd
En milieu "Acide" : s » Ks / [OH-]3
log s = log Ks - 3 log [OH-]
-log s = -log Ks + 3 log [OH-]
ps = pKs - 3 pOH
ps = pKs - 3 (14 - pH)
ps = pKs - 42 + 3 pH
En milieu "basique" : s
= Ks [OH-] / Kd
log s = log Ks + log [OH-]
- log Kd
-log s = -log Ks - log [OH-]
+ log Kd
ps = pKs + pOH - p Kd
ps = pKs + 14 - pH - pKd
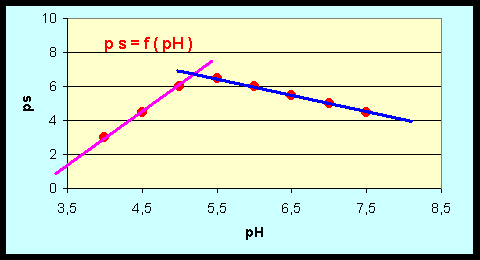
C-2-e : On donne la solubilité totale de
Al(III) et son cologarithme décimal en fonction du pH : Tracer
la courbe ps = f (pH) et en déduire les valeurs de pKs et pKd
pH
|
s
|
p s
|
4
|
1,00E-03
|
3,00
|
4,5
|
3,17E-05
|
4,50
|
5
|
1,10E-06
|
6
|
5,5
|
3,48E-07
|
6,5
|
6
|
1,00E-06
|
6,00
|
6,5
|
3,16E-06
|
5,50
|
7
|
1,00E-05
|
5,00
|
7,5
|
3,16E-05
|
4,50
|
En milieu acide : ps = pKs
- 42 + 3 pH
On obtient une droite de pente p = 3 et
d'ordonnée à l'origine O = pKs - 42
Il suffit donc de calculer O pour en
déduire pKs.
On trouve O = -9 soit pKs = 33
En milieu "basique"
: ps = pKs + 14 - pH - pKd
On obtient une droite de pente p = -1 et
d'ordonnée à l'origine
O = pKs + 14 - pKd
Il suffit donc de calculer O pour en
déduire pKd.
On trouve O = 12 soit pKd = 33 + 14 - 12
= 35
C-2-f : Pour quel pH la solubilité de
l'ion Al(III) est-elle minimale ? Estimez cette solubilité
minimale.
Les deux droites se coupent au point
correspondant à la solubilité minimale.
Il suffit de calculer les coordonnées
de ce point d'intersection.
-9 + 3 pH = 12 - pH
4 pH = 21
pH = 5,25
ps = -9 + 3*5.25 = 12 - 5,25 = 6,75
s = 1,8 10-7
mol.L-1
C-2-g: Décrire un test de reconnaissance
de l'ion Aluminium (III) couramment utilisé et basé sur cette
solubilité en fonction du pH.
On introduit un peu de solution de l'ion
Al3+ dans un tube à essai. On verse
goutte à goutte une solution diluée de soude.
On observe la formation d'un précipité
blanc gélatineux de Al(OH)3. Le
précipité se redissous si on verse la soude en excès.
On peut utiliser une solution de soude
plus concentrée pour faciliter la redissolution du précipité
et éviter ainsi d'avoir un volume trop grand à ajouter.
C-2-h : Citez un autre ion présentant le
même phénomène de précipitation puis redissolution quand le
pH augmente.
L'ion Zn2+
présente le même phénomène de précipitation sous forme
Zn(OH)2 puis redissolution sous forme de
l'ion complexe Zn(OH)42-.
Partie D : Oxydo-réduction
On donne le diagramme potentiel-pH de
l'aluminium pour une concentration de tracé de 10-3
mol.L-1.
Les espèces retenues pour l'étude sont
: Al - Al3+ - Al(OH)3
et Al(OH)4-
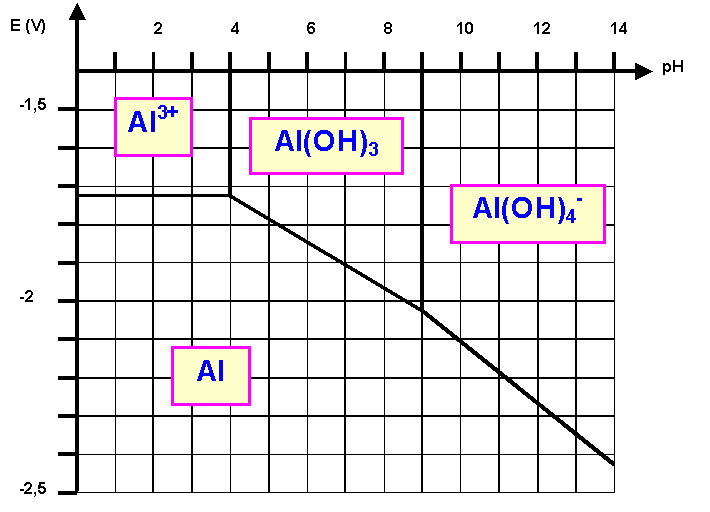
D-1 : Placer ces espèces sur le
diagramme.
Voir figure
D-2 : A partir du diagramme déterminer :
D-2-a : la valeur de pKs
On voit que le pH de début de
précipitation de Al(OH)3 est de pH = 4
soit pOH = 10 et [OH-] = 10-10
mol.L-1
Ks = [Al3+] [OH-]3
Ks = 10-3 * 10-30
= 10-33 è pKs = 33
D-2-b : la valeur de pKd
On voit que le pH de redissolution
complète de Al(OH)3 est de pH = 9 soit
pOH = 5 et [OH-] = 10-5
mol.L-1
On a établi précédemment : [Al(OH)4-]=
Ks [OH-] / Kd
Kd = Ks [OH-] /
[Al(OH)4-]
On a [Al(OH)4-]
= C = 10-3 mol.L-1
Kd = 10-33 * 10-5
* 103 = 10-35
pKd = 35
D-2-c : la valeur des potentiels normaux
d'oxydoréduction des couples :
* Al3+ /
Al
Al3+ + 3 e-
= Al
E = E0 + 0,02
log [Al3+]
E0= E - 0,02
log [Al3+] = E + 0,06
Sur le diagramme on trouve E » -1,72 V
Soit E0
Al3+/Al = - 1,66 V
* Al(OH)3
/ Al
Al(OH)3 + 3 e-
= Al + 3 OH-
E = E0 + 0,02
log { 1/[OH-]3
}
E = E0 - 0,02
log { [OH-]3 }
E = E0 - 0,06
log [OH-]
E = E0 + 0,06
pOH
E = E0 + 0,06
(14 - pH )
E = E0 + 0,84 -
0,06 pH
E0= E - 0,84 +
0,06 pH
La droite correspondante passe par le
point de coordonnées :
pH = 4 - E = -1,72 V è E0
= -1,72 - 0,84 + 0,06 *4 = - 2,32 v
E0Al(OH)3
/ Al = -2,32 V
Remarque : On peut aussi
calculer E0 par la méthode
thermodynamique :
(1) Al(OH)3 =
Al3+ + 3 OH- DRG0(1)
= - RT ln Ks
(2) Al3+ + 3 e-
= Al DRG0(2)
=- 3 F E0(2)
(3) Al(OH)3 + 3
e- = Al + 3 OH-
DRG0(3)
=- 3 F E0(3)
(3) = (1) + (2)
DRG0(3)
= DRG0(1)
+ DRG0(2)
- 3 F E0(3) = -
RT ln Ks - 3 F E0(2)
E0(3) = RT/3F
ln Ks + E0(2)
E0(3) = - 0,02
pKs + E0(2)
E0(3) = - 0,02
* 33 + -1,66 = - 2,32 V
*
Al(OH)4 -/ Al
Al(OH)4 -
+ 3 e- = Al + 4 OH-
E = E0 + 0,02
log { [Al(OH)4-] / [OH-]4
}
E = E0 + 0,02
log { [Al(OH)4-] } -
0,02 log { [OH-]4
}
E = E0 + 0,02
log { [Al(OH)4-] } -
0,08 log { [OH-] }
E = E0 + 0,02
log { [Al(OH)4-] } +
0,08 pOH
E = E0 + 0,02
log { [Al(OH)4-] } +
0,08 ( 14 - pH )
E = E0 + 0,02
log { [Al(OH)4-] } +
1,12 - 0,08 pH
E = E0 + 0,02
log { 10-3 } + 1,12 - 0,08 pH
E = E0 - 0,06 +
1,12 - 0,08 pH
E = E0 + 1,06 -
0,08 pH
E0 = E - 1,06 +
0,08 pH
La droite correspondante passe par le
point de coordonnées :
pH = 9 - E = -2,02 V è E0=
-2,02 - 1,06 + 0,08 *9 = - 2,36 v
Al(OH)4-
/ Al = -2.36 V
Remarque : On peut aussi
calculer E0 par la méthode
thermodynamique :
(1) Al(OH)4 =
Al3+ + 4 OH- DRG0(1)
= - RT ln Kd
(2) Al3+ + 3 e-
= Al DRG0(2)
=- 3 F E0(2)
(3) Al(OH)4 + 3
e- = Al + 4 OH-
DRG0(3)
=- 3 F E0(3)
(3) = (1) + (2)
DRG0(3)
= DRG0(1)
+ DRG0(2)
- 3 F E0(3) = -
RT ln Kd - 3 F E0(2)
E0(3) = RT/3F
ln Kd + E0(2)
E0(3) = - 0,02
pKd + E0(2)
E0(3) = - 0,02
* 35 + -1,66 = - 2,36 V
E : Corrosion de l'aluminium
E-1 : Montrez que le métal aluminium est
thermodynamiquement instable quand il est en contact avec l'eau.
Couple de l'eau en tant qu'oxydant
:
2 H+ + 2 e-
= H2
E = E0 + 0,03
log { [H+]2 /
pH2 }
E = E0 + 0,03
log [H+]2 -
0,06 log pH2
Si on pose pH2
= 1 bar
E = E0 + 0,03
log [H+]2
E = E0 - 0,06
pH
De plus E0 =
0,000 V par convention.
E = -0,06 pH
E = -0,06 V à pH = 0 et E = -0,84 V à
pH = 14
Quel que soit le pH, le potentiel du
couple H2O/H2
est supérieur a celui des couples Al(III)/Al, H2O
oxydera donc Al quel que soit le pH. L'aluminium est donc en
principe toujours attaqué par l'eau. En pratique toutefois il se
forme une couche protectrice d'alumine Al2O3
imperméable qui protège l'aluminium de la
corrosion, c'est le phénomène de passivation.
Ecrire les réactions qui se produisent
entre le métal aluminium et l'eau en milieu :
* Acide ( pH < 3) : Domaine de Al3+ et H3O+
Al = Al3+ + 3 e-
2 H+ + 2 e-
= H2
2 Al + 6 H+ = 2
Al3+ + 3 H2
2 Al + 6 H3O+
= 2 Al3+ + 3 H2
+ 6 H2O
* Neutre ( 6 < pH < 8) : Domaines de Al(OH)3
et H2O
Al + 3 OH-= Al
(OH)3 + 3 e-
2 H+ + 2 e-
= H2
2 Al + 6 OH-+ 6
H+ = 3 H2 + 2
Al(OH)3
2 Al + 6 H2O
= 2 Al(OH)3 + 3 H2
* Basique ( pH > 11) : Domaine de Al(OH)4-
et OH-
Al + 4 OH- = Al
(OH)4- + 3 e-
2 H+ + 2 e-
= H2
2 Al + 8 OH- +
6 H+ = 2 Al(OH)4-
+ 3 H2
2 Al + 6 H2O
+ 2 OH- = 2 Al(OH)4 +
3 H2
E-2 : Quelle réaction devrait
"normalement" se produire entre l'aluminium métallique
et l'acide nitrique concentré ?
HNO3 + 3 H+ + 3 e-
= NO + 2 H2O (E0 = 0,96 V )
Al = Al3+ + 3 e-
HNO3 + 3 H+ + Al = NO
+ 2 H2O + Al3+
4 HNO3 + Al =
NO + 2 H2O + Al3+
+ 3 NO3-
E-3 : En fait, l'acide nitrique
concentré n'attaque pas l'aluminium. Proposez une explication.
Il se forme une couche protectrice
d'alumine Al2O3 imperméable
qui protège l'aluminium de la corrosion, c'est le phénomène de
passivation.
E-4 : Cette résistance à l'oxydation
permet l'utilisation de l'aluminium dans des application
courantes. Citez-en quelques unes.
Aviation - Casseroles - papier aluminium
- menuiserie aluminium etc
E-5 : Un procédé appelé anodisation de
l'aluminium est utilisé industriellement pour renforcer cette
résistance à la corrosion. En décrire brièvement le principe.
L'anodisation consiste en une
électrolyse de l'eau acidifiée par H2SO4
(20 % en volume), la cathode est une électrode inerte (graphite
ou platine) et l'anode est constituée par la pièce d'aluminium
à protéger. A la cathode on observe la réduction de l'eau et
à l'anode l'oxydation de Al en alumine, la couche d'alumine
obtenue peut ensuite être colorée par adsorbtion d'un colorant
dissous dans de l'eau chaude. Le colorant est fixé et on obtient
une pièce d'aluminium colorée dans la masse et protégée de
toute oxydation ultérieure par une couche protectrice très
efficace. Toutes les pièces d'aluminium sont ainsi protégées
par anodisation.
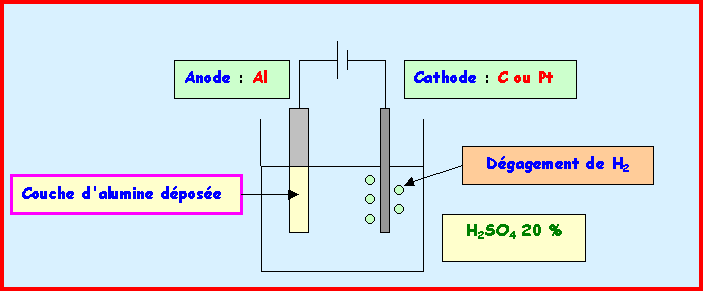
Réactions :
Cathode :
2 H2O
+ 2 e- = H2 + 2
OH-
Anode :
H2O = O2
+ 2 H+ + 2 e-
2 Al + 3 O2 =
Al2O3
2 Al + 3 H2O
= Al2O3 + 6 H+
+ 6 e-
Réaction globale :
2 Al + 3 H2O
= Al2O3 + 3 H2






