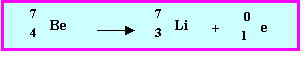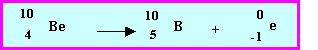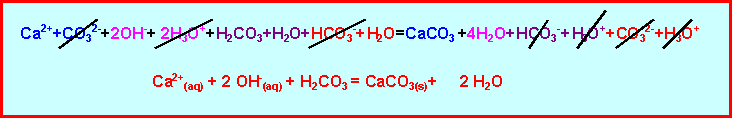PLP2 MATH-SCIENCES – SUJET DE CHIMIE
Les alcalino-terreux
I – GENERALITES SUR LES ATOMES
Données :
Masse Molaire du Potassium : 40 g.mol-1
masse du proton : mp = 1,00727 u.m.a
masse du neutron : mn=1,00866 u.m.a
1 Faraday = 96500 C
Nombre d'Avogadro : N = 6,022 1023
Constante de Planck : h = 6,62 10-34 J.s
On connaît actuellement 6 éléments appartenant à cette famille qui sont (classés par ordre croissant de leur numéro atomique) : Béryllium – Magnésium - Calcium – Strontium – Baryum et Radium.
- Quelle colonne de la classification périodique occupe la famille des alcalino-terreux ?
- Donnez à chacun son numéro atomique sa configuration électronique.
Colonne 2 : tous ont une configuration du type [gaz rare] n s2
Leur numéro atomique sera donc celui du gaz rare plus deux.
Les gaz rares sont : He (2) - Ne(10) - Ar(18) - Kr(36) - Xe(54) - Rn(86)
D'ou le tableau :
|
Nom |
Symbole |
Z |
Configuration |
|
Bérylium |
Be |
4 |
1s2 2s2 = [He] 2s2 |
|
Magnésium |
Mg |
12 |
[He] 2s2 2p6 3s2 = [Ne] 3s2 |
|
Calcium |
Ca |
20 |
[Ne] 3s2 3p6 4s2 = [Ar] 4s2 |
|
Strontium |
Sr |
38 |
[Ar] 3d10 4s2 4p6 5s2 = [Kr] 5s2 |
|
Baryum |
Ba |
56 |
[Kr] 4d10 5s2 5p6 6s2 = [Xe] 6s2 |
|
Radium |
Ra |
88 |
[Xe] 4 f14 5d10 6s2 6p6 7s2 = [Rn] 7s2 |
- Un autre élément devrait normalement appartenir à cette famille mais en a été exclu. Lequel et pour quelle raison ?
L'Hélium de configuration 1s2 devrait appartenir à la colonne 2 mais on l'a déplacé en colonne 18 car c'est un gaz rare très stable.
- Si l’on réussit un jour à obtenir un septième alcalino-terreux quel seront son numéro atomique et sa configuration électronique ?
Z = 120
- [Rn] 5f14 6d10 7s2 7p6 8s2
- Quel type d’ion donnent les alcalino-terreux ?
Ils perdent facilement leurs deux électrons s2 pour donner l'ion X2+ qui possède la configutation d'un gaz rare.
- Quelles sont les formules des oxydes des alcalino-terreux sachant qu’il s’agit de composés ioniques ?
O donne l'ion O2- , les oxydes d'alcalino-terreux sont donc du type XO.
- Ces oxydes sont-ils acides ou basiques ? Justifiez simplement.
Les alcalino-tereux sont tous des métaux, leurs oxydes sont donc basiques.
Exemple
: CaO + H2O = Ca2+ + 2 OH-
- Les alcalino-terreux ont des énergies de première ionisation " anormalement élevées " et des affinités électroniques " anormalement faibles ". Comment peut-on expliquer simplement ces deux " anomalies " ?
Leur couche de valence ns2 se compose d'une sous-couche totalement remplie ce qui leur confère une assez grande stabilité, il sera donc difficile de leur arracher un électron (énergie d'ionisation élevée) et également difficile de leur ajouter un électron supplémentaire (affinité électronique faible).
- Le Béryllium ne possède qu’un seul isotope stable. Sa masse molaire atomique est 9,012 g. mol-1.
- Calculez l’énergie de cohésion de cet isotope stable, en Joule mol-1 puis en MeV par noyau puis en MeV par nucléon.
Masse "théorique" du noyau
:
On sait que ZBe = 4, de plus on sait que M
» A.
On a donc ici A = 9 et donc N = 5.
mthéo = 4 * 1,00727 + 5 * 1,00866 = 9,07238 u.m.a / noyau = 9,07238 g mol-1
Défaut de masse
:
D
m = ˝ 9,012 - 9,07238 ˝ = 0,06038 u.m.a / noyau = 0,06038 g mol-1
La masse réelle du noyau est inférieure à sa masse " théorique ", le noyau est plus stable que ses constituants séparés. Il y a donc dégagement d’énergie lors de la formation du noyau à partir de ses constituants. La masse perdue est entièrement convertie en énergie.
Energie de cohésion
:
E =
Dm C2 = 0,06038 10-3 * 9 1016 = 5,4342 1012 J.mol-1
Soit 5,4342 1012 / e (en eV. mol-1) soit 5,4342 1012 / N e (en eV. noyau-1)
or N.e = F = 96500 C
Soit 5,4342 1012 / 96500 = 56,31 106 eV / noyau = 56,31 MeV / noyau
Soit pour l'énergie moyenne par nucléon : 56,31 / 9 = 6,26 MeV / nucléon
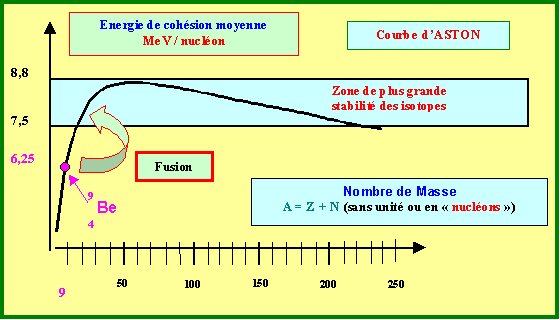
- Représentez sommairement la courbe d’Aston de stabilité des isotopes et y placer cet isotope. Fait-il parti des isotopes les plus stables ? Si non, par quel type de processus peut-il se stabiliser ?
Il se situe en dessous de la zone de plus grande stabilité et pourra se stabiliser par fusion nucléaire.
Cet isotope est utilisé comme " générateur de neutrons " dans l’industrie nucléaire. Un atome de cet isotope fixe en effet une particule
a, un neutron est libéré et il se forme un autre noyau dont on précisera la nature exacte. Ecrire la transformation correspondante et dire si elle est en accord avec la réponse à la question 8-b)
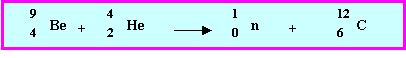
Il s’agit bien d’une réaction de fusion dans laquelle deux noyaux " légers " s’unissent pour donner un noyau plus " gros ".
Il existe également trois isotopes radioactifs du Béryllium 8Be , 9Be et 10Be.
Un de ces isotopes est émetteur de type
a ce qui peut paraître surprenant puisque ce type de radioactivité est généralement observé pour les atomes lourds de Z>84. Quel est cet isotope ? Qu’a-t-il de particulier qui justifie cette forme de radioactivité ? Ecrire la réaction nucléaire correspondante.
Le noyau de 8Be est équivalent à deux particules
a il se scinde donc facilement en deux particules a individuelles.

Remarque
: Au début du siècle, à l’aube des études sur l’atome et la radioactivité on a pensé que les particules a étaient des particules élémentaires.
- Les deux autres isotopes sont des émetteurs de type
b. Attribuez à chacun son type de radioactivité b+ ou b- en justifiant simplement la réponse. Ecrire les réactions nucléaires correspondantes.
Isotope
7Be :
Par comparaison avec l'isotope stable 9Be pour lequel Z = 4 et N = 5
On constate que cet isotope instable
7Be pour lequel Z = 4 et N = 3 présente un " déficit " de neutrons, il cherchera donc à se stabiliser en transformant un proton en neutron. Il sera donc émetteur b+.
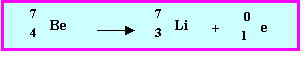
Isotope 10Be :
Par comparaison avec l'isotope stable 9Be pour lequel Z = 4 et N = 5
On constate que cet isotope instable
10Be pour lequel Z = 4 et N = 6 présente un " excès " de neutrons il cherchera donc à se stabiliser en transformant un neutron en proton. Il sera donc émetteur b-.
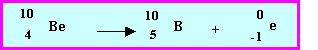
- Le Strontium est très utilisé en pyrotechnie (feux d’artifices) en raison de la belle couleur rouge qu’il émet quand il est mis dans une flamme, cette émission de lumière rouge est due à deux raies intenses présentes dans son spectre d’émission. La première dont la longueur d’onde est de 605 nm est de couleur jaune-orangée, la deuxième correspond à une longueur d’onde de 461 nm et est de couleur bleue. On donne d’autre part l’énergie de première ionisation du Strontium qui est de 5,7 eV/atome.
- Calculer les énergies associées à ces deux raies.
E = h
n = h C / l
E1 = 6,62 10-34 * 3 108 / 605 10-9 = 3,28 10-19 J
E2= 6,62 10-34 * 3 108 / 461 10-9 = 4,31 10-19 J
Calculer la longueur d’onde de la raie émise quand l’électron passe de l’état ionisé à l’état fondamental.
Le passage de l'état ionisé à l'état fondamental correspond à l'énergie d'ionisation de l'atome.
E = 5,7 eV = 9,12 10-19 J
E = h C /
l
l
= h C / E = 6,62 10-34 * 3 108 / 9,12 10-19 = 2,178 10-7 m = 217,8 nm
- Le Magnésium (Z=12) possède trois isotopes stables 24Mg, 25Mg et 26Mg leurs abondances naturelles sont respectivement : 78,6% - 10,1 % et 11,3% . Calculer la masse molaire atomique approchée du Magnésium et expliquer pourquoi le résultat obtenu n’est qu’approximatif.
On peut faire l’approximation mp
» mn » 1 u.m.a, on néglige de plus la masse des électrons et surtout le défaut de masse du noyau.
M =
Sxi Mi
Mi
» S xi Ai
MAl = 0,786 * 24 + 0,101* 25 + 0,113 * 26 =
24,3 g mol-1
Si on vérifie sur une table on constate que ces approximations ne faussent que très peu le résultat. Le premier chiffre après la virgule reste correct. On pourra donc dans la plupart des cas et si on n'a pas besoin d'une extrême précision assimiler Nombre de Masse A et masse molaire atomique pour un isotope donné.
II) Oxyde de Calcium
Comment prépare-t-on l’oxyde de Calcium ?
L'oxyde de Calcium est obtenu par calcination du carbonate de calcium CaCO3, des roches calcaires ou des coquillages et des coraux.
CaCO3 (s) = CaO(s) + CO2(g)
Quel est le nom courant de l’oxyde de calcium ?
Il s'agit de la chaux.
Citez quelques usages courants de cet oxyde.
C'est un des composants principaux des ciments, elle est aussi utilisé seule pour la fabrication des mortiers. La chaux est aussi utilisée pour augmenter le pH des sols trop acides (chaulage). Elle est également utilisée dans la fabrication du papier, du verre, du badigeon (lait de chaux), dans le tannage du cuir, le raffinage du sucre et comme agent adoucissant dans l'eau.
L'eau de chaux, solution alcaline de chaux éteinte dans l'eau, est principalement utilisée en médecine comme anti-acide pour neutraliser les intoxications et dans le traitement des brûlures.
Dans l’enseignement secondaire cet oxyde est utilisé pour caractériser le dioxyde de carbone.
Décrire l’expérience réalisée.
Test à l'eau de chaux
:
On dissous de l'oxyde de calcium CaO dans de l'eau distillée. On filtre le CaO qui ne s'est pas dissous car sa solubilité est très faible. Le filtrat est l'eau de chaux. On fait barbotter CO2 dans le filtrat, on observe un trouble blanc. Il se forme du carbonate de calcium CaCO3 très peu soluble.
CaO + H2O = Ca2+ + 2 OH-
CO2 + 2 OH- = CO32- + H2O
CO32- + Ca2+ = CaCO3 (s)
L’oxyde de calcium réagit avec l’eau. Ecrire la réaction.
CaO + H2O = Ca2+ + 2 OH-
On donne la solubilité à 25 °c dans l’eau pure de l’oxyde de calcium : s = 1,8 10-2 mol.L-1.
Calculer le pKs correspondant.
Résolution exacte
Ks = [Ca2+] [OH-]2
C.M(Ca) : s = [Ca2+]
E.N : 2 [Ca2+] + [H3O+] = [OH-]
[OH-]2 = Ks /[Ca2+] = Ks / s
[OH-] =
Ö ( Ks/s)
[H3O+] = Ke / [OH-] = Ke /
Ö ( Ks/ s)
2 s +
Ke / Ö ( Ks / s) = Ö ( Ks / s)
On peut résoudre directement cette équation par une méthode itérative, on trouve alors
4,632 < pKs < 4,633
Résolution approchée
:
On peut se contenter d'une résolution approchée en négligeant les ions OH- provenant de la dissociation de l'eau, en effet, la solubilité de CaO est relativement élevée et les ions OH- proviennent donc essentiellement de sa dissolution.
On a alors classiquement :
[Ca2+] = s
[OH-] = 2s
Soit Ks = [Ca2+][OH-]2 = 4 s3 = 4
* (1,8 10-2)3 = 2,33 10-5
Soit pKs = 4,632
Calculer le pH de la solution saturée.
[OH-] = 2 s = 3,6 10-2 mol.L-1
pOH = 1,44
pH = 12,6
En réalité, le pKs trouvé dans la littérature est de pKs = 5,3
Quelle raison peut-on invoquer pour justifier la différence ?
Les concentrations sont relativement élevées et on devrait utiliser l'activité
réelle des espèces ioniques et non leurs concentrations.
Pour la suite on prendra la valeur pKs = 5,3.
On donne le pKs de CaCO3 : pKs = 8,4 et les pKa successifs de l’acide carbonique CO2,H2O : pK1 = 6,4 et pK2 = 10,3
Montrer qu’il y a précipitation de CaCO3 si on fait barboter du CO2 dans la solution saturée d’oxyde de calcium.
Pour qu'il y ait précipitation de CaCO3 on doit avoir :
[Ca2+] [CO32-]
ł Ks
[CO32-]
ł Ks / [Ca2+]
[CO32-]
ł 10-8,4 / 1,8 10-2
[CO32-]
ł 2,21 10-7 mol.L-1
Le pH de la solution étant initialement très basique (pH=12,6) on est très
largement dans le domaine de prédominance de CO32- (pH > pK2 + 1)
Tout le CO2 introduit sera donc sous forme CO32-. Comme de plus, il suffit
de très peu de CO2 on peut supposer que le pH ne variera pas.
La précipitation de CaCO3 se produira donc dès que les premières bulles
de CO2(g) barboterons dans la solution.
Toutefois, si on fait barboter CO2 trop longtemp, on peut observer la redissolution du précipité formé.
Comment évolue le pH de la solution au cours du barbotage de CO2 ?
CO2 étant acide, le pH va diminuer au cours du barbotage.
Calculer la molarité des ions CO32- au moment de la redissolution
Au moment de la redissolution du précipité on est dans la même situation qu'au moment de sa précipitation : la présence d'un grain aussi minuscule qu'on le désire de CaCO3 solide permet d'écrire simultanément que le Ks est atteint et que la concentration de Ca2+ est égale a sa concentration initiale.
On à donc :
[Ca2+] = s = 1,8 10-2 mol.L-1 et [CO32-] = Ks / [Ca2+] =
2,21 10-7 mole.L-1.
Remarque
: Ce genre de raisonnement limite est très courant dans les problèmes concernant les précipitations.
Calculer le pH lors de la redissolution.
Remarque
: les notations CO2,H2O - CO2(aq) ou H2CO3 sont équivalentes.
On peut facilement exprimer la concentration de HCO3- en fonction de celles de H3O+ et de CO32- par l'intermédiaire du Ka2.
HCO3- + H2O = CO32- + H3O+
K2 = [CO32-] [H3O+] / [HCO3-]
[HCO3-]= [CO32-] [H3O+] / K2
On peut de même facilement exprimer la concentration de H2CO3 en fonction de celles de H3O+ et de HCO3- par l'intermédiaire du Ka1.
H2CO3 + H2O = HCO3- + H3O+
K1 = [HCO3-] [H3O+] / [H2CO3]
[H2CO3]= [HCO3-] [H3O+] / K2 = [CO32-] [H3O+]2 / (K2 K1)
Electroneutralité
:
2 [Ca2+] + [H3O+] = [OH-] + [HCO3-] + 2 [CO32-]
2 [Ca2+] + h = Ke/h + [CO32-] h / K2 + 2 [CO32-]
[Ca2+] = 1,8 10-2 mol.L-1
[CO32-] = 2,21 10-7 mol.L-1
3,6 10-2 + h = 10-14/h + 2.21 10-7 h / 10-10,3 + 4,42 10-7
3,6 10-2 - 4,42 10-7 = 10-14/h + 4408.5 h
3,6 10-2 h = 10-14 + 4408,5 h2
4408,5 h2 - 3,6 10-2 h + 10-14 = 0
On trouve : h = 8,165 10-6 mole.L-1 et
pH = 5,1
En déduire la molarité des autres espèces carbonées.
[HCO3-]= [CO32-] [H3O+] / K2 = 2,21 10-7 * 8,165 10-6 / 10-10,3 = 0,0360 mol.L-1
[H2CO3]= [CO32-] [H3O+]2 / (K2 K1) = 2,21 10-7 * (8,165 10-6)2 / 10-16,7= 0,738 mol.L-1
Faudra-t-il un léger ou inversement un très grand excès de CO2 pour observer cette redissolution Le test à l'eau de chaux risque-t-il d'être faussé ?
Soit pour la concentration totale :
0,738 + 0,0360 + 2,21 10-7 = 0,774 mol.L-1
Il faut un très large excès de CO2 pour pouvoir observer la redissolution.
Le test à l'eau de chaux ne sera donc normalement pas faussé par la redissolution de CaCO3.
La réaction de précipitation de CaCO3 peut aussi s’écrire :
Ca2+(aq) + 2 OH-(aq) + CO2(aq) = CaCO3(s)+ H2O
Calculer la constante de cet équilibre.
Si on utilise la notation H2CO3 au lieu de CO2(aq) l'équation précédante s'écrit :
(1) Ca2+(aq) + 2 OH-(aq) + H2CO3 = CaCO3(s)+ 2 H2O
(2) HCO3- + H2O = CO32- + H3O+
(3) H2CO3 + H2O = HCO3- + H3O+
(4) OH- + H3O+ = 2 H2O
(5) Ca2+ + CO32- = CaCO3
= (5) + 2 *(4) + (3) + (2)
D
RG01 = DRG05 + 2 DRG04 + DRG03 + DRG02
K1 = K5 * K42 * K3 * K2
K1 = 108,4 * 1028 * 10-6,4 * 10-10,3 = 1019,7 = 5,01 1019
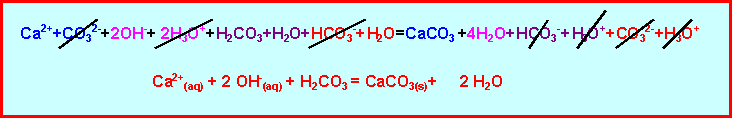
- Que se passe-t-il si on souffle dans une pipette immergée dans une solution saturée d’oxyde de calcium ? Pourquoi ?
Le CO2 expiré provenant de la respiration trouble l'eau de chaux.
On donne la constante de l’équilibre de dissolution de CO2 : CO2(g) = CO2(aq) Kdis = 3 10-2
On suppose que le pH moyen de la salive est 6,75 et que la concentration moyenne des ions Ca2+ dans la salive est de 3 10-3 mol.L-1. On suppose que le CO2 expiré est à la pression partielle de 0,04 bars.
17) Dans de telles conditions la formation d’un dépôt de CaCO3 sur les dents est-il thermodynamiquement favorisée ?
Ca2+(aq) + 2 OH-(aq) + H2CO3 = CaCO3(s)+ 2 H2O K = 5,01 1019
D
RG = DRG0 + RT ln Q
D
RG = -RT ln K + RT ln Q
D
RG = RT ln (Q/K)
Si Q < K :
DRG < 0 : Réaction thermodynamiquement favorisée
Si Q > K : DRG > 0 : Réaction thermodynamiquement défavorisée
Q = aCaCO3 aH2O2 / { aCa2+ aOH-2 aH2CO3 }
aCaCO3 = 1 : CaCO3 solide pur dans sa phase
aH2O = 1 : H2O est le solvant
aCa2+ = [Ca2+]
aH2CO3 = [H2CO3]
aOH- = [OH-]
Q = 1/ { [Ca2+][OH-]2[H2CO3] }
[Ca2+] = 3 10-3 mol.L-1
pH = 6,75
è pOH = 7,25 è [OH-] = 5,623 10-8 mol.L-1
Calcul de [H2CO3]
CO2(g) = CO2(aq)
Kdis = 3 10-2 = [H2CO3] / PCO2
|H2CO3] = 3 10-2 PCO2 = 3 10-2 * 0,04 =
1,2 10-3 mol.L-1
Sans tenir compte des équilibres acidobasiques :
On peut supposer que les équilibres acidobasiques concernant H2CO3 n'interviennent pas et que la concentration de H2CO3 est constamment maintenue par l'équilibre de dissolution a cette valeur de
1,2 10-3 mol.L-1.
Calcul de Q :
Q = 1/ { 3 10-3 * (5,623 10-8)2 * 1,2 10-3 } = 8,8 1019
Q > K :
DRG > 0 : Réaction thermodynamiquement défavorisée
En tenant compte des équilibres acidobasiques :
Si on considère que le pH de la salive est constant on peu tenir compte des équilibres acidobasiques et considérer que la concentration totale de H2CO3 est maintenue constante à 1,2 10-3 mol.L-1 par l'équilibre de dissolution mais que cette concentration totale se répartie entre les trois espèces H2CO3 , HCO3- et CO32-. Il nous faut alors calculer la concentration de H2CO3 à pH = 6,75.
pH = pK1 + log [HCO3-]/ [H2CO3]
[HCO3-]/ [H2CO3] = R1 = 10(pH-pK1)
pH = pK2+ log [CO32-]/ [HCO3-]
[CO32-]/ [HCO3-] = R2 = 10(pH-pK2)
[HCO3-]/ [H2CO3] = R1
[HCO3-] = R1 [H2CO3]
[CO32-]/ [H2CO3] = R2
[CO32-] = R2[HCO3-] = R1 R2 [H2CO3]
Conservation de la matière :
C = [H2CO3] + [HCO3-] + [CO32-]
C = [H2CO3] + R1 [H2CO3] + R2 [H2CO3]
[H2CO3] = C / ( 1 + R1 + R1 R2 )
A pH = 7,75 : R1 = 2,239 - R2 = 2,818 10-4 - 1 + R1 + R1R2 = 3,239
[H2CO3] = C / ( 1 + R1 + R1 R2 ) =
1,2 10-3 / 3,239 = 3,7 10-4 mol.L-1
Calcul de Q :
Q = 1/ { 3 10-3
* (5,623 10-8)2 * 3,7 10-4 } = 2,8 1020
Q > K :
DRG > 0 : Réaction thermodynamiquement défavorisée
III) Dosage des ions Ca2+ et Mg2+ par compléxométrie
On veut doser une eau minérale contenant Ca2+ et Mg2+.
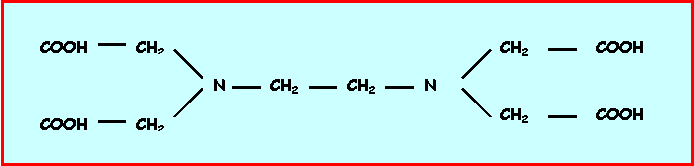
On utilise comme agent titrant l’acide éthylène diamine tétra acétique (E.D.T.A).
- Quelle est sa formule semi développée ?
L’indicateur utilisé est le NET.
Que signifie ce sigle ?
Noir Erhyochrome T
Comment se manifeste le virage si on tamponne le milieu à pH=10 ?
Le NET compléxé est rouge violacé, à pH = 10 le NET libre est bleu. Les complexes du NET étant moins stable que ceux de l'E.D.T.A, le virage se fera du rouge violacé au bleu.
Comment préparer une solution tampon molaire pH=10 à partir d’une solution 2 mol.L-1 d’ammoniaque et d’une solution 2 mol.L-1 d’acide chlorhydrique ? (pKa NH4+/NH3 = 9,25).
Supposons qu'on veuille préparer un litre de tampon pH = 10.
Résolution exacte
:
Ammoniaque NH3 : Cb Vb
Acide chlorhydique : Ca Va
Va + Vb = 1 L
NH4+ + H2O = NH3 + H3O+
Ka = [NH3] [H3O+] / [NH4+]
[H3O+] = Ka [NH4+] / [NH3]
pH = pKa + log { [NH3] / [NH4+] }
[NH3] / [NH4+] = R
pH = pKa + log R
log R = pH - pKa
R = 10(pH-pKa)
[NH3] = R [NH4+]
Conservation de la matière (N) :
Cb Vb / (Va + Vb) = C'b = [NH3] + [NH4+]
C'b = R [NH4+] + [NH4+] = [NH4+] ( 1 + R )
[NH4+] = C'b / ( 1 + R )
Conservation de la matière (Cl) :
Ca Va / (Va + Vb) = C'a = [Cl-]
Electroneutralité :
[Cl-] + [OH-] = [H3O+] + [NH4+]
C'a + [OH-] = [H3O+] + C'b / ( 1 + R )
[OH-] - [H3O+] = C'b / ( 1 + R ) - C'a
pH = 10
[H3O+] = 10-10
[OH-] = 10-4
R = 5,623
C'a = 2 Va / (Va + Vb) = 2 Va
C'b = 2 Vb / (Va + Vb) = 2 Vb
10-4 - 10-10 = 2 Vb / 6,623 - 2 Va
10-4 = 0,302 Vb - 2 Va
Vb = 1 - Va
10-4 = 0,302 - 0,302 Va - 2 Va = 0,302 - 2,302 Va
Va = ( 0,302 - 10-4 ) / 2,302 = 0,131 L = 131,1 mL
Vb = 1 - 0,131 = 0,869 L = 868,9 mL
On mélangera donc : Va = 131 mL de HCl à 2 mol.L-1 et Vb = 869 mLde NH3 à 2 mol.L-1 pour obtenir un litre de tampon pH = 10
Résolution approchée :
On considère la réaction prépondérante et quasi totale :
NH3 + H3O+
è NH4+ + H2O
|
|
NH3 (excès) |
H3O+ (défaut) |
NH4+ |
|
Etat initial |
Cb Vb |
Ca Va |
0 |
|
Etat Final |
Cb Vb - Ca Va |
0 |
Ca Va |
pH = pKa + log [ ( Cb Vb - Ca Va ) / Ca Va ]
[ ( Cb Vb - Ca Va ) / Ca Va ] = 10(pH-pKa) = 5,623
( 2 Vb - 2 Va ) / 2 Va = 5,623
( Vb - Va ) / Va = 5,623
( 1 - 2 Va ) / Va = 5,623
1 - 2 Va = 5,623 Va
1 = 7,523 Va
Va = 133 mL
Vb = 867 mL
La résolution approchée conduit à des résultats assez proches de la résolution exacte. De toute manière avec des concentrations aussi élevèes, on devrait tenir compte des activités et non des concentrations. Le résultat n'est donc pas exact même par résolution sans approximation.
On veut doser une eau minérale (eau de Cilaos) sur l’étiquette de laquelle il est écrit : Ca 110,5 mg/L – Mg 20,5 mg/L. On veut utiliser 100 ml d’eau minérale et avoir une tombée de burette de 10 ml.
Quel doit être le titre de la solution d’E.D.T.A utilisée ?
Le calcium et le magnésium donnent des complexes de stabilités équivalentes avec l'E.D.T.A, ils sont donc dosés simultanément.
[Ca2+] = 110,5 10-3 / 40 = 2,7625 10-3 mol.L-1
[Mg2+] = 20,5 10-3 / 24,3 = 8,4362 10-4 mol.L-1
C Totale = 3,606 10-3 mol.L-1
Soit 3,606 10-4 mole dans 100 mL d'eau à doser.
La réaction de complexation se fait mole à mole on donc doit avoir le même nombre de mole d'E.D.T.A dans les 10 mL de tombée de burette soit une concentration de 3,6 10-2 mol.L-1 pour l'E.D.T.A.