P.L.P.2 MATH-SCIENCES
DEVOIR DE CHIMIE
Exercice 1 :
Il existe deux oxydes de carbone différents :
Dioxyde de Carbone et Monoxyde de Carbone
1) Généralités :
-1a) Donner leurs formules chimiques
monoxyde de carbone : CO - dioxyde de carbone : CO2
-1b) Tous deux sont des gaz toxiques mais l’un est beaucoup plus dangereux que l’autre. Préciser lequel et dire pourquoi il est si dangereux.
CO est beaucoup plus toxique que CO2, il se fixe en effet préférentiellement au dioxygène sur l'hémoglobine du sang. L'asphyxie est alors très rapide et souvent mortelle.
2) Synthèse :
Ces deux gaz peuvent être obtenus par combustion du carbone dans l’air ou dans le dioxygène.
-2a) Ecrire les réactions correspondantes.
C(s) + O2 (g) = CO2 (g)
C(s) + 1/2 O2 (g) = CO (g)
-2b) Dans la pratique seul l’un des deux est étudié en classe. Lequel ?
Décrivez le protocole expérimental de sa synthèse en classe.
Vous préciserez le matèriel utilisé et vous décrirez sommairement l’expèrience que pourrait réaliser les élèves.
Seul CO2 est étudiè au collège.
Sa synthèse peut être facilement réalisée par combustion du graphite ou du charbon de bois dans l'air et/ou dans le dioxygène. Un flacon est préalablement rempli de dioxygène par déplacement d'eau. Le flacon est bouché, on laisse un peu d'eau au fond du flacon. On enflamme un morceau de graphite au bec bunsen puis on l'introduit dans le flacon. Le graphite brûle beaucoup plus vivement qu'a l'air libre. On peut éventuellement boucher le flacon avec la paume de la main et l'agiter fortement, CO2 étant très soluble dans l'eau il va y avoir diminution du volume gazeux ce qui va se traduire par un effet d'aspiration et de succion. On peut ensuite si on le désire caractériser le CO2 dissous par le pH acide de la solution et/ou le test à l'eau de chaux.
2c) Ce gaz peut être caractérisé par un test très simple. Lequel ? Vous décrirez l’expèrience correspondante et vous écrirez les diverses réactions permettant sa caractérisation.
Test à l'eau de chaux :
On dissous de l'oxyde de calcium CaO dans de l'eau distillée. On filtre le CaO qui ne s'est pas dissous car sa solubilité est très faible. Le filtrat est l'eau de chaux. On fait barboter CO2 dans le filtrat, on observe un trouble blanc. Il se forme du carbonate de calcium CaCO3 très peu soluble.
CaO + H2O = Ca2+ + 2 OH-
CO2 + 2 OH- = CO32- + H2O
CO32- + Ca2+ = CaCO3 (s)
2d) L’autre est souvent synthétisé involontairement et est cause de nombreux décès accidentels. Vous préciserez dans quelles circonstances il est ainsi produit accidentellement et vous préciserez les précautions à prendre pour limiter les risques encourus.
La combustion incomplète du carbone conduit à la formation de monoxyde de carbonne. Les chauffages a bois ou a charbon mal réglés, les cheminées mal entretenues etc sont causes de nombreux accidents. Les appareils de chauffage doivent être vérifiés en particulier quand à leur tirage, une bonne aération est indispensable pour éviter ces problèmes.
3) Chimie théorique - Atomistique :
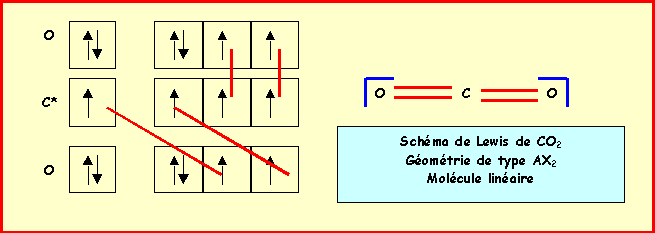
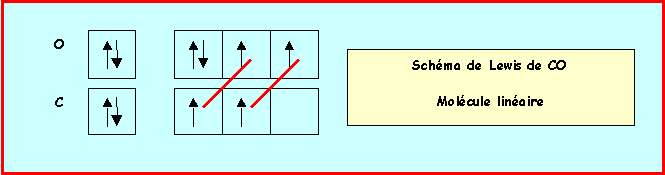
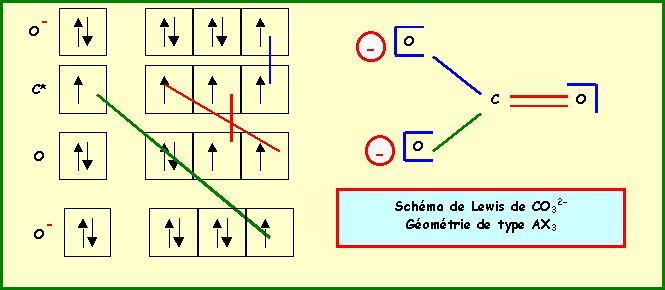
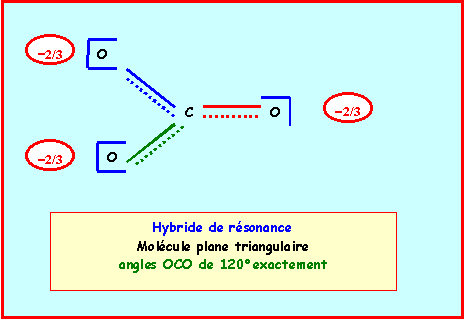
3a) Donner en justifiant votre réponse les schémas de Lewis de ces deux molècules et leur géomètrie. Indiquez de même structure de Lewis et géomètrie de l’ion Carbonate.

4) Dioxyde de Carbone en solution aqueuse :
Le dioxyde de carbone est soluble dans l’eau. La solution obtenue est acide.
4a) Sachant qu’il s’agit d’un diacide faible écrire les réactions qui se produisent lors de sa dissolution.
4b) Donner l’expression des constantes d’équilibre correspondantes.
Montrer comment on peut calculer le pH d’une solution aqueuse de ce gaz si ces constantes sont connues.
CO2 + 2 H2O = HCO3- + H3O+ : K1 = [HCO3-] [H3O+] / [CO2]
HCO3- + H2O = CO32- + H3O+ : K2 = [H3O+] [CO32-] / [HCO3-]
Le problème fait intervenir 5 inconnues : [H3O+] ; [OH-] ; [CO32-] ; [HCO3-] ; [CO2]
Il faut donc trouver 5 relations indépendantes entre ces 5 inconnues :
(1) K1 = [HCO3-] [H3O+] / [CO2]
(2) K2 = [H3O+] [CO32-] / [HCO3-]
(3) Ke = [H3O+] [OH-]
(4) Conservation de la matière : [CO32-] + [HCO3-] + [CO2] = C
(5) Electroneutralité : 2 [CO32-] + [HCO3-] + [OH-] = [H3O+]
Résolution exacte :
Première méthode :
(2) K2 = [H3O+] [CO32-] / [HCO3-] è [HCO3-] = [H3O+] [CO32-] / K2
[CO2]= [CO32-] [H3O+]2 / (K2 K1)
(4) [CO32-] + [HCO3-] + [CO2] = C
[CO32-] + [H3O+] [CO32-] / K2 + [CO32-] [H3O+]2 / (K2 K1) = C
[CO32-] { 1+ [H3O+] / K2 + [H3O+]2 / (K2 K1) } = C
[CO32-] { 1+ [H3O+] / K2 + [H3O+]2 / (K2 K1) } = C / { 1 + [H3O+] / K2 + [H3O+]2 / (K2 K1) }
Posons [H3O+] = h
[CO32-] = C / { 1 + (h / K2) + (h2 / (K2 K1) ) }
Posons L = { 1 + (h / K2) + (h2 / (K2 K1) ) }
[CO32-] = C / L
[HCO3-] = [H3O+] [CO32-] / K2 = h C / (K2 L)
[CO2]= [HCO3-] [H3O+] / K1 = h2 C / (K1 K2 L)
(5) Electroneutralité : 2 [CO32-] + [HCO3-] + [OH-] = [H3O+]
2 C/L + h C / (K2L) + h2 C / (K2K1L) + Ke/h = h
C / L [ 2 + h / K2+ h2 / (K2K1) ] + Ke/h = h
Posons (1/L) [ 2 + h / K2+ h2 / (K2K1) ] = M
C M + Ke/h = h
h C M + Ke = h2
Q = h2 - h C M - Ke = 0
La résolution de cette équation conduira à la valeur de h et donc du pH.
Une méthode simple consiste a se fixer une valeur arbitraire pour pH puis à calculer les valeurs de L, M et Q correspondantes. Il suffira de trouver deux valeurs de pH qui donne un signe différent à Q, on saura alors que le pH exact est compris entre ces deux valeurs. On pourra ainsi calculer le pH avec le degré de précision que l'on choisira, généralement à 0,1 unité près.
L'intéret de cette méthode est que la formule obtenue Q = h2 - h C M - Ke = 0 est tout à fait générale et pourra s'écrire dans n'importe quel cas, seules les expressions de L et M changent selon l'espèce étudiée mais des règles simples permettent de les retenir facilement. Dans le cas de mélanges complexes la formule devient simplement Q = h2 - h S Ci Mi - Ke = 0, il suffit de sommer sur toutes les espèces présentes en solution.
Deuxième méthode :
Pour un diacide faible AH2 (ici CO2)
Les expressions de K1 et K2 permettent d'écrire les expressions classiques:
pH = pK1 + log { [AH-] / [AH2] } = pK1 + log R1
pH = pK2 + log { [A2-] /[AH-] } = pK2 + log R2
Soit R1 = 10(pH-pK1) et R2= 10(pH-pK2)
R1 = [AH-] / [AH2] et R2 = [A2-] /[AH-]
On peut alors facilement établir grace à la conservation de la matière :
C = [AH2] + [AH-] + [A2-]
C = [AH2] + R1 [AH2] + R1 R2 [AH2]
[AH2] = C / (1 + R1 + R1R2)
[AH-] = R1C / (1 + R1 + R1R2)
[A2-] = R1R2C / (1 + R1 + R1R2)
Pour un pH donné et C donné on peut facilement calculer ces expressions.
Il suffit alors de remplacer dans l'équation d'électroneutralité.
Electroneutralité : 2 [CO32-] + [HCO3-] + [OH-] = [H3O+]
Q = 2 [CO32-] + [HCO3-] + [OH-] - [H3O+] = 0
La résolution de cette équation conduira à la valeur de h et donc du pH.
Une méthode simple consiste a se fixer une valeur arbitraire pour pH puis à calculer les valeurs de Q correspondante. Il suffira de trouver deux valeurs de pH qui donne un signe différent à Q, on saura alors que le pH exact est compris entre ces deux valeurs. On pourra ainsi calculer le pH avec le degré de précision que l'on choisira, généralement à 0,1 unité près.
Résolution approchée :
L'approximation généralement faite dans ce type de problème consiste à négliger la deuxième acidité par rapport à la première. On considère alors le diacide faible comme un monoacide faible. La deuxième acidité étant négligée on considère que l'espèce A2- est totalement absente de la solution.
AH = A- + H3O+
K1 = [A-] [H3O+] / [AH]
E.N : [A-] + [OH-] = [H3O+]
C.M : [A-] + [AH] = C
On suppose que la solution est suffisamment acide pour pouvoir négliger la présence d'ion hydroxyde OH-.
E.N : [A-] + [OH-] = [H3O+] è [A-] = [H3O+]
K1 = [A-] [H3O+] / [AH] è K1 = [H3O+]2 / [AH]
On remplace [AH] par C - [A-] = C - [H3O+]
K1 = [H3O+]2 / (C - [H3O+] )
K1 = h2 / (C - h )
K1 (C - h ) = h2
K1 C - K1 h = h2
h2 + K1 h - K1 C = 0
D = K12 + 4 K1 C
h = 1/2 [ - K1 + Ö { K12 + 4 K1 C } ]
Si de plus on considère que la première acidité est suffisamment faible pour que l'on puisse négliger [A- ] devant [AH] l'acide étant très peu dissocié.
On obtient simplement la formule classique :
K1 = [H3O+]2 / [AH] = h2 / C
h2 = K1 C
pH = 1/2 { pK1 - log C}
5) Dioxyde de carbone dans l’atmosphère :
L’air qui nous entoure contient naturellement du dioxyde de carbone.
5a) Citer les principales causes naturelles de sa production et donc se sa présence dans l’atmosphère.
La principale source de CO2 est la combustion du carbone.
Respiration des animaux - Feux divers - Volcanisme
5b) Sa teneur à longtemps été considérée comme constante. Une méthode de datation est d’ailleurs basée sur cette hypothèse. Décrivez simplement cette technique.
Datation au carbone 14 : Le carbone 14 est un isotope radioactif du carbone. Sa décroissance naturelle suit une loi cinétique du premier ordre du type :
ln C = - k t + ln C0
k est la constante de vitesse de la transformation radioactive.
On utilise plus couramment le temps de demi-vie t1/2 ou période radioactive, c'est le temps qu'il faut pour que la teneur en radioélément soit divisée par deux :
soit C = C0/2
ln (C /C0) = - k t
ln (1/2) = - k t
t 1/2 = ln 2 / k
Le temps de demi-vie du carbone 14 est d'environ 5600 ans.
Au cours de leur vie les organismes vivants ingèrent sans arrêt par leur métabolisme du carbone 14 et il s'établit un équilibre entre leur organisme et l'atmosphère ou l'océan. Le taux de carbone 14 d'un organisme vivant est donc constant si on suppose que sa teneur dans l'environnement l'est aussi. A la mort de l'organisme son métabolisme s'arrête et le carbone 14 n'est plus renouvélé. On peut donc calculer le temps écoulé depuis la mort de l'organisme en comparant son taux de carbone 14 avec celui d'un organisme vivant, c'est le principe de la datation au carbone 14. Cette méthode fonctionne très correctement pour des périodes s'étendant à environ 50000 à 60000 ans en arrière.
5c) Cette teneur est-elle toujours constante aujourd’hui ? Pourquoi ? Quelle conséquences possibles cela pourrait-il entraîner dans l’avenir ?
La combustion des hydrocarbures fossiles due aux activités industrielles et tout particulièrement à l'automobile est la source artificielle principale de production de CO2. Depuis la révolution industrielle le taux de CO2 à très fortement augmenté dans l'atmosphère et continuera de le faire si aucune mesures ne sont prises. D'autre part, la destruction des forêts tropicales par l'homme produit du CO2 par combustion mais diminue également sa fixation par photosynthèse. La principale conséquence de cette teneur élevée est la modification du climat qui en résulte. CO2 est des principaux gaz à effet de serre. Si sa teneur augmente la température moyenne de la terre va augmenter elle aussi, on craint des modifications profondes du climat dont les effets commencent déjà à se faire sentir. La principale conséquence possible est la fonte des glaces continentales qui pourront entrainer une montée non négligeable du niveau des mers.
Le réchauffement est du au fait que CO2 est transparent à la lumière visible mais absorbe le rayonnement infra-rouge. Durant le jour la terre reçoit de l'énergie du Soleil sous forme de lumière visible, une partie de cette énergie est restituée à l'espace durant la nuit sous forme de rayonnement thermique infra-rouge, le CO2 atmosphérique bloque en quelque sorte ce rayonnement nocturne et la chaleur n'est donc plus évacuée.
6) Conséquences pratiques
6a) L’eau distillée n’ a généralement pas un pH neutre. Pourquoi ?
Le pH de l'eau distillée est généralement acide a cause de la dissolution du CO2 atmosphérique.
6b) Les solutions de soude ne se conservent pas très bien et à la longue on observe la précipitation d’un solide blanc au fond des flacons qui les contiennent. Quel est ce solide ? Ecrire les réactions qui le produisent.
2 OH- + CO2 = CO32-
Il se forme du carbonate de sodium Na2CO3.
Exercice 2 : Titrage pH-mètrique du carbonate de sodium
On titre par pH-métrie 20 ml d’une solution de carbonate de sodium par l’acide chlorhydrique 0,1 M.
2a) Donner l’expression théorique permettant le calcul du pH en fonction du volume d’acide versé pour les différents domaines de la courbe de titrage.
On va faire l'hypothèse simplificatrice de considérer les deux basicités suffisamment différentes pour qu'elles soient dosées successivement et séparément.
On va de plus supposer les deux réactions de neutralisation successives comme pouvant être considérées comme totales.
On est en présence d'une dibase faible, on peut supposer que la deuxième basicité est négligeable par rapport à la première. On considère alors simplement avoir affaire à une solution de monobase faible.
La formule classique est pH = 7 + 1/2 pK2 + 1/2 log C
* Pour 0 < Va < Ve1
La réaction prépondérante considérée comme totale est :
A2- + H3O+ è AH- + H2O
A2- (excès) |
H3O+ (défaut) |
AH- |
|
Etat initial |
Cb Vb |
Ca Va |
0 |
Etat final |
Cb Vb - CaVa |
0 |
CaVa |
pH = pK2 + log { [A2-] / [AH-] }
pH = pK2 + log { (CbVb - CaVa) / CaVa }
Le volume se simplifie et on peut donc ne pas le faire figurer.
* Pour Ve1< Va < Ve2
La réaction prépondérante considérée comme totale est :
AH- + H3O+ è AH2 + H2O
AH- (excès) |
H3O+ (défaut) |
AH2 |
|
Etat initial |
CbVb |
CaVa* |
0 |
Etat final |
CbVb - CaVa* |
0 |
CaVa* |
pH = pK1 + log { [AH-] / [AH2] }
pH = pK1 + log { (CbVb - CaVa*) / CaVa* }
Le volume se simplifie et on peut donc ne pas le faire figurer.
Va* = Va - Ve1 il faut tenir compte du volume de HCl ayant servi a neutraliser la première basicité.
* Pour 0 < Va < Ve1
La réaction prépondérante considérée comme totale est :
A2- + H3O+ è AH- + H2O
A2- (excès) |
H3O+ (défaut) |
AH- |
|
Etat initial |
Cb Vb |
Ca Va |
0 |
Etat final |
Cb Vb - CaVa |
0 |
CaVa |
pH = pK2 + log { [A2-] / [AH-] }
pH = pK2 + log { (CbVb - CaVa) / CaVa }
Le volume se simplifie et on peut donc ne pas le faire figurer.
* Pour Va > Ve2
La réaction prépondérante considérée comme totale est :
AH- + H3O+ è AH2 + H2O
AH- (défaut) |
H3O+ (excès) |
AH2 |
|
Etat initial |
CbVb |
CaVa* |
0 |
Etat final |
0 |
CaVa* - CbVb |
CaVa* |
pH = - log { (CaVa* - CbVb) / (Va + Vb) }
Le volume se simplifie et on peut donc ne pas le faire figurer.
Va* = Va - Ve1 il faut tenir compte du volume de HCl ayant servi a neutraliser la première basicité.
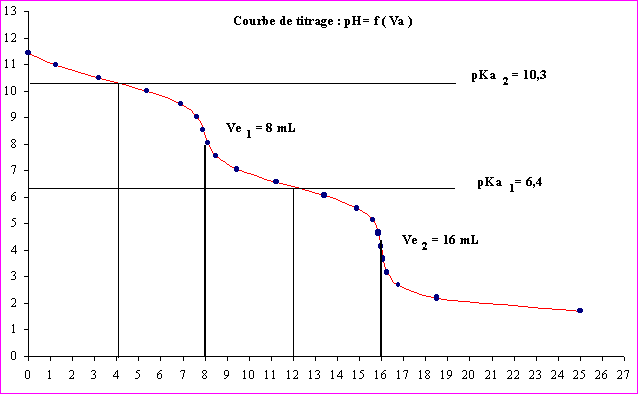
2b) A partir de la courbe expérimentale déterminer :
- la concentration de la solution.
Ca Ve1 = Cb Vb
Cb = 0,1 * 8 / 20 = 0,04 mol.L-1
- les pKa du carbonate de sodium.
On lit graphiquement une valeur approximative des pKa en se plaçant aux demi neutralisations.