CAPLP2 MATH-SCIENCES - CORRIGE DU SUJET de 2002
PARTIE A - LE PHOSPHORE ET SES DERIVES
I- L'élément
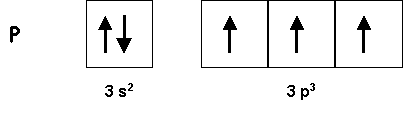
I-1 : Donner la structure de l'atome de phosphore dans son état fondamental.
Z = 15 : 1s2 2s2 2p6 3s2 3p3
I-2 : Nommer les deux éléments appartenant à la même colonne de la classification périodique que le phosphore et encadrant celui-ci.
H |
He |
||||||
Li |
Be |
B |
C |
N |
O |
F |
Ne |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
K |
Ca |
Ga |
Ge |
As |
Se |
Br |
Kr |
N = Azote - As = Arsenic
I-3 : Parmi les 17 isotopes connus, l'isotope 31P est stable et l'isotope 32P est utilisé comme traceur en biologie. Préciser la composition détaillée de chacun de ces nucléïdes.
31P le noyau est "composé" de Z = 15 protons et N = 31 -15 = 16 neutrons.
32P le noyau est "composé" de Z = 15 protons et N = 32 -15 = 17 neutrons.
1-4 : Le phosphore peut présenter divers degrés d'oxydation. Entre quelles valeurs extrêmes le degré d'oxydation de cet élément peut-il varier ? Donner la formule d'un exemple de composés binaires illustrant chacune de ces valeurs.

Le phosphore peut "gagner" 3 électrons supplémentaires et compléter ainsi sa couche de valence à 8 électrons, ce qui correspond au degré d'oxydation P(-III).
P(-III) : P3- (anion phosphure) - PH3 (phosphine)
Remarque : En réalité P est légèrement moins électronégatif que H et on devrait considérer PH3 comme représentant du degré +III mais l'usage veut qu'on l'assimile tout de même au degré -III comme NH3.
Le phosphore peut "perdre" ses 5 électrons de valence, ce qui correspond au degré d'oxydation P(+V).
P(+V). : PO43- (ion phosphate) - PCl5 (pentachlorure de phosphore)
II - Les corps simples :
II-1 : A l'état solide, le phosphore peut exister sous deux formes allotropiques : le phosphore blanc et le phosphore rouge. Quelle est la variété thermodynamiquement la plus stable à la température ordinaire ? Justifier. Indiquer une utilisation usuelle de celle-ci.
P(blanc) = P(rouge)
DRH0 = DfH0 P(rouge) - DfH0 P(blanc)
DRH0 = -17600 J.mol-1
DRS0 = S0 P(rouge) - S0 P(blanc)
DRS0 = 22,8 - 41,1 = -18,3 J.mol-1.K-1
DRG0 = DRH0 - T DRS0
DRG0298 = -17600 - ( 298 * -18,3 ) =-12146,6 J.mol-1
DRG0298 < 0 : Dans les conditions standards, la transformation du phosphore blanc en phosphore rouge est thermodynamiquement favorisée. Le phosphore rouge est donc la variété thermodynamiquement la plus stable à 298 K.
Dans la vie courante le phosphore rouge est utilisé comme agent d'amorçage dans les grattoirs des boites d'allumettes. Le bout rouge de l'allumette contient du soufre et des colles comme combustible et du chlorate de potassium comme comburant.
Remarque : Bien que le phosphore rouge soit le plus stable c'est tout de même le phosphore blanc sous sa forme P4 qui à été choisi comme état standard de l'élément phosphore. C'est pourquoi son enthalpie standard de formation est posée comme nulle. Cela est une exception à la règle générale qui veut que l'état standard corresponde à l'état le plus stable.
II-2 : Par chauffage le phosphore rouge se sublime en phosphore blanc sous la forme de molécules P4. Proposer une structure géométrique pour cette molécule, compatible avec l'équivalence des quatre atomes de phosphore. La schématiser en précisant la valeur des angles de liaison.
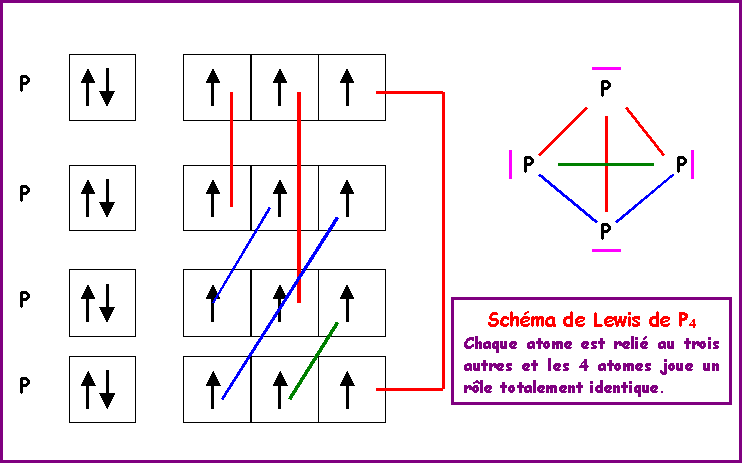
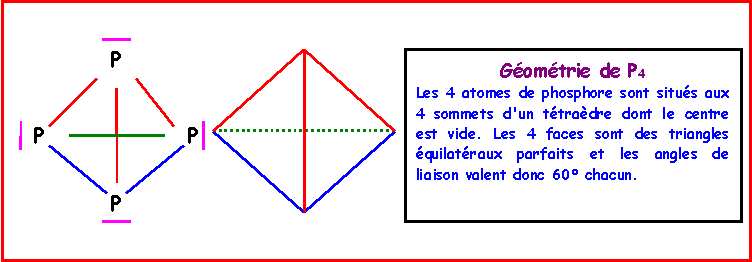
III- Les chlorures de phosphore :
III-1 : Le trichlorure de phosphore PCl3 et le pentachlorure de phosphore PCl5 sont des agents de chloruration (encore appelés agents de "chloration") très utilisés en chimie organique.
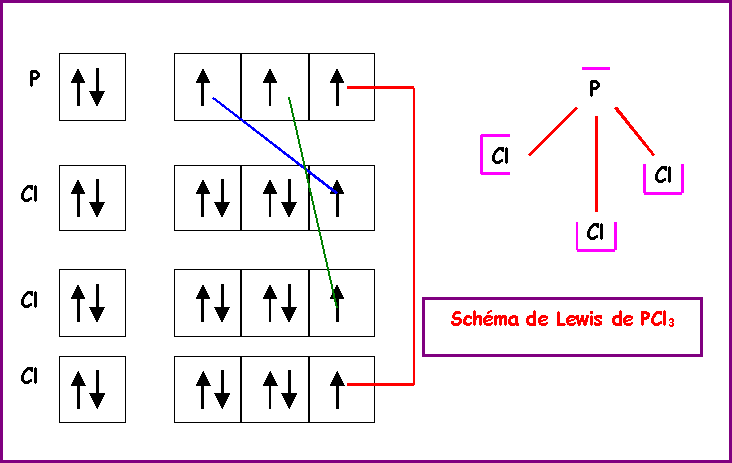

Par excitation et utilisation de son niveau 3 d l'atome de phosphore peut atteindre la valence 5.
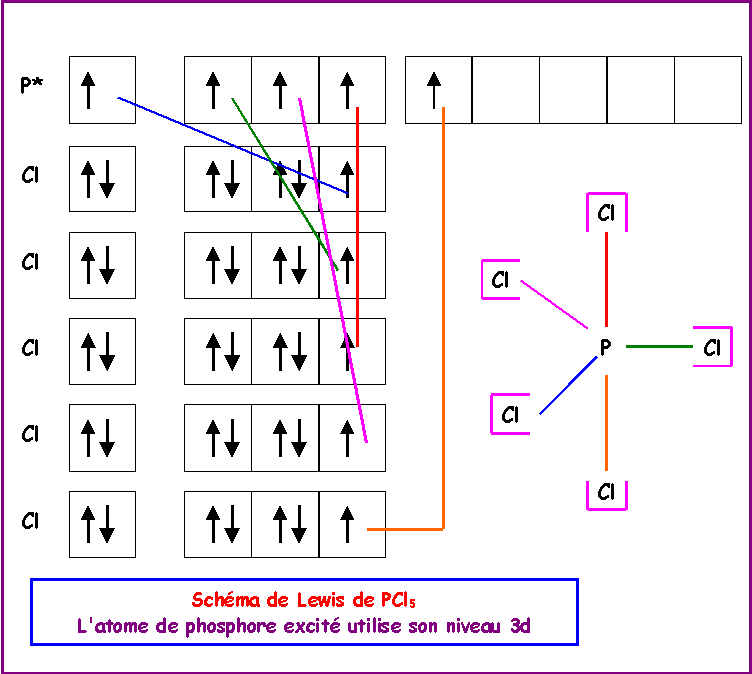

III-2 : Par chauffage, le pentachlorure de phosphore se dissocie par l'équilibre :
PCl5 (g) = PCl3 (g) + Cl2(g)
A 230°C et sous une pression p1 = 1,0 bar, la densité d du mélange gazeux par rapport à l'air vaut 4,62.
Le rapport des masses volumiques de deux gaz est donc égal au rapport des masses molaires des deux gaz. La densité d'un gaz par rapport à l'air étant le rapport entre la masse volumique du gaz et celle de l'air elle est donc égale à la masse molaire du gaz divisée par la masse molaire de l'air.
L'air étant composé approximativement de 20% de O2, 80% de N2 sa masse molaire est de M = 0,2*32+0.78*28 = 28,8 g.mol-1 qu'on arrondit usuellement à 29 g.mol-1.
Soit finalement la relation classique entre la densité d'un gaz et sa masse molaire :
d = M / 29
On peut donc déterminer la masse molaire du mélange : M = 29 * 4,62 = 134 g.mol-1
PCl5 (g) = PCl3 (g) + Cl2(g)
PCl5 |
PCl3 |
Cl2 |
||
Etat initial |
a |
0 |
0 |
a |
Etat final |
a-n |
n |
n |
a+n |
Soit pour les fractions molaires :
x1 = xPCl5 = ( a - n) / (a + n)
x2 = xPCl3 = n / ( a + n )
x3 = xCl2 = n / ( a + n )
On a donc x2 = x3
De plus : x1 + x2 + x3 = 1
et M = x1 M1 + x2 M2 + x3 M3
Soit à résoudre :
x1 + 2 x2 = 1
134 = 208,5 x1 + 137,5 x2 + 71 x2 = 208,5 x1 + 208,5 x2 = 208,5 (x1 + x2)
134 = 208,5 (1 - x3 )
134 = 208,5 - 208,5 x3
208,5 x3 = 208,5 - 134 = 74,5
x3 = 0,357
xPCl3 = x2 = 0,357
xPCl5 = x1 = 0,286
xCl2 = x3 = 0,357
par définition le coefficient de dissociation est le rapport entre le nombre de mole ayant disparu sur le nombre de mole qui aurait disparu si la réaction était totale.
Ici : a = n / a soit n = a a
x1 = xPCl5 = ( a - n) / (a + n)
x1 = xPCl5 = ( a - aa) / (a + aa) = (1 - a ) / (1 + a)
(1 - a ) / (1 + a) = 0,286
1 - a = 0,286 (1 + a)
1 - a = 0,286 + 0,286 a
0,714 = 1,286 a
a = 0,714 / 1,286 = 0,555
a1 = 0,555
K0 = P Pi ni (car P0 = 1 bar)
Ici : K0 = PPCl3 PPCl2 / PPCl5
PPCl3 = xPCl3 P = xPCl3 = 0,357 (P = p1 = 1 bar)
PCl2 = xCl2 P = xCl2 = 0,357
PPCl5 = xPCl5 P = xPCl5= 0,286
Soit K0 = 0,3572 / 0,286 = 0,4456
En chimie organique pour réaliser une chloruration à partir de PCl5 on procède plutôt sous basse pression. Expliquer pourquoi.
Première explication "qualitative" :
Principe de Le Chatelier : L'équilibre cherche à s'opposer aux contraintes qu'on veut lui imposer (loi de modération).
Ici, si on fait diminuer la pression l'équilibre va chercher à la faire augmenter et pour cela va se déplacer dans le sens d'augmentation du nombre de mole gazeuses, c'est à dire dans le sens de dissociation de PCl5. On peut donc espérer que la dissociation de PCl5 augmentant, la réaction de chloruration conduira à de meilleurs rendements à faible pression.
Deuxième explication à partir de l'expression de K0
K0 = P Pi ni = P (xi P) ni = P xi ni P P ni = PSni Pxini
Ici Svi = 2 -1 = 1
K0 = P [ xPCl3 xCl2 / xPCl5 ]
Si on fait diminuer P, [ xPCl3 xCl2 / xPCl5 ] doit augmenter pour que K0 (qui ne dépend que de T) reste constant. Les fractions molaires des produits doivent donc augmenter et celle de PCl5 diminuer ce qui correspond bien à une dissociation accrue de celui-ci.
Remarque : Cette question peut paraître un peu artificielle car le pentachlorure de phosphore n'est pas couramment utilisé à l'état gazeux. Il s'agit d'un solide ionique de formule réelle ( PCl4+; PCl6- ). L'agent chlorurant n'étant pas Cl2 il n'est pas nécessaire de dissocier PCl5 pour obtenir la réaction. En revanche PBr5 se dissocie bien en PBr3 et Br2 et dans ce cas Br2 est bien l'agent bromant.
Calculer le degré de dissociation à la température de 230°C, sous une pression totale p2 = 0,5 bar.
La température étant identique K0 garde la même valeur.
n = a a
a - n = a - a a = a (1 - a )
a + n = a ( 1 + a )
PCl5 |
PCl3 |
Cl2 |
||
Etat initial |
a |
0 |
0 |
a |
Etat final |
a-n |
n |
n |
a+n |
a ( 1 - a ) |
a a |
a a |
a ( 1 + a ) |
PPCl5 = P a ( 1 - a ) / a ( 1 + a ) = P ( 1 - a ) / ( 1 + a )
PPCl3 = P a a / a ( 1 + a ) = P a / ( 1 + a )
PPCl2 = P a a / a ( 1 + a ) = P a / ( 1 + a )
K0 = PPCl3 PPCl2 / PPCl5
K0 = P2 a2 / ( 1 + a )2 * ( 1 + a ) / P ( 1 - a )
K0 = P a2 / ( 1 - a ) ( 1 + a ) = P a2 / ( 1 - a2 )
0,4456 = 0,5 a2 / ( 1 - a2 )
0,89125 = a2 / ( 1 - a2 )
0,89125 ( 1 - a2 )= a2
0,89125 - 0,89125 a2 = a2
1,89125 a2 = 0,89125
a2 = 0,89125 / 1,89125 = 0,471
a = 0,686
La diminution de P a bien provoqué une augmentation de a.
Quelle serait la composition volumique du mélange obtenu à l'équilibre sous une pression de 1,0 bar et à 230°C par chauffage d'un mélange initial contenant 0,3 mole de PCl5 et 0,3 mole de PCl3 ? Interpréter qualitativement le résultat obtenu.
PCl5 |
PCl3 |
Cl2 |
||
Etat initial |
0,3 |
0,3 |
0 |
0,6 |
Etat final |
0,3 - n |
0,3 + n |
n |
0,6+n |
PPCl5 = P ( 0,3 - n ) / ( 0,6 + n ) = ( 0,3 - n ) / (0,6 + n )
PPCl3 = P ( 0,3 + n ) / ( 0,6 + n ) = ( 0,3 + n ) / (0,6 + n )
PPCl2 = P n / (0,6 + n ) = n / (0,6 + n )
K0 = PPCl3 PPCl2 / PPCl5
K0 = ( 0,3 + n ) / (0,6 + n ) * n / (0,6 + n ) * (0,6 + n ) / ( 0,3 - n )
K0 = 0,239 = n ( 0,3 + n ) / [ ( 0,3 - n ) (0,6 + n ) ]
0,4456 = n ( 0,3 + n ) / [ ( 0,3 - n ) (0,6 + n ) ]
Après résolution on trouve : n = 0,129 mole
Composition molaire
nPCl5 = 0,3 - 0,129 = 0,171 mole
nPCl3 = 0,3 + 0,129 = 0,429 mole
nCl2 = 0,129 mole
ntotal = 0,6 + 0,129 = 0,729
Fractions molaires
xPCl5 = 0,171/ 0,729 = 0,235
xPCl3 = 0,429 / 0,729 = 0,588
xCl2 = 0,129 / 0,729 = 0,177
Composition volumique :
PCl5 23,5 % - PCl3 58,8 % - Cl2 17,7 %
On peut calculer le coefficient de dissociation de PCl5 : a = 0,129 / 0,3 = 0,43.
On avait a = 0,55 dans les même conditions mais avec PCl5 seul.
On remarque donc que l'ajout de PCl3 a fait diminuer la dissociation de PCl5.
Cela est aussi en accord avec le principe de Le Chatelier.
e)
PCl5 |
PCl3 |
Cl2 |
|
DfH0 (kJ.mol-1) |
-375 |
-287 |
0 |
S0 (J.mol-1.K-1) |
365 |
312 |
223 |
DRH0298 = S ni DfH0i298
DRH0298 = -287 + 0 - (-375) = 88 kJ.mol-1
DRS0298 = S ni S0i
DRS0298= 312 + 223 - 365= 170 J.mol-1
DRG0T = DRH0T - T DRS0T
Si on suppose DRH0 et DRS0 indépentantes de T :
DRG0 = DRH0 - T DRS0
DRG0 = -RT ln K0
ln K0 = - DRG0 / ( RT ) = - DRH0 / (RT) + DRS0 / R
ln K0 » ( -10590 / T ) + 20,5
Nous avons établi à la question III-2-c
K0 = P a2 / ( 1 - a2 )
K0 = 1 * 0,802 / ( 1 - 0,802 ) = 1,78
Ln K0 = 0,575
T » ( ln K0 - 20,5 ) / - 10590 = 531 K
Une température élevée favorise la dissociation de PCl5.
Première explication "qualitative" :
Principe de Le Chatelier : L'équilibre cherche à s'opposer aux contraintes qu'on veut lui imposer (loi de modération).
Ici, si on fait augmenter la température, l'équilibre va chercher à la faire diminuer et pour cela va se déplacer dans le sens endothermique, c'est à dire dans le sens de dissociation de PCl5.
deuxième explication : A partir de l'expression de Van't hoff
d ln K / d T = DRH0 / R T2
RT2 est positif, d ln K / d T est donc du même signe que DRH0
Pour une réaction endothermique (DRH0 > 0), d ln K / d T > 0, d ln K et d T ont donc même signe, Ln K et K varient donc comme T. Une augmentation de température provoque donc une dissociation plus grande (valeur de K plus élevée).
IV- L'acide phosphorique
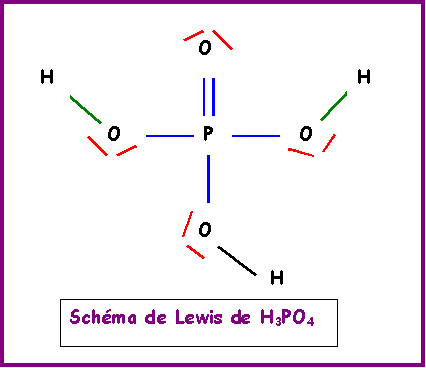
L'acide phosphorique est un triacide de formule H3PO4.
IV-1 : Ecrire sa formule développée
IV-2 : Ecrire les équations des trois réactions mises en jeu lors de la dissolution dans l'eau de l'acide phosphorique.
H3PO4 + H2O = H2PO4- + H3O+
H2PO4- + H2O = HPO42- + H3O+
HPO42- + H2O = PO43- + H3O+
IV-3 : Que peut-on dire de l'ion H2PO4- dans la théorie de bronsted ? Justifier par une définition précise.
L'ion H2PO4- est appelé espèce amphotère (ou ampholyte).
Un ampholyte est une espèce qui joue le rôle d'un acide dans un couple et le rôle d'une base dans un autre.
H3PO4 + H2O = H2PO4- + H3O+ : H2PO4- est une base
H2PO4- + H2O = HPO42- + H3O+ : H2PO4- est un acide
IV-4 : On verse progressivement, dans 20 mL d'une solution d'acide phosphorique de concentration égale à 5,0 10-2 mol.L-1 une solution d'hydroxyde de sodium de concentration égale à 1,0 10-1 mol.L-1. La courbe pH-métrique révèle deux points d'équivalence. Soient Ve1 et Ve2 les volumes de soude correspondants.
a) En comparant les trois fonctions acides de H3PO4 dans l'eau, quelle approximation peut-on faire dans le calcul du pH d'une solution d'acide phosphorique, lorsqu'on se contente d'une précision de l'ordre de 0,1 unité de pH ?
pK1 = 2,1 - pK2 = 7,2 - pK3 = 12,4
Plusieurs approximations sont envisageables :
H3PO4 comme un monoacide faible.
Si on suppose ces trois approximations comme valables ont peut utiliser la formule classique pH = 1/2 ( pKa + pC ) pour calculer le pH d'une solution de H3PO4.
Cela revient en fait à négliger les espèces PO43-, HPO4- et H2PO4- devant H3PO4 dans l'équation de conservation de la matière et à négliger OH-, PO43- et HPO4- devant H3O+ et H2PO4- dans l'équation d'électroneutralité de la solution.
Conservation de la matière :
[H3PO4] + [H2PO4-] + [HPO4-] + [PO43-] = C
[H3PO4] » C
Electroneutralité de la solution :
[H3O+] = [H2PO4-] + [HPO4-] + [PO43-] + [OH-]
K1 = [H2PO4-] [H3O+] / [H3PO4]
K1 » [H3O+]2 / C
[H3O+]2 » K1C
soit finalement pH = 1/2 ( pKa + pC )
Les deux premières approximations sont tout à fait réalistes. La troisième est un peu plus hasardeuse car avec un pKa de 2,1 H3PO4 est un acide moyen.
En solution diluée il se dissocie suffisamment pour que l'on ne puisse plus négliger [H2PO4-] devant [H3PO4] dans l'équation de conservation de la matière.
Conservation de la matière :
[H3PO4] + [H2PO4-] + [HPO4-] + [PO43-] = C
[H3PO4]] = C - [H2PO4-] = C - [H3O+]
K1 = [H2PO4-] [H3O+] / [H3PO4]
K1 = [H3O+]2 / ( C - [H3O+] )
On doit alors résoudre une équation du second degré pour calculer [H3O+].
[H3O+]2 + K1 [H3O+] - K1 C = 0
h2 + K1 h - K1 C = 0
D = K12 + 4 K1 C
h = 1/2 { -K1 + Ö [K12 + 4 K1 C ] }
La résolution exacte du problème (par la méthode de Briere par exemple - B.U.P Fevrier 2002) montre que la formule approchée pH = 1/2 ( pKa + pC ) donne un résultat correct à 0,1 unité de pH près tant que C > 4 10-3 mol.L-1. La résolution de l'équation du second degré donne un résultat correct à 0,1 unité de pH près jusqu'à des concentrations de l'ordre de 10-6 mol.L-1.
Cette méthode de résolution exacte est basée sur l'équation :
Q = h2 - h S Ci Mi - Ke = 0
Cette relation est toujours vérifiée quel que soit le mélange étudié.
Ici on aura :
L = 1 + h/K3 + h2/K3K2 + h3/K3K2K1
M = 1/L (3 + 2 h/K3 + h2/K3K2)
Il suffit de fixer une valeur au pH et calculer la valeur de Q correspondante, si on trouve deux valeurs de pH conduisant à une valeur de Q positive et l'autre à une valeur négative, on sait que le pH vrai est compris entre ces deux valeurs. On pourra donc facilement déterminer le pH avec la précision choisie.
Nous utiliserons cette méthode pour le calcul exact du pH dans la suite du problème.
H3PO4 + OH- = H2PO4- + H2O KR = [H2PO4- ] / [H3PO4] / [OH-] = Ka1 / Ke = 1011,9
H2PO4- + OH- = HPO42- + H2O KR = [HPO42- ] / [H2PO4-] / [OH-] = Ka2 / Ke = 106,8
HPO42- + OH- = PO43- + H2O KR = [PO43- ] / [HPO42-] / [OH-] = Ka3 / Ke = 101,6
Une approximation classique consiste a considérer que deux réactions sont successives si l'écart entre les pKR est supérieur à 4 unités. C'est bien le cas ici car les pKa successifs sont suffisamment différents.
pK2 - pK1 = 5,1 > 4
pK3 - pK2= 5,2 > 4
On peut "démontrer" cette règle de la façon suivante :
Pour simplifier considérons un diacide AH2
AH2 + OH- = AH- + H2O
AH- + OH- = A2- + H2O
Supposons le titrage correct et les deux acidités dosées séparément si la première acidité est titrée à 99% tandis que la seconde ne l'est qu'à seulement 1%.
[AH2] = 0,01 C0
[AH-] = 0,99 * 0,99 C0
[A2-] = 0,99 * 0,01 C0
Ces concentrations sont reliées par les Ka successifs du diacide :
K1 = [AH-] [H3O+] / [AH2]
K2 = [A2-] [H3O+] / [AH-]
K1 / K2 = [AH-]2 / { [A2-] * [AH2] }
Soit après calcul : K1 / K2 » 104
Soit DpK = 4
Si les pK sont plus éloignés que 4 unité le titrage séparé est possible et les deux points équivalents seront très nettement différenciés.
Remarque : Dans la pratique, trois unités de pK d'écart peuvent suffire pour les deux points équivalents soient détectables séparément.
c) Déterminer les valeurs de Ve1 et Ve2
H3PO4 : Ca = 0,05 mol.L-1 - Va = 20 mL
NaOH : Cb = 0,1 mol.L-1
La neutralisation de la première fonction acide de H3PO4 correspond à la réaction
H3PO4 + OH- = H2PO4- + H2O
1 mole de H3PO4 réagit avec une mole de OH-
Par définition le point équivalent correspond aux proportions stoéchiométriques, pour un nombre de mole CaVa de H3PO4 il faut donc également CaVa mole de OH-.
Soit à l'équivalence Ca Va = Cb Vbeq
Soit Vbeq = Ca Va / Cb = 0,05 * 20 / 0,1 = 10 mL de soude.
On peut tenir le même raisonement pour la deuxième acidité, ou plus simplement, considérer qu'il faut deux fois plus de soude pour neutraliser les deux acidités.
Ve1 = 10 mL et Ve2 = 20 mL
Remarque : Le troisième point équivalent non détectable sur la courbe de titrage correspond bien entendu à 30 mL de soude
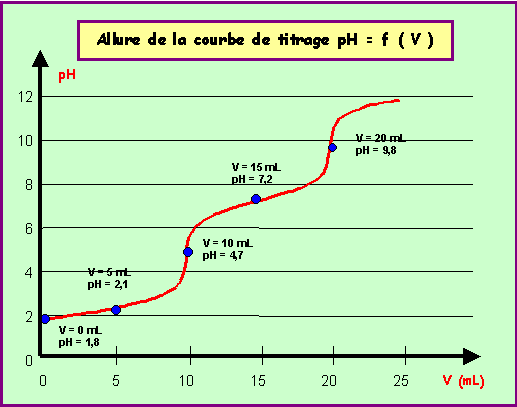
V = 0 mL ; 5 mL ; 10 mL ; 15 mL ; 20 mL
pK1 = 2,1 - pK2 = 7,2 - pK3 = 12,4
H3PO4 : Ca = 0,05 mol.L-1 - Va = 20 mL
NaOH : Cb = 0,1 mol.L-1
Pour la résolution exacte on pourra écrire :
Q = h2 - h S Ci Mi - Ke = 0
Cette relation est toujours vérifiée quel que soit le mélange étudié.
Ici on aura :
Pour H3PO4 :
Lac = 1 + h/K3 + h2/K3K2 + h3/K3K2K1
Mac= 1/L (3 + 2 h/K3 + h2/K3K2)
Pour NaOH : Mbs = -1
Q = h2 - h (Ca Mac + Cb Mbs) - Ke = 0
Il suffit de fixer une valeur au pH et calculer la valeur de Q correspondante, si on trouve deux valeurs de pH conduisant à une valeur de Q positive et l'autre à une valeur négative, on sait que le pH vrai est compris entre ces deux valeurs. On pourra donc facilement déterminer le pH avec la précision choisie.
Soit : pH = 0,5 * ( 2,1 - log 0,05 ) = 1,70
On peut aussi résoudre l'équation du second degré, on trouve alors pH = 1,79
A 0,1 unitée de pH près on prendra pH = 1,8 puisque l'équation du second degré est une approximation plus fine que la première.
Remarque : Le pH "exact" est en fait pH = 1,786 situé entre les deux valeurs approchées. La deuxième approximation est bien meilleure que la première.
Remarque : en raison de la force relativement importante de la première acidité cette approximation est risquée. Le pH "exact" est en fait de 2,32 et l'approximation n'est donc pas correcte. L'énoncé précisant qu'il faut utiliser une formule simplifiée non démontrée on peut penser que cette réponse incorrecte sera néanmoins acceptée par le jury.
A à 0,1 unité de pH près on prendra indifféremment pH = 4,6 ou pH = 4,7
Remarque : Le pH exact est en fait pH = 4,69. Approximation correcte.
Remarque : Le pH "exact" est en fait pH = 7,20 à 0,0001 unité près. Approximation excellente.
Remarque : Le pH "exact" est en fait de 9,65 et l'approximation n'est donc pas correcte. L'énoncé précisant qu'il faut utiliser une formule simplifiée non démontrée on peut penser que cette réponse incorrecte sera néanmoins acceptée par le jury.
V ( mL ) |
0 |
5 |
10 |
15 |
20 |
pH approximé |
1,8 |
2,1 |
4,6 ou 4,7 |
7,2 |
9,8 |
pH "exact" |
1,79 |
2,32 |
4,69 |
7,20 |
9,65 |
f) Lors du dosage de l'acide phosphorique présent dans le coca-cola, on constate souvent que le volume Ve2 de soude versée à la seconde équivalence est supérieur à la valeur théorique. Proposer une explication.
L'explication est de dire que le coca-cola à été mal dégazé et que le CO2 restant perturbe le titrage.
En effet les pKa de CO2 sont : pK1 = 6,4 et pK2 = 10,3
Le pK1 de CO2 étant très proche du pK2 de H3PO4 les deux acidités sont titrées simultanément ce qui modifie la valeur de Ve2 en l'augmentant.