Les alcalino-terreux
CORRIGE
Données :
masse du proton : mp = 1,00727 u.m.a
masse du neutron : mn=1,00866 u.m.a
1 Faraday = 96500 C
On connaît actuellement 6 éléments appartenant à cette famille qui sont (classés par ordre croissant de leur numéro atomique) : Béryllium – Magnésium - Calcium – Strontium – Baryum et Radium.
1) Quelle colonne de la classification périodique occupe la famille des alcalino-terreux ?
Colonne 2
2) Donnez à chacun son numéro atomique et sa configuration électronique.
Z |
Configuration électronique | ||
| Béryllium | Be |
4 |
1s2 2s2 = (He) 2s2 |
| Magnésium | Mg |
12 |
(He) 2s2 2p6 3 s2 = (Ne) 3s2 |
| Calcium | Ca |
20 |
(Ne) 3s2 3p6 4s2 = (Ar) 4s2 |
| Strontium | Sr |
38 |
(Ar) 3 d10 4s2 4p6 5s2 = (Kr) 5s2 |
| Baryum | Ba |
56 |
(Kr) 4d10 5s2 5p6 6s2 = (Xe) 6s2 |
| Radium | Ra |
88 |
(Xe)4f14 5d10 6s2 6p6 7s2 = (Rn) 7s2 |
3) Un autre élément devrait normalement appartenir à cette famille mais en a été exclu. Lequel et pour quelle raison ?
Hélium He : Z = 2 soit 1s2 2s2 mais il appartient a la famille des gaz rares (chimiquement presque inertes) et est donc placé en colonne 18.
4) Si l’on réussit un jour à obtenir un septième alcalino-terreux quel seront son numéro atomique et sa configuration électronique ?
Z = 120
(Rn) 7s2 5f14 6d10 7p6 8s2
5) Quel type d’ion donnent les alcalino-terreux ?
Ils perdent leurs deux électrons ns2 pour ressembler au gaz rare précédant : X2+
6) Quelles sont les formules des oxydes des alcalino-terreux sachant qu’il s’agit de composés ioniques ?
O prend 2 électrons pour ressembler à Ne soit O2-
M2+ + O2- = MO
7) Ces oxydes sont-ils acides ou basiques ? Justifiez simplement.
Avec 2 électrons seulement sur leur couche de valence, les alcalino-terreux sont tous des métaux et leurs oxydes sont donc basiques.
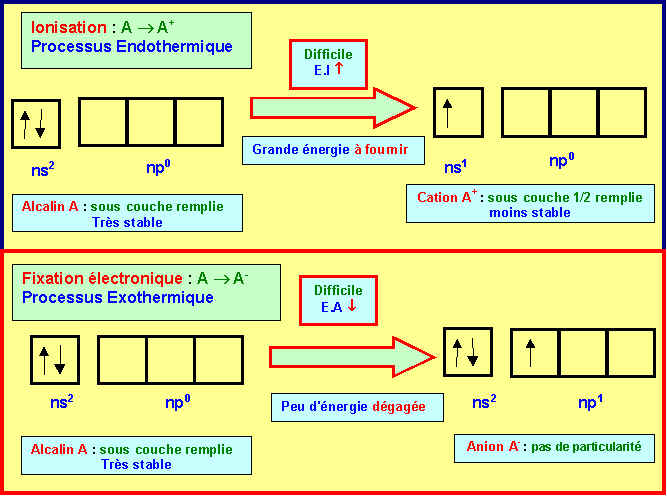
8) Les alcalino-terreux ont des énergies de première ionisation " anormalement élevées " et des affinités électroniques " anormalement faibles ". Comment peut-on expliquer simplement ces deux " anomalies " ?
Ces deux "anomalies" s'expliquent par la stabilité particulière de l'atome neutre qui possède une sous-couche ns2 totalement remplie.
Le processus d'ionisation qui consiste à arracher un électron est donc "anormalement" difficile et nécessite donc une énergie particulièrement élevée.
Le processus de fixation d'un électron est lui aussi peu favorisé et dégagera donc peu d'énergie ce qui conduira à une électroaffinité "anormalement" faible.

9) Le Béryllium ne possède qu’un seul isotope stable. Sa masse molaire atomique est 9,012 g. mol-1.
a) Calculez l’énergie de cohésion de cet isotope stable, en Joule mol-1 puis en MeV par noyau puis en MeV par nucléon.
M = 9,012 g mol-1 è A = 9 è 9Be è Z = 4 et N = 5
Masse "théorique" du noyau :
Mthéo = Z mp + N mn = 4 * 1,00727 + 5 * 1,00866 = 9,07238 u.m.a / noyau = 9,07238 g mol-1
Défaut de masse :
Dm = ½ 9,012 - 9,07238 ½ = 0,06038 u.m.a / noyau = 0,06038 g mol-1
La masse réelle du noyau est inférieure à sa masse " théorique ", le noyau est plus stable que ses constituants séparés. Il y a donc dégagement d’énergie lors de la formation du noyau a partir de ses constituants. La masse perdue est entièrement convertie en énergie.
Energie de cohésion :
E = Dm C2 = 0,06038 10-3 * 9 1016 = 5,4342 1012 J.mol-1
E = 5,4342 106 / 96500 = 56,31 MeV / noyau = 56,31 / 9 = 6,26 MeV / nucléon
b) On a représenté sommairement la courbe d’Aston de stabilité des isotopes. Complétez ce schéma en indiquant les grandeurs (et leurs unités) représentées en abscices et en ordonnées. Que représentent les deux traits horizontaux ? Placer approximativement cet isotope sur la courbe. Fait-il parti des isotopes les plus stables ? Si non, par quel type de processus peut-il se stabiliser ?
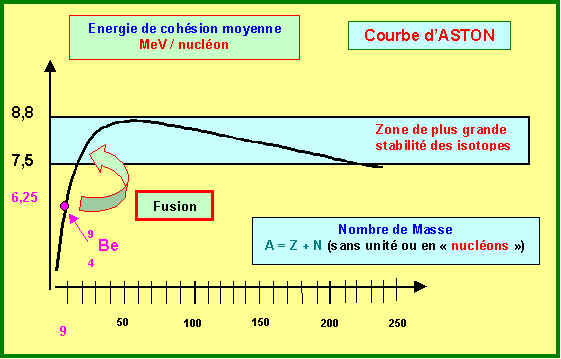
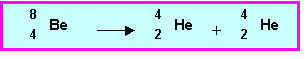
Cet isotope est utilisé comme " générateur de neutrons " dans l’industrie nucléaire. Un atome de cet isotope fixe en effet une particule a, un neutron est libéré et il se forme un autre noyau dont on précisera la nature exacte. Ecrire la transformation correspondante et dire si elle est en accord avec la réponse à la question 8-b)

Il s’agit bien d’une réaction de fusion dans laquelle deux noyaux " légers " s’unissent pour donner un noyau plus " gros ".
Il existe également trois isotopes radioactifs du Béryllium 7Be , 8Be et 10Be.
Un de ces isotopes est émetteur de type a ce qui peut paraître surprenant puisque ce type de radioactivité est généralement observé pour les atomes lourds de Z>84. Quel est cet isotope ? Qu’a-t-il de particulier qui justifie cette forme de radioactivité ? Ecrire la réaction nucléaire correspondante.
Le noyau de 8Be est équivalent à deux particules a il se scinde donc facilement en deux particules a individuelles.
Remarque : Au début du siècle, à l’aube des études sur l’atome et la radioactivité on a pensé que les particules a étaient des particules élémentaires.
Les deux autres isotopes sont des émetteurs de type b. Attribuez à chacun son type de radioactivité b+ ou b- en justifiant simplement la réponse. Ecrire les réactions nucléaires correspondantes.
Isotope 7Be : Cet isotope instable possède un " manque " de neutron (ou un excès de protons) il cherchera à se stabiliser en transformant un proton en neutron. Il sera donc émetteur b+(émissions de positrons).

Isotope 10Be : Cet isotope instable possède un " excès " de neutrons (ou un " manque " de protons) il cherchera à se stabiliser en transformant un neutron en proton. Il sera donc émetteur b- (émission d'électrons).

Le Magnésium (Z=12) possède trois isotopes stables 24Mg, 25Mg et 26Mg leurs abondances naturelles sont respectivement : 78,6% - 10,1 % et 11,3% . Calculer la masse molaire atomique approchée du Magnésium et expliquer pourquoi le résultat obtenu n’est qu’approximatif.
On peut faire l’approximation mp » mn » 1 u.m.a, on néglige de plus la masse des électrons et surtout le défaut de masse du noyau.
M = S xi Mi
Mi » S xi Ai
MAl = 0,786 * 24 + 0,101* 25 + 0,113 * 26 = 24,3 g mol-1