SUJET DE CHIMIE THEORIQUE - ATOMISTIQUE :
Soit la réaction (1) : 2 ABC = 2 AB + C2
Le mécanisme de la réaction (1) peut s'écrire schématiquement :
Etape 1 : Cassure d'une liaison B - C pour donner deux radicaux AB. et C.
2 A - B - C = 2 A - B. + 2 C.
Etape 2 : Recombinaison des radicaux C. formés pour donner C2
2 C. = C2
Une réaction de ce type est la décomposition du composé NClO (éléments donnés dans l'ordre alphabétique de leur nom) pour donner NO et Cl2
NClO = 2 NO + Cl2
QUESTIONS :
Composé NO :
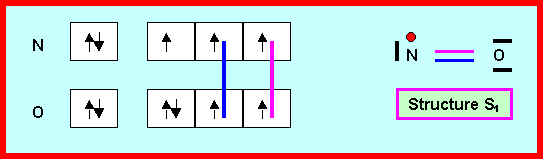
Ce composé est lui-même un radical possédant un électron célibataire.
Pour ce composé proposer deux structures de Lewis différentes :

Pour la structure S2 montrer que l'on peut écrire deux formes mésomères
- Des deux formes mésomères S2a et S2b quelle est celle de plus haut poids statistique ?

N : n* = 2 et Z* = 3,9 O : n* = 2 et Z* = 4,55
L(A°) = 0,239 S (n*2/Z*) + 0,164 S n* + 0,297
Liaison Simple NO :
L(A°) = 0,239 * ( 4 / 3,9 + 4 / 4,55 ) + 0,164 * ( 2 + 2 ) + 0,297 = 1,408 A°
Liaison double NO : 0,86 * 1,408 = 1,211 A°
Montrer que ce résultat expérimental s'accorde beaucoup mieux avec une des deux structures envisagées qu'avec l'autre. Quelle est cette structure ?
La valeur expérimentale est beaucoup plus proche de la longueur calculée pour la liaison double NO que de la longueur calculée pour liaison simple NO.
C'est donc la structure S1 qui semble convenir le mieux pour NO.
REMARQUE : La longueur de la liaison NO est en réalité intermédiaire entre celle de la liaison double et celle de la liaison triple. Cela pourrait être montré en utilisant le modèle quantique et la méthode C.L.O.A)
Composé NClO :
Pour ce composé proposer trois structures de Lewis différentes :
ON SE LIMITERA AUX FORMES MESOMERES NON CHARGEES
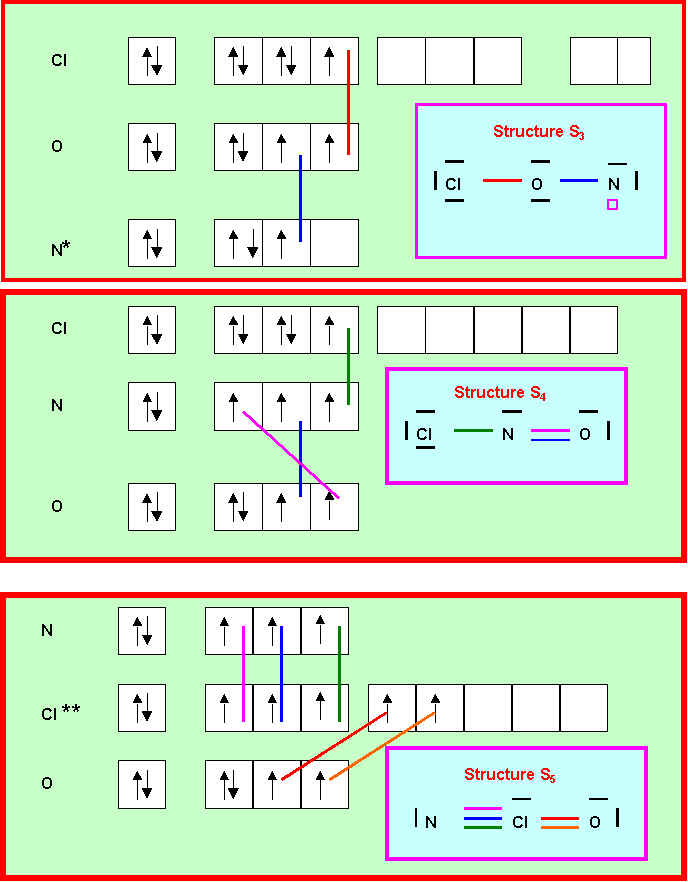
Prévoir la géométrie moléculaire et la valeur de l'angle (Cl-O-N, Cl-N-O ou N-Cl-O) pour ces trois structures.
La connaissance de la valeur de cet angle permettrait-elle de choisir entre ces trois structures ?
Les trois structures sont du type AX2E avec un angle légèrement inférieur à 120°.
La connaissance de l'angle ne permettrait donc pas de trancher à coup sur entre ces trois structures.
2 ABC = 2 AB + C2
Avec Cl central on obtiendrait selon la liaison qui se casse :
soit N2 + ClO : 2 OCl----- N = 2OCl + N2
soit O2 + ClN : 2 O-----ClN = O2 + 2 ClN
On ne peut en aucun cas obtenir Cl2 + NO.
- En appliquant le mécanisme réactionnel proposé, montrer que les structures S3 et S4 peuvent conduire toutes deux par cassure d'une simple liaison à la formation de Cl2 et NO.
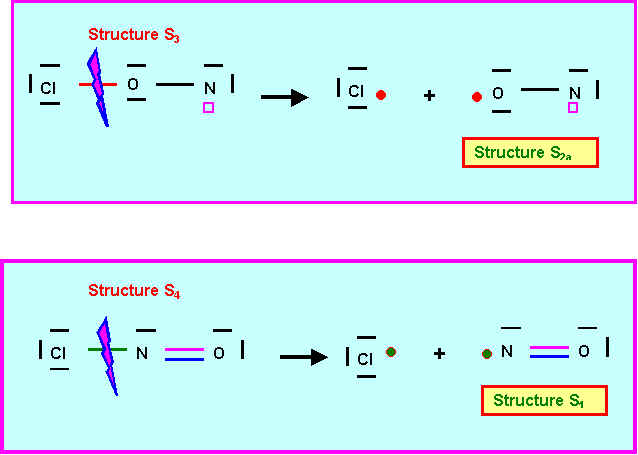
La structure S3 conduisant à la forme S2 qui est la plus probable pour NO, c'est cette structure S3 qui à priori est la "bonne" forme de NClO