CORRIGE DES SUJETS DE
ET DE THERMODYNAMIQUE
PREMIERE PERIODE
A: CHIMIE THEORIQUE-ATOMISTIQUE (sur 5 points)
Formulaire - Rappels - Données :
On rappelle la formule vue en cours permettant le calcul approché du rayon de covalence d’un atome : R(A°) = 0,215 n2/Z* + 0,148 n + 0,225
On rappelle les valeurs des constantes d'écran de Slater
| 1 s | 2 s ; 2 p | 3 s ; 3 p | 3 d | 4 s ; 4 p | |
| 1 s | 0,3 | 0,85 | 1 | 1 | 1 |
| 2 s ; 2 p | 0,35 | 0,85 | 1 | 1 | |
| 3 s ; 3 p | 0,35 | 1 | 0,85 | ||
| 3 d | 0,35 | 0,85 | |||
| 4 s ; 4 p | 0,35 |
Electronégativité de Mulliken : XM = 0,21 (EI + EA)
Electronégativité d'Alred et Rochow : XA.R = 0,34 Z*/R2 + 0,67
Nombre d'Avogadro : N = 6,022 1023
Données expérimentales sur l'atome d'oxygène
E.I = 13,6 eV - E.A = 1,46 eV - XAR = 3,5 - XM = 3,2 - Rcov = 0,73 A°
Exercice 1 : LES ATOMES S et O
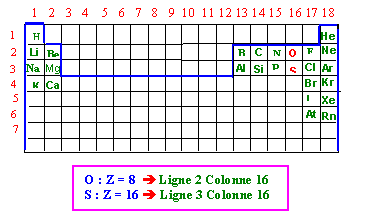
1) Situer les éléments Oxygène et Soufre dans la classification périodique.
(0,25 points)

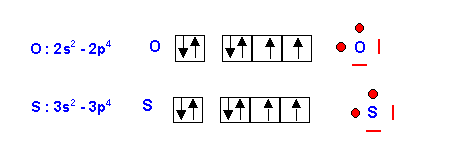
2) Donner pour ces deux éléments la configuration électronique de l’atome dans son état fondamental. (0,25 point)
O : 1s2 - 2s2 - 2p4
S : 1s2 - 2s2 - 2p6 - 3s2 - 3p4
3) Préciser leur couche de valence et donner le schéma de Lewis correspondant (0,25 point)
4) Que peut-on conclure quant aux propriétés comparées de ces deux éléments ?
Appartenant à la même colonne de la classification périodique, ces deux éléments ont une couche de valence identique et posséderont des propriétés chimiques semblables.(0,25 point)
5) Il existe 4 isotopes pour l’élément Soufre de nombre de masse 32, 33, 34, et 35.
a) Pour chaque isotope préciser la composition du noyau.(0,25 point)
Le noyau contient Z protons et N neutrons, soit A nucléons : A = Z + N.
Deux isotopes diffèrent seulement par le nombre de neutrons.
| Isotope | S 32 | S 33 | S 34 | S 35 |
A |
32 |
33 |
34 |
35 |
Z (Protons) |
16 |
16 |
16 |
16 |
N (Neutrons) |
16 |
17 |
18 |
19 |
b) Seuls les isotopes 32,33 et 34 existent naturellement. L’isotope 35 étant artificiel.
L’abondance naturelle de l’isotope 33 est de 0,74 %. La masse molaire atomique du soufre naturel est de 32,0640 g mol-1. Celle des isotopes 32, 33 et 34 sont respectivement : 31,97244 ; 32,97168 et 33,96852.
Déterminer l’abondance naturelle des isotopes 32 et 34.
| Isotope | S 32 | S 33 | S 34 |
| Masse Molaire | 31,97244 | 32,97168 | 33,96852 |
| Abondance (%) | x | y = 0,74 | z |
M = S xi Mi è 0,3197244 x + 0,3297168 y + 0,3396852 z = 32,0640
x + y + z = 100 è x + z = 100 - 0,74 è x + z = 99,26 è z = 99,26 - x
0,3197244 x + 0,3396852 z = 32,0640 - ( 0,3297168 * 0,74 ) = 31,82000957
0,3197244 x + 0, 3396852 ( 99,26 - x ) = 31,82000957
0,3197244 x + 33,717115295 - 0,3396852 x = 31,82000957
1,897143382 = 0,0199608 x
x = 95.04 (0,25 point)
z = 4,22
| Isotope | S 32 | S 33 | S 34 |
| Masse Molaire | 31,97244 | 32,97168 | 33,96852 |
| Abondance (%) | x = 95,04 | y = 0,74 | z = 4,22 |
Exercice 2 :
Pour l’atome d’Oxygène déterminer par utilisation des règles de Slater :
Comparer votre résultat à la valeur expérimentale et discuter l'accord entre ces deux valeurs
Oxygène ( Z = 8 )
| O | 1s2 | 2s2 , 2p4 |
| 2 E1 | 6 E2 | |
| O+ | 1s2 | 2s2 , 2p3 |
| 2 E1 | 5 E'2 |
O à O+ + 1 e- : Energie de première ionisation E.I1 = EO+ - EO
E O+ = 2 E1 + 5 E'2
EO = 2 E1 + 6 E2
E.I1 = 5 E'2 - 6 E2
Calcul de Z*E2 et E2 :
Z*E2 = 8 – (5 * 0,35) - (2 * 0,85) = 4,55
E2 = -13.6 * 4,552 / 4 = -70,39 eV
Calcul de Z*E'2 et E'2 :
Z*E'2 = 8 – (4 * 0,35) - (2 * 0,85) = 4,9 (soit plus simplement 4,55 + 0,35 = 4,9)
E'2 = -13,6 * 4,92 / 4 = -81,63 eV
Calcul de E.I1 :
E.I1 = 5 E'2 - 6 E2 = ( 5 * -81,63 ) - ( 6 * -70,39 ) = 14,2 eV (0,5 point)
Valeur expérimentale : EI1=13,6 eV
Ecart en % : [(14,2-13,6)/13.6] *100 = 4,4 %
La valeur trouvée par le calcul est bien du même ordre de grandeur que la valeur expérimentale mais est légèrement supérieure à celle-ci. Cet écart peut être expliqué par comparaison des schémas de Lewis de O et O+ :
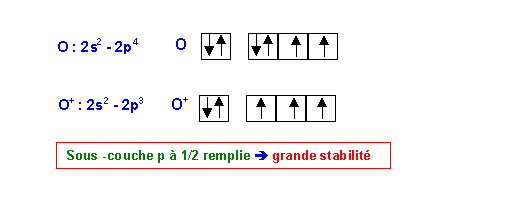
La stabilité particulière de O+ en raison de sa sous-couche à 1/2 remplie fait que l'atome O est particulièrement facile à ioniser d'où son énergie d'ionisation "anormalement" faible. (0,25 point)
b) L’affinité électronique E.A :
Comparer votre résultat à la valeur expérimentale et discuter l'accord entre ces deux valeurs
Oxygène ( Z = 8 )
| O | 1s2 | 2s2 , 2p4 |
| 2 E1 | 6 E2 | |
| O- | 1s2 | 2s2 , 2p5 |
| 2 E1 | 7 E'2 |
O + 1 e- à O- : Energie de fixation électronique Ef = EO- - EO
E O- = 2 E1 + 7 E'2
EO = 2 E1 + 6 E2
Ef = 7 E'2 - 6 E2
Calcul de Z*E2 et E2 :
Z*E2 = 8 – (5 * 0,35) - (2 * 0,85) = 4,55
E2 = -13.6 * 4,552 / 4 = -70,39 eV
Calcul de Z*E'2 et E'2 :
Z*E'2 = 8 – (6 * 0,35) - (2 * 0,85) = 4,2 (soit plus simplement 4,55 - 0,35 = 4,2)
E'2 = -13,6 * 4,22 / 4 = -59,976 eV
Calcul de Ef :
Ef = 7 E'2 - 6 E2 = (7 * -59,976) - (6 * -70,39) = 2,50 eV
Soit pour l'électroaffinité E.A = -2,5 eV (l'électroaffinité est égale à l'énergie de fixation électronique changée de signe).
Valeur expérimentale : EA = 1,46 eV (0,5 point)
Ecart en % : [(-2,5 -1,46)/1,46] *100 = 271 %
La valeur trouvée par le calcul est très éloignée de la valeur expérimentale. Cela est général, les valeurs calculées par cette technique sont très souvent mauvaises en ce qui concerne l'électroaffinité. Ici, l'erreur principale provient du signe trouvé pour l'énergie de fixation électronique qui est normalement négative pour la première fixation d'un électron. C'est d'ailleurs pour cette raison que l'on utilise l'électroaffinité positive au lieu de l'énergie de fixation électronique dans les tables de données.
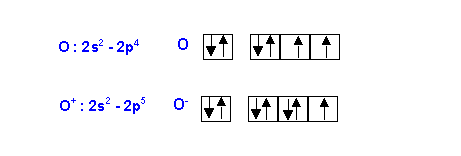
Remarque : On ne peut justifier cet écart par l'utilisation des schémas de Lewis de O et O- car aucun des deux ne possède une sous-couche particulièrement stable (ni remplie, ni à moitié remplie) (0,25 point)
c) En déduire l’électronégativité de l’oxygène dans l’échelle de Mulliken.
Comparer votre résultat à la valeur expérimentale et discuter l'accord entre ces deux valeurs
Electronégativité de Mulliken : XM = 0,21 (EI + EA)
Valeur calculée : XM = 0,21 (14,2 + -2,50) = 2,45
Valeur expérimentale : XM = 0,21 (13,6 + 1,46) = 3,16
Soit un écart de -22%
On ne peut tout au plus qu'estimer l'ordre de grandeur de l'électronégativité de Mulliken par utilisation des approximations hydrogénoïde de Slater car les erreurs commises à la fois sur EI et sur EA "s'ajoutent" généralement. (0,25 point)
Remarque : La valeur de E.I étant dans le cas général très supérieure à celle de EA c'est essentiellement la valeur de EI qui fixe l'électronégativité. Les erreurs commises sur le calcul de EA n'introduisent généralement pas d'erreur catastrophique sur la détermination de l'électronégativité de Mulliken. Dans cet exemple l'écart énorme de 271% sur la valeur attribué à E.A est ramené à seulement 20% sur XM.
d) Le rayon de covalence. Comparer votre résultat à la valeur expérimentale et discuter l'accord entre ces deux valeurs
R(A°) = 0,215 n2/Z* + 0,148 n + 0,225
Ici n=2 et Z*= 4,55 è R = 0,71 A°
Valeur expérimentale : R = 0,73 A°
Ecart : [0,71 - 0,73] / 0,73 * 100 = 2,8 %
La formule utilisée conduit à une assez bonne approximation du rayon de covalence. (0,25 point)
e) L'électronégativité dans l'échelle d'Alred et Rochow. Comparer votre résultat à la valeur expérimentale et discuter l'accord entre ces deux valeurs
Electronégativité d'Alred et Rochow : XA.R = 0,34 Z*/R2 + 0,67
XA.R = [ 0,34 * 4,55 / 0,712] + 0,67 = 3,74
Valeur expérimentale : 3,5
Ecart : (3,74 - 3,5) / 3,5 * 100 = 6,8 %
La formule utilisée permet d'obtenir l'ordre de grandeur de l'électronégativité de Alred et Rochow. La précision est nettement meilleure que celle obtenue pour l'échelle de Mulliken. (0,25 point)
Exercice 3 :
On donne pour les éléments des 1° et 2° groupes A à F les valeurs de EI1 et EI2 en eV.
Donner le numéro atomique Z, le nom et le symbole de chacun de ces éléments, sachant qu’ils appartiennent aussi aux quatre premières lignes :
A : 4,3 - 31,8 B : 9,3 - 18,2 C : 6,1 - 11,9
D : 5,1 - 47,3 E : 5,4 - 75,6 F : 7,6 - 15,0
Les éléments possibles sont :
Premier groupe (ou colonne) : H - Li - Na - K
(En fait H est exclu puisque ne possédant qu'un seul électron)
Deuxième groupe : Be - Mg - Ca
(0,25 point)
Pour attribuer son groupe à chaque élément il suffit de comparer les valeurs de EI1 et EI2.
En effet les ions ayant une structure électronique semblable à celle d'un gaz rare sont très stables (règle de l'octet) et donc très difficile à ioniser. Cela se traduit par une brusque élévation de l'énergie d'ionisation. Il suffit donc de voir pour quelle énergie d'ionisation se produit ce saut pour déduire le groupe auquel appartient un élément. On peut par exemple calculer le rapport EI2/EI1 si ce rapport a une valeur très élevée cela signifie que l'élément X étudié appartient au premier groupe puisque son ion X+ possède une énergie d'ionisation (correspondant à EI2) particulièrement élevée.
| Elément | A | B | C | D | E | F |
| EI1 | 4,3 | 9,3 | 6,1 | 5,1 | 5,4 | 7,6 |
| EI2 | 31,8 | 18,2 | 11,9 | 47,3 | 75,6 | 15,0 |
| EI2/ EI1 | 7,4 | 1,95 | 1,95 | 9,27 | 14 | 1,97 |
| groupe | 1 | 2 | 2 | 1 | 1 | 2 |
On voit ainsi que les éléments A, D et E appartiennent au premier groupe et que les éléments B, C et F appartiennent au deuxième groupe. (0,5 point)
Pour identifier ensuite chaque élément il suffit de considérer la valeur de EI1 :
En première approximation, la valeur de l'énergie d'ionisation est inversement proportionnelle à la taille de l'atome. Un atome petit retient mieux ses électrons qu'un gros car ceux-ci sont plus proches du noyau et donc plus fortement attiré par celui-ci.
On peut raisonner en fonction de la position d'un élément dans une même colonne :
Le rayon atomique est sensiblement proportionnel à n2/Z*, Z* varie peu quand on descend dans une colonne de la classification tandis que dans le même temps n augmente d'une unité. L'effet de l'augmentation de n est donc l'effet principal et le rayon atomique augmente sensiblement et l'énergie d'ionisation diminue donc quand on descend dans une même colonne de la classification.
On peut donc identifier les divers éléments :
Groupe 1 : E = Li ; D = Na ; A = K
Groupe 2 : B = Be ; F = Mg ; C = Ca (0,5 point)
| Elément | E | B | D | F | A | C |
| EI1 | 5,4 | 9,3 | 5,1 | 7,6 | 4,3 | 6,1 |
| EI2 | 75,6 | 18,2 | 47,3 | 15,0 | 31,8 | 11,9 |
| Nom | Lithium | Béryllium | Sodium | Magnésium | Potassium | Calcium |
| Z | 3 | 4 | 11 | 12 | 19 | 20 |
| Symbole | Li | Be | Na | Mg | K | Ca |
(0,25 point)
Données :
| CH3OH | O2 | CO2 | H2O | |
| T Ebullition | 65 °C (338 K) | -183 °C (90 K) | - 78 °C (195 K) | 100 °C (373 K) |
| C0p liquide | 82 J mol-1 K-1 | 75 J mol-1 K-1 | ||
| C0p gaz | 44 J mol-1 K-1 | 30 J mol-1 K-1 | 37 J mol-1 K-1 | 29 J mol-1 K-1 |
| DvapH0 | 35 KJ mol-1 | 7 KJ mol-1 | 44 KJ mol-1 |
On supposera les valeurs des C0p indépendantes de la température.
Les valeurs des enthalpies standards de changement d'état sont données pour la température du changement d'état correspondant.
R = 8,314 J mol-1 K-1
Masse Molaire de l'eau : MH2O = 18 g mol-1
Exercice 1 :
Dans un calorimètre on introduit 100 ml d'eau chaude, après stabilisation on note une température initiale de 45°C. On introduit alors dans le calorimètre 300 ml d'eau froide à 15°C.
- Calculer la valeur théorique de la température d'équilibre.
Q = m C DT = m C (Tf - Ti)
S Qi = 0
QCh + QFr = 0
Qch = 100 * Ce * (Tf - 45)
QFr = 300 * Ce * (Tf - 15)
Ce est supposé indépendant de T
100 * Ce * (Tf - 45) + 300 * Ce * (Tf - 15) = 0
100 * (Tf - 45) + 300 * (Tf - 15) = 0
100 Tf - 4500 + 300 Tf - 4500 = 0
400 Tf = 9000
Tf = 9000/400 = 22,5 °C (0,25 point)
Après stabilisation on note une température d'équilibre expérimentale de 23,6 °C.
QCh + QFr + QCal= 0
Qch = 100 * Ce * (Tf - 45)
QFr = 300 * Ce * (Tf - 15)
Qcal = m Ce (Tf - 45) : Le calorimètre est assimilé à de l'eau, on lui attribue une masse fictive m égale par définition à sa valeur en eau.
[100 * Ce * (23,6 - 45)] + [300 * Ce * (23,6 - 15)] + [m Ce (23,6 - 45)] = 0
[100 * -21,4] + [300 * 8,6] - [ 21,4 m] = 0
-2140 + 2580 = 21,4 m
Soit : m = 20,6 g (0,5 point)
On introduit alors 0,1 mole d'une substance S qui se dissout dans le mélange. On note la nouvelle valeur de la température d'équilibre T = 17,5 °C.
- Déterminer l'enthalpie molaire de dissolution de S.
Qeau + Qcal + QR = 0
QR = - Qeau - QCal
Qeau = 400 * Ce * (17,5 - 23,6) = -2440 Ce
Qcal = 20,6 * Ce * (17,5 - 23,6) = -331,6 Ce
Calcul de Ce : Ce = 75 J mol-1 K-1 è Ce = 75 / 18 = 4,17 J g-1 K-1
QR = (2440 + 331,6) * 4,17 = 11557,6 J (pour 0,1 mole de S)
Soit DRH0Dis = 11557,6 / 0,1 = 115576 J mol-1
DRH0Dis =115,6 KJ mol-1(0,25 point)
Exercice 2 :
Soient les réactions suivantes :
R1 : 4 NH3 + 3 O2 à 2 N2 + 6 H2O DRH10= - 1530 KJ mol-1
R2 : 2 H2 + O2 à 2 H2O DRH20= - 568 KJ mol-1
R3 : N2 à 2 N DRH30= + 940 KJ mol-1
R4 : H2 à 2 H DRH40= + 436 KJ mol-1
Déterminez l'enthalpie de la liaison N-H
Toutes les valeurs sont données pour T = 298 K.
Tous les composés sont gazeux à cette température sauf H2O qui est liquide.
On travaille avec les énergies de dissociation des liaisons qui sont forcements positives puisqu'il faut fournir de l'énergie pour casser une liaison.
Dans ces conditions : DRH0 = S Eliaisons rompues - S Eliaisons crées
Soit pour les 4 réactions :
DRH10 = 12 ENH + 3 EOO - 2 ENN -12 EOH
DRH20 = 2 EHH + EOO - 4 EOH
DRH30 = ENN
DRH40 = EHH
DRH10 = 12 ENH + 3EOO - 2 DRH30 -12 EOH
DRH20 = 2 DRH40 + EOO - 4 EOH
3 DRH20 = 6 DRH40 + 3 EOO - 12 EOH
DRH10 = 12 ENH + 3EOO - 2 DRH30 -12 EOH
3 DRH20 - DRH10 = 6 DRH40 -12 ENH + 2 DRH30
12 ENH = 6 DRH40 - 3 DRH20 + 2 DRH30 + DRH10
ENH = [ 6 DRH40 - 3 DRH20 + 2 DRH30 + DRH10 ] / 12
ENH = [ (6 * 436) - (3 * -568) + (2 * 940) + -1530] / 12 = 389 KJ mol-1
ENH = 389 KJ mol-1 (2 points)
Exercice 3 :
On étudie la réaction de combustion complète du méthanol CH3OH dans le dioxygène O2, conduisant à la formation de dioxyde de carbone CO2 et d'eau H2O.
L'enthalpie standard de cette réaction est de DRH0298 = - 725 KJ mol-1 à 298 K.
Les autres données nécessaires sont fournies en première page du sujet de thermodynamique.
a) déterminez la valeur de DRU0298
| CH3OH | O2 | CO2 | H2O | |
| T Ebullition | 65 °C (338 K) | -183 °C (90 K) | - 78 °C (195 K) | 100 °C (373 K) |
| C0p liquide | 82 J mol-1 K-1 | 75 J mol-1 K-1 | ||
| C0p gaz | 44 J mol-1 K-1 | 30 J mol-1 K-1 | 37 J mol-1 K-1 | 29 J mol-1 K-1 |
| DvapH0 | 35 KJ mol-1 | 7 KJ mol-1 | 44 KJ mol-1 |
H = U + PV
PV = ng RT
H = U + ng RT
DH = DU + Dng RT
DRU0 = DRH0 - Dng RT
A 298 K sous P = 1 bar : CH3OH et H2O sont liquides, O2 et CO2 sont gazeux.
CH3OH (l) + 3/2 O2 (g) = CO2 (g) + 2 H2O(l)
Dn(g) = 1 - 3/2 = -1/2
DRU0 = DRH0 + 0,5 RT
DRU0 = -725000 + 0,5 * 8,314 * 298 = -723761 J mol-1
DRU0 = -723,8 KJ mol-1 (0,25 point)
Le méthanol change d'état à 338 K, il faudra donc en tenir compte.
Plusieurs méthodes permettent d'obtenir le résultat, je vous en propose ici trois :
Première Méthode : Basée sur l'utilisation de chemins différents partant du même état initial pour conduire au même état final.
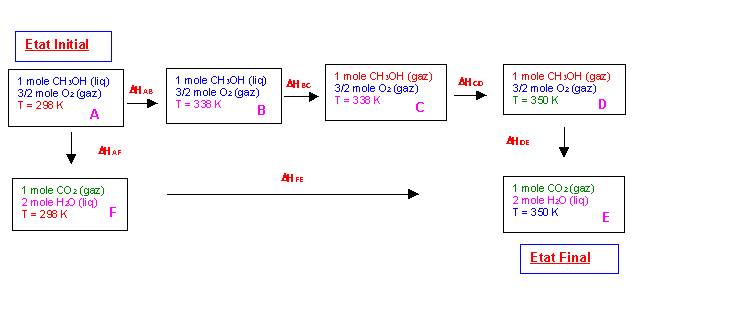
Pour aller de l'état initial A à l'état final E ont peut emprunter deux chemins différents :
A à B à C à D à E ou A à F à E
L'enthalpie est une fonction d'état dont la valeur ne dépend pas du chemin suivi mais uniquement de l'état final et de l'état initial.
Chemin : A à B à C à D à E
DHAE = DHAB + DHBC + DHCD + DHDE
Chemin : A à F à E
DHAE = DHAF + DHFE
DHAB = [Cp CH3OH (liq) * (338 - 298) ] + [3/2 Cp O2 (gaz) * (338 - 298) ]
DHAB = [82 * (338 - 298) ] + [3/2 * 30 * (338 - 298) ] = 5080 J
DHBC = DVapH0338 = 35000 J
DHCD = [Cp CH3OH (gaz) * (350 - 338) ] + [3/2 Cp O2 (gaz) * (350 - 338) ]
DHCD = [44 * (350 - 338) ] + [3/2 * 30 * (350 - 338) ] = 1068 J
DHDE = DRH0350
DHAF = DRH0298 = -725000 J
DHFE = [Cp CO2 (gaz) * (350 - 298) ] + [2 Cp H2O (liq) * (350 - 298) ]
DHFE = [37 * (350 - 298) ] + [2 * 75 * (350 - 298) ] = 9724 J
DHAB + DHBC + DHCD + DHDE = DHAF + DHFE
DRH0350 = DHDE = DHAF + DHFE - DHAB - DHBC - DHCD
DRH0350 = -725000 + 9724 - 5080 - 35000 - 1068 = -756424 J
DRH0350 = -756424 J
Deuxième méthode : Utilisation de la loi de Kirschoff
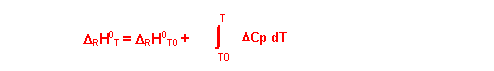
Si on considère les Cp indépendants de T
DRH0T = DRH0T0 + DCp ( T - T0 )
La réaction étudiée à 350 K est :
CH3OH (gaz) + 3/2 O2 (gaz) = CO2 (gaz) + 2 H2O(liq)
DCp = 2 CpH2O(liq) + CpCO2(gaz) - CpCH3OH(gaz) - 3/2 CpO2(gaz)
DCp = (2 * 75) + 37 - 44 - (3/2 * 30) = 98 J K-1
Détermination de DRH0298 = DRH0T0
R1 : CH3OH (gaz) + 3/2 O2 (gaz) = CO2 (gaz) + 2 H2O(liq)
R2 : CH3OH (liq) + 3/2 O2 (gaz) = CO2 (gaz) + 2 H2O(liq)
R3 : CH3OH (liq) = CH3OH (gaz)
La réaction R1 peut être obtenue par combinaison linéaire des réactions R2 et R3 :
R1 = R2 - R3
Soit la relation équivalente pour les enthalpies de réaction :
DR1H0298 = DR2H0298 - DR3H0298
DR2H0298 = -725000 J mol-1
DR3H0298 = DvapH0298
On connaît DVapH0338 = 35000 J mol-1
On peut calculer DVapH0298 en appliquant la loi de Kirschoff
DVapH0T = DVapH0T0 + DCpVap ( T - T0)
DVapH0298 = DVapH0338 + DCpVap ( 298 - 338)
DCpVap = Cp CH3OH (gaz) - Cp CH3OH (liq) = 44 - 82 = -38
DVapH0298 = 35000 - 38 * ( 298 - 338) = 36520 J mol-1
DR1H0298 = -725000 - 36520 = -761520 J mol-1
DR1H0350 = -761520 + [ 98 * ( 350 - 298 ) ] = -756424 J mol-1
DR1H0350 = -756424 J mol-1
Troisième méthode : utilisation d'un cycle de Hess
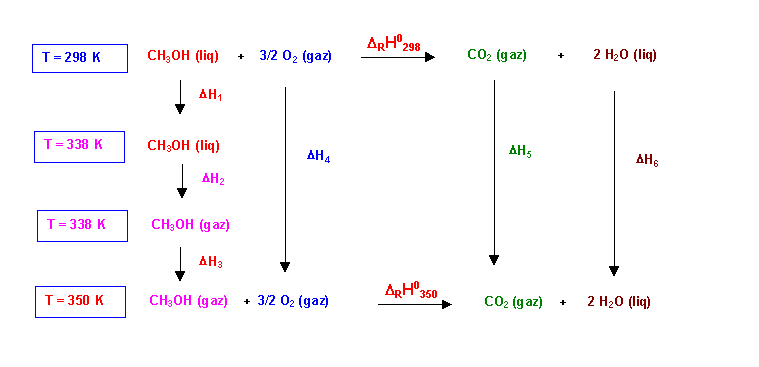
Posons
DH1 + DH2 + DH3 = DHCH3OH
DH4 = DHO2
DH5 = DHCO2
DH6 = DHH2O
On peut écrire :
DHCH3OH + DHO2 + DRH0350 = DRH0298 + DHCO2 + DHH2O
DRH0350 = DRH0298 + DHCO2 + DHH2O - DHCH3OH - DHO2
DHCH3OH = [ Cp CH3OH(liq) * (338 - 298 ) ] + DVapH0 + [ Cp CH3OH(gaz) * (350 - 338 ) ]
DHCH3OH = [ 82 * (338 - 298 ) ] + 35000 + [ 44 * (350 - 338 ) ] = 38808 J
DHO2 = [ Cp O2(gaz) * (350 - 298 ) ]
DHO2 = [ 30 * (350 - 298 ) ] = 1560 J
Soit pour 1,5 moles : 2340 J
DHCO2 = [ Cp CO2(gaz) * (350 - 298 ) ]
DHCO2 = [ 37 * (350 - 298 ) ] = 1924J
DHH2O = [ Cp H2O(liq) * (350 - 298 ) ]
DHH2O = [ 75 * (350 - 298 ) ] = 3900 J
Soit pour 2 moles : 7800 J
DRH0350 = DRH0298 + DHCO2 + DHH2O - DHCH3OH - DHO2
DRH0350 = -725000 + 1924 + 7800 - 38808 - 2340 = -756424 J mol-1
DRH0350 = -756424 J mol-1