SUJET DE CHIMIE THEORIQUE-ATOMISTIQUE
SESSION DE SEPTEMBRE 99 – Première période
LES ATOMES
" LES ALCALINS "
FORMULAIRE – RAPPELS - DONNEES :
On donne la valeur du Z* de Slater pour certains éléments des blocs s et p de la classification périodique :
| H (1) | He (1,70) | ||||||
| Li (1,3) | Be (1,95) | B (2,60) | C (3,25) | N (3,90) | O (4,55) | F (5,2) | Ne (5,85) |
| Na (2,2) | Mg (2,85) | Al (3,5) | Si (4,15) | P (4,80) | S (5,45) | Cl(6,1) | Ar (6,75) |
| K (2,2) | Ca (2,85) | Ga (5,00) | Ge (5,65) | As (6,30) | Se (6,95) | Br (7,6) | Kr (8,25) |
| Rb (2,2) | Sr (2,85) | In (5,00) | Sn (5,65) | Sb (6,30) | Te (6,95) | I (7,60) | Xe (8,25) |
NOTA : Le Z* des ions pourra être calculé directement à partir des valeurs des Z* des éléments.
Constantes diverses :
Constante de Planck : h = 6,63 10-34 J s
Charge de l’électron : e = 1,6 10-19 C
Nombre d’Avogadro : N = 6,022 1023
Célérité de la lumière dans le vide : C = 3 108 m s-1
Masse de l'électron : me = 9,1 10-31 kg
Masse du proton : mp = 1,6725 10-27 kg =1,00727 u.m.a
Masse du neutron : mn = 1,6747 10-27 kg = 1,00866 u.m.a
QUESTIONS :
2) Complétez le tableau suivant en indiquant pour chaque alcalin son numéro atomique et sa configuration électronique sous la forme : [gaz rare] couche de valence.
NOM |
SYMBOLE |
Z |
Configuration |
Lithium |
Li |
||
Sodium |
Na |
||
Potassium |
K |
||
Rubidium |
Rb |
||
Césium |
Cs |
||
Francium |
Fr |
3) Le Sodium ne possède qu’un seul isotope stable 23Na.
La masse molaire du sodium naturel trouvée dans les tables est de 22,9898 g mol-1.
Commentez cette valeur et expliquer pourquoi elle est très proche de la valeur entière 23 et très légèrement inférieure à celle-ci..
4) Le Potassium existe sous forme de deux isotopes stables 39K et 41K.
Les abondances relatives de ces deux isotopes sont de 93,09 % pour l’un et de 6,91 % pour l’autre.
Sachant que la masse molaire du Potassium naturel est de 39,10 g mol-1 attribuer son abondance naturelle à chaque isotope.
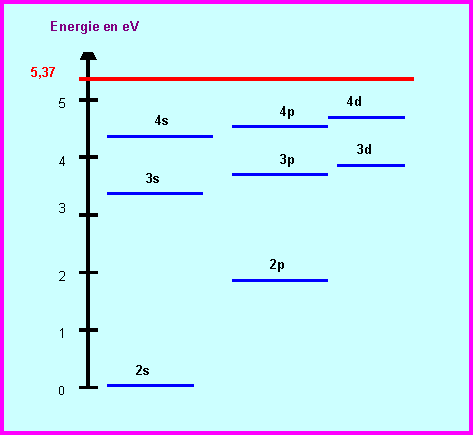
5) Le Lithium présente dans son spectre d’émission une raie rouge intense de longueur d’onde 671 nm.
Calculer l’énergie associée à cette longueur d’onde.
La figure suivante donne les niveaux d’énergies de l’atome de Lithium déterminés à partir de son spectre d’émission.

6) Le Francium est le métal alcalin le plus lourd connu. Il a été découvert par Perey en 1939.
Ce métal est radioactif et ne possède aucun isotopes stables.
On obtient un de ses isotopes 223Fr par la désintégration spontanée de type a d'un isotope radioactif de l'Actinium (Z = 89). L'isotope du francium obtenu se transforme par radioactivité de type b- en un isotope du Radium.
Ces deux transformation successives sont schématisées dans la figure suivante :
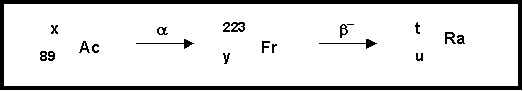
On demande de déterminer les valeurs de x, y, t et u.
7) Le tableau suivant donne : le rayon de covalence et le rayon ionique (en A°) et les énergies de première ionisation (E.I.1) et de deuxième ionisation (E.I.2) en KJ mol-1 des 4 premiers alcalins.
Rayon Covalent (A°) |
Rayon Ionique (A°) |
E.I 1 (KJ mol-1) |
E.I 2 (KJ mol-1) | |
Lithium |
1,23 |
0,60 |
520,3 |
7298 |
Sodium |
1,54 |
0,95 |
495,8 |
4562 |
Potassium |
2,03 |
1,33 |
419 |
3051 |
Rubidium |
2,16 |
1,48 |
403 |
2632 |
Dans le Chlorure de Potassium KCl la distance internucléaire K-Cl est de 3,14 A°.
Evaluer les rayons ioniques de K et de Cl.