S.M 1 - Session de Septembre 2001
Rattrapage Première période
" Initiation à la Chimie Théorique : Les Atomes "
Constantes d'écran de Slater
1s |
0,3 |
||||||||||
2s 2p |
0,85 |
0,35 |
|||||||||
3s 3p |
1 |
0,85 |
0,35 |
||||||||
3d |
1 |
1 |
1 |
0,35 |
|||||||
4s 4p |
1 |
1 |
0,85 |
0,85 |
0,35 |
||||||
4d |
1 |
1 |
1 |
1 |
1 |
0,35 |
|||||
4f |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
||||
5s 5p |
1 |
1 |
1 |
1 |
0,85 |
0,85 |
0,85 |
0,35 |
|||
5d |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
||
5f |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
6s 6p |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,85 |
0,85 |
0,85 |
0,35 |
1s |
2s 2p |
3s 3p |
3d |
4s 4p |
4d |
4f |
5s 5p |
5d |
5f |
6s 6p |
Rayon de Bohr : a0 = 0,529 A° ( 1 A° = 10-10 m )
Les éléments de la colonne 14
Les éléments de la colonne 14 de la classification périodique sont dans l'ordre de leur numéro atomique croissant : Carbone - Silicium - Germanium - Etain - Plomb.
Le tableau suivant résume quelques données sur ces éléments :
Nom |
Rayon de covalence (A°) |
Rayons ioniques (A°) |
Carbone |
0,77 |
|
Silicium |
1,18 |
|
Germanium |
1,22 |
0,53 - 0,93 |
Etain |
1,40 |
0,71 - 1,12 |
Plomb |
1,46 |
0,84 - 1, 20 |
Nom |
Symbole |
Z |
Configuration électronique simplifiée [gaz rare] (couches externes) |
Z* |
Carbone |
C |
6 |
[He] 2s2 2p2 |
3,25 |
Silicium |
Si |
14 |
||
Germanium |
[Ar] 3d10 4s2 4p2 |
|||
Etain |
Sn |
|||
Plomb |
5,65 |
2-1: Enoncer le postulat de Bohr
2-2: Donner l'expression obtenue pour le rayon d'une orbite de Bohr.
2-3 : Donner l'expression obtenue pour l'énergie de l'électron sur une orbite de Bohr.
2-4 : Que deviennent les deux expressions précédantes dans le cadre du modèle des approximations hydrogénoïdes de Slater.
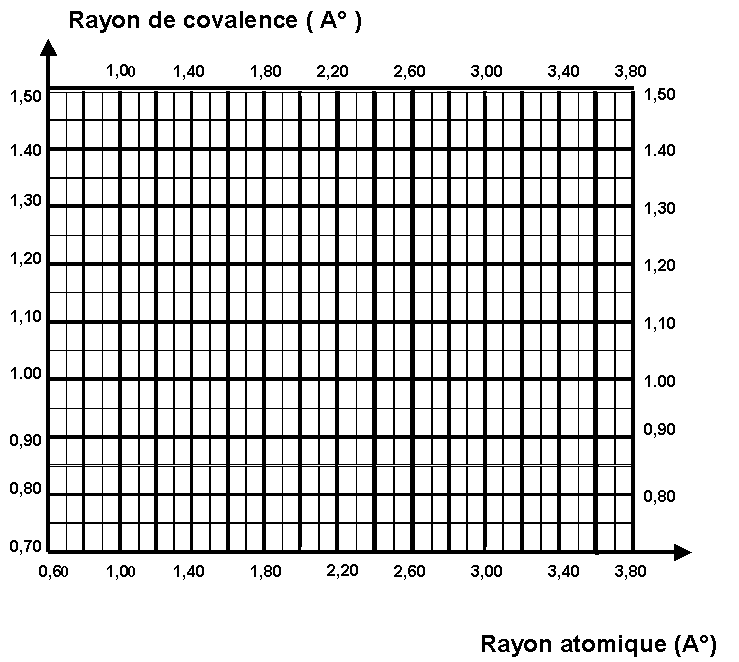
3) Rayons de covalence et rayons atomiques
On évalue parfois le rayon atomique par l'expression Ra = a0 n2 / Z*
On peut donc calculer, en utilisant cette expression, les rayons atomiques des éléments de la colonne 14.
3-1 : Compléter le tableau.
élément |
n |
n2 / Z* |
Rayon atomique (A°) |
Carbone |
2 |
1,23 |
0,65 |
Silicium |
|||
Germanium |
4 |
||
Etain |
|||
Plomb |
6,37 |
3,37 |
3-2 : Donner la définition du rayon de covalence d'un atome.
3-3 : Représenter graphiquement l'évolution du rayon de covalence en fonction du rayon atomique (définit comme précédemment) pour les éléments de la colonne 14.

3-4 : Existe-t-il une relation de proportionnalité entre rayon de covalence et rayon atomique pour les éléments de la colonne 14 ?
3-5 : En fait, pour "améliorer "le modèle de Slater on utilise des valeurs "corrigées" de n notées n*. Pour n = 1, 2 ou 3 on a simplement n* = n, pour n = 4 on prend n* = 3,7 et pour n = 5 on prend n* = 4. Complétez le tableau. Sur le graphique précédant faire figurer les points obtenus en utilisant ces valeurs corrigées de n.
élément |
n* |
n*2 /Z* |
Rayon atomique corrigé (A°) |
Carbone |
2 |
1,23 |
0,65 |
Silicium |
3 |
||
Germanium |
3,7 |
||
Etain |
4 |
3-6: Le résultat obtenu est-il plus satisfaisant ?
3-7: Quelle valeur faut-il donner à n* quand n = 6 ?
4) Rayons ioniques :
Pour chaque rayon ionique de la table fournie, donner la nature de l'ion correspondant. Indiquer s'il s'agit d'un anion ou d'un cation et préciser sa charge électrique. Complétez le tableau puis justifiez qualitativement vos réponses.
