S.M 1 - Session de Septembre 2001 -
Rattrapage Première période
" Initiation à la Chimie Théorique - Les atomes "
Constantes d'écran de Slater
1s |
0,3 |
||||||||||
2s 2p |
0,85 |
0,35 |
|||||||||
3s 3p |
1 |
0,85 |
0,35 |
||||||||
3d |
1 |
1 |
1 |
0,35 |
|||||||
4s 4p |
1 |
1 |
0,85 |
0,85 |
0,35 |
||||||
4d |
1 |
1 |
1 |
1 |
1 |
0,35 |
|||||
4f |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
||||
5s 5p |
1 |
1 |
1 |
1 |
0,85 |
0,85 |
0,85 |
0,35 |
|||
5d |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
||
5f |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
6s 6p |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0,85 |
0,85 |
0,85 |
0,35 |
1s |
2s 2p |
3s 3p |
3d |
4s 4p |
4d |
4f |
5s 5p |
5d |
5f |
6s 6p |
Rayon de Bohr : a0 = 0,529 A° (1A° = 10-10 m )
Les éléments de la colonne 14
Les éléments de la colonne 14 de la classification périodique sont dans l'ordre de leur numéro atomique croissant : Carbone - Silicium - Germanium - Etain - Plomb
Le tableau suivant résume quelques données sur ces éléments :
Nom |
Rayon de covalence (A°) |
Rayons ioniques (A°) |
Carbone |
0,77 |
|
Silicium |
1,18 |
|
Germanium |
1,22 |
0,53 - 0,93 |
Etain |
1,40 |
0,71 - 1,12 |
Plomb |
1,46 |
0,84 - 1, 20 |
Nom |
Symbole |
Z |
Configuration électronique simplifiée [gaz rare] (couches externes) |
Z* |
Carbone |
C |
6 |
[He] 2s2 2p2 |
3,25 |
Silicium |
Si |
14 |
[Ne] 3s2 3p2 |
4,15 |
Germanium |
Ge |
32 |
[Ar] 3d10 4s2 4p2 |
5,65 |
Etain |
Sn |
50 |
[Kr] 4d10 5s2 5p2 |
5,65 |
Plomb |
Pb |
78 |
[Xe] 4f14 5d10 6s2 6p2 |
5,65 |
2-1: Enoncer le postulat de Bohr
Le moment cinétique de l'électron est quantifié.
Il ne peut prendre que des valeurs multiples de h / (2p).
m v R = n * [ h / (2p) ]
avec n = nombre quantique principal = nombre entier naturel non nul
2-2: Donner l'expression obtenue pour le rayon d'une orbite de Bohr.
R = (h2 e0 / p m e2) [ n2 / Z ] = a0 [ n2 / Z ]
Avec a0 = premier rayon de Bohr = 0,529 A°
2-3 : Donner l'expression obtenue pour l'énergie de l'électron sur une orbite de Bohr.
ET = - [m e4 / 8 e02 h2 ] * [ Z2 / n2 ]
Avec : [m e4 / 8 e02 h2 ] = 2,17 10-18 J = 13,6 eV = E0
ET = - E0 * [ Z2 / n2 ]
2-4 : Que deviennent les deux expressions précédantes dans le cadre du modèle des approximations hydrogénoïdes de Slater.
R = a0 [ n2 / Z * ]
ET = - E0 * [ Z*2 / n2 ]
3) Rayons de covalence et rayons atomiques
On évalue parfois le rayon atomique par l'expression Ra = a0 n2 / Z*
On peut donc calculer en utilisant cette expression les rayons atomiques des éléments de la colonne 14.
3-1 : Complétez le tableau.
n2 / Z* |
Rayon atomique (A°) |
|
Carbone |
1,23 |
0,65 |
Silicium |
2,17 |
1,15 |
Germanium |
2,83 |
1,50 |
Etain |
4,42 |
2,34 |
Plomb |
6,37 |
3,37 |
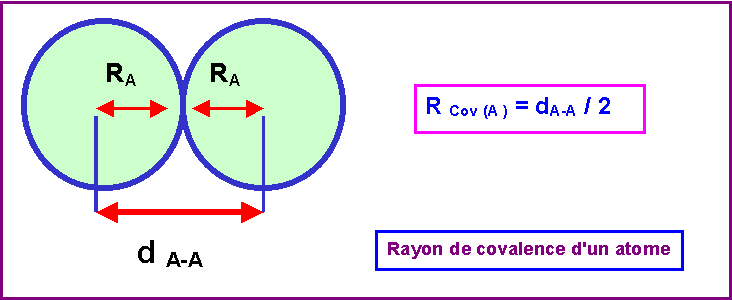
3-2 : Donner la définition du rayon de covalence d'un atome.
Le rayon de covalence d’un atome est une donnée expérimentale.
Supposons la molécule A2, dans cette molécule il existe une liaison A - A dont la longueur est mesurable expérimentalement.
Par définition, le rayon de covalence de l’atome A sera la moitié de cette distance de liaison.

3-3 : Représenter graphiquement l'évolution du Rayon de covalence en fonction du rayon atomique (définit comme précédemment) pour les éléments de la colonne 14.
élément |
Rayon de Covalence (A°) |
Rayon atomique (A°) |
Carbone |
0,77 |
0,65 |
Silicium |
1,18 |
1,15 |
Germanium |
1,22 |
1,50 |
Etain |
1,40 |
2,34 |
Plomb |
1,46 |
3,37 |
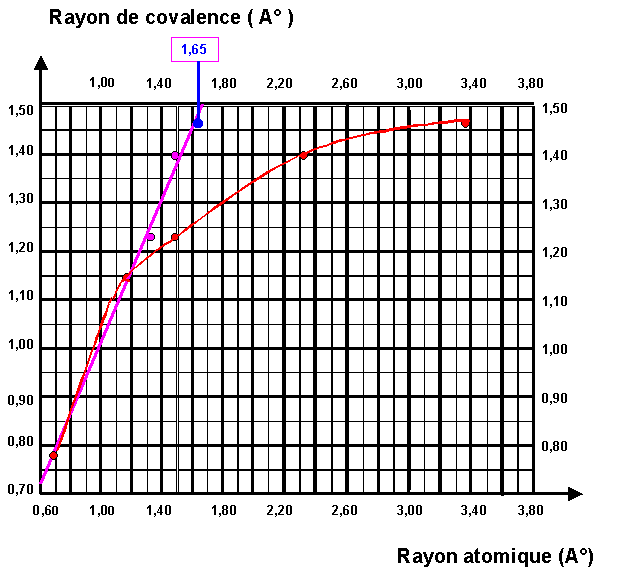
3-4 : Existe-t-il une relation de proportionnalité entre rayon de covalence et rayon atomique pour les éléments de la colonne 14 ?
Non, la courbe n'est pas une droite passant par l'origine, il n'y a donc pas proportionnalité.
3-5 : En fait, pour "améliorer "le modèle de Slater on utilise des valeurs "corrigées" de n notées n*. Pour n = 1, 2 ou 3 on a simplement n* = n, pour n = 4 on prend n* = 3,7 et pour n = 5 on prend n* = 4. Sur le graphique précédant faire figurer les points obtenus en utilisant ces valeurs corrigées de n.
élément |
n* |
n*2 / Z* |
Rayon atomique corrigé (A°) |
Carbone |
2 |
1,23 |
0,65 |
Silicium |
3 |
2,17 |
1,15 |
Germanium |
3,7 |
2,42 |
1,28 |
Etain |
4 |
2,83 |
1,50 |
3-6 : Le résultat obtenu est-il plus satisfaisant ?
Avec les valeurs "corrigées" on obtient une assez bonne corrélation linéaire, il n'y a pas proportionnalité au sens strict, car la droite ne passe pas tout à fait par l'origine. La relation linéaire est néanmoins assez satisfaisante.
3-7 : Quelle valeur faut-il donner à n* quand n = 6 ?
On lit graphiquement que le rayon atomique du Plomb doit être de 1,65 A° environ pour obtenir un bon alignement avec les autres points.
R = a0 n*2 / Z*
n*2 = R * Z* / a0 = 1,65 * 5,65 / 0,529 = 17,623
soit : n* = 4,2
4) Rayons ioniques :
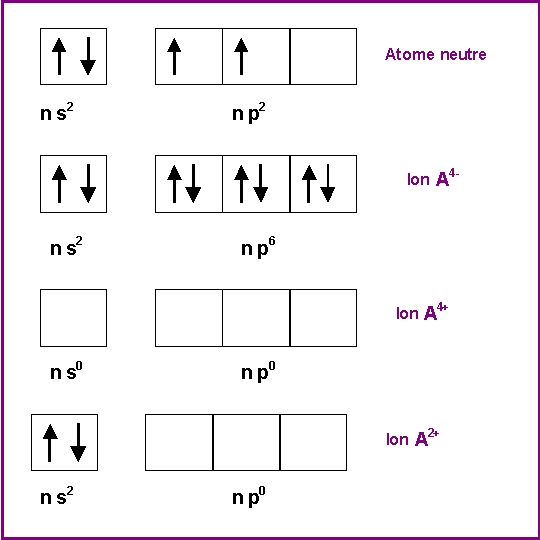
Pour chaque rayon ionique de la table fournie donner la nature de l'ion correspondant.. Justifier qualitativement vos réponses.

On constate que les rayons ioniques donnés sont toujours inférieurs aux rayons de covalence, cela montre qu'il s'agit de cations. En effet, en perdant des électrons l'atome voit son Z* augmenter par diminution de l'effet d'écran, les électrons sont donc soumis à une attraction plus importante du noyau et ils se rapprochent donc de lui, soit une diminution du rayon atomique. Cette contraction est d'autant plus importante que la charge de l'ion augmente, les rayons ioniques les plus petits correspondent donc aux fortes charges.
La prévision des ions stables donnés par un atome (des blocs s ou p) se fait en première approximation en utilisant la règle de l'octet. L'atome cherche à acquérir la structure électronique du gaz rare le plus proche dans la classification périodique. Dans le cas de la colonne 14 située au milieu de la classification les éléments ont deux possibilités pour satisfaire à la règle de l'octet : ressembler au gaz rare qui les précèdent en perdant 4 électrons ou ressembler au gaz rare qui les suit en gagnant 4 électrons.
La règle de l'octet permet donc de prévoir l'existence d'ions du type A4+ et A4-.
Dans le cas des éléments de la colonne 14, la configuration électronique de la couche de valence est du type : n s2 - n p2. Ils peuvent donc perdre les 4 électrons de leurs couche de valence pour donner l'ion A4+. Ils peuvent également ne perdre que les deux électrons p pour donner l'ion A2+, cet ion est également stable en raison de la sous-couche n s2 totalement remplie.
La formation d'anions en gagnant 4 électrons est également possible, à condition toutefois que l'élément ne soit pas un métal. Le carbone non métal caractérisé pourra donner l'ion C4-. Le Plomb et l'Etain non-métaux caractérisés ne le feront pas. Le Silicium et le Germanium sot des semi-métaux intermédiaires entre métaux et non-métaux.