JUIN 2000 – Deuxième Période – Chimie théorique – Atomistique
CORRIGE
1) Question de cours :
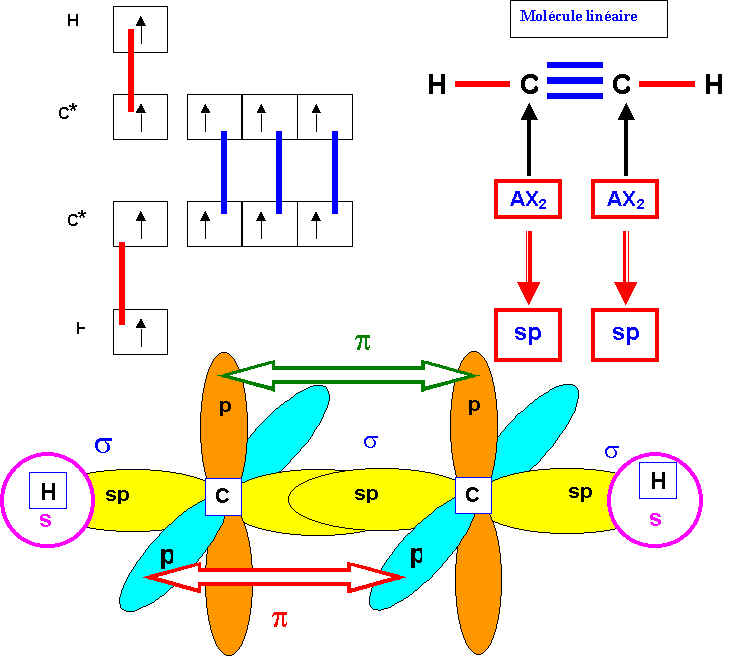
Décrire la molécule d’acéthylène (ou éthyne) de formule C2H2 dans le modèle de Lewis. En déduire la géométrie par la méthode R.P.E.C.V. Décrire ensuite cette molécule dans le modèle quantique
(géométrie- hybridation – formation des liaisons…)

2) Exercice :
La molécule ClO2 (dioxyde de chlore) possède un électron célibataire et est donc un radical peu stable. Elle donne facilement un cation ClO2+ et un anion ClO2- .
L’étude expérimentale de cette molécule montre que l’angle OClO est de 118,5 °
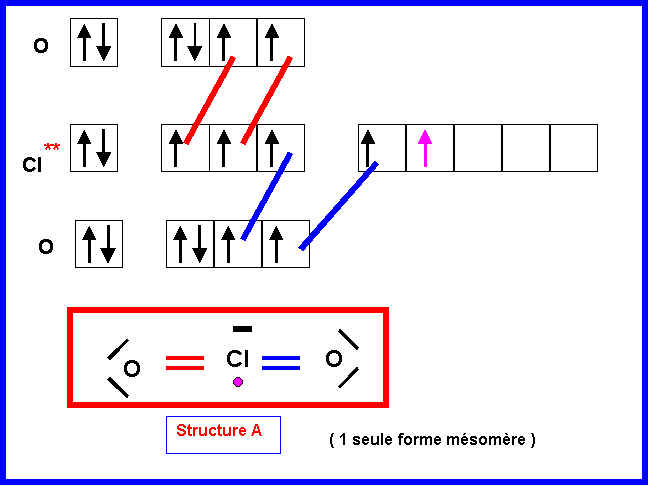
1) Donner un schéma de Lewis de la molécule ClO2
1-a) Pour lequel l’électron célibataire sera attribué à l’atome de Chlore (structure A).
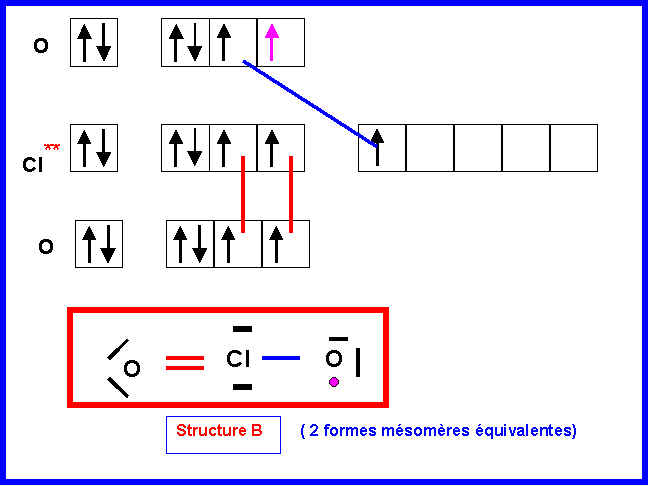
1-b) Pour lequel l’électron célibataire sera attribué à l’atome d’Oxygène (Structure B).
2) Montrer que la méthode de Gillespie permet de prévoir facilement la géométrie associée à une de ces deux structures alors qu’il est beaucoup plus difficile de prévoir la géométrie associée à l’autre.
Décrire la géométrie moléculaire pour la structure qui ne pose pas de problèmes.
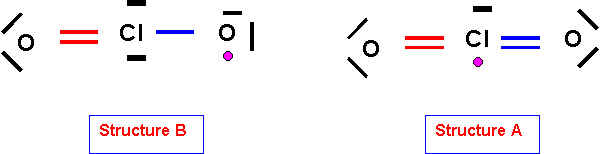
La méthode de Gillespie (V.S.E.P.R) permet de prévoir simplement la géométrie moléculaire à partir de la "disposition" des doublets électroniques autour de l'atome central. Pour que cette méthode puisse s'appliquer simplement il faut donc un nombre pair d'électrons autour de l'atome central.
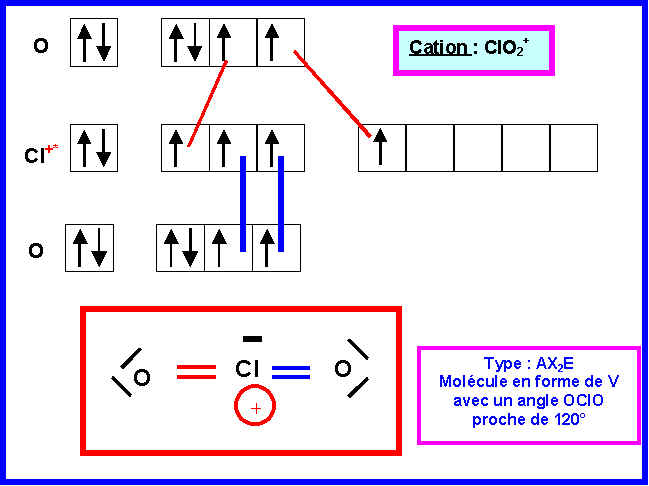
La géométrie de la structure B est donc facilement prévisible (type AX2E2).
La structure A pour lequel l'atome central possède un électron célibataire est plus difficile à décrire.
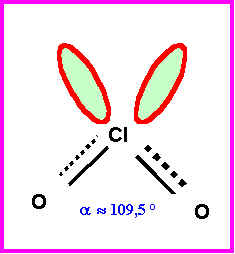
Géométrie de la structure B :
Type moléculaire : AX2E2
4 doublets soit une figure de répulsion "tétraédrique" avec deux sommets inoccupés (doublet s libres).
La molécule est en forme de V avec un angle OClO proche de 109,5°.
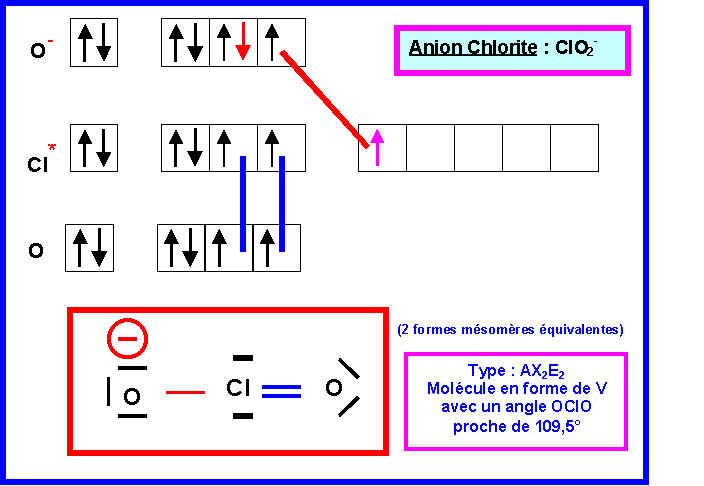
3) Donner les schémas de Lewis des deux ions et prévoir leur géométrie moléculaire.
4) La géométrie de l’ion Chlorite ClO2- a été étudiée expérimentalement.
L’angle OClO trouvé expérimentalement est de 110 °, la longueur des liaisons Cl -O est de 1,55 A°
Justifier ces valeurs expérimentales.
On donne les valeurs calculées des liaisons Cl-O (en A°) :
Simple 1,67 – Double 1,44 – Triple 1,30
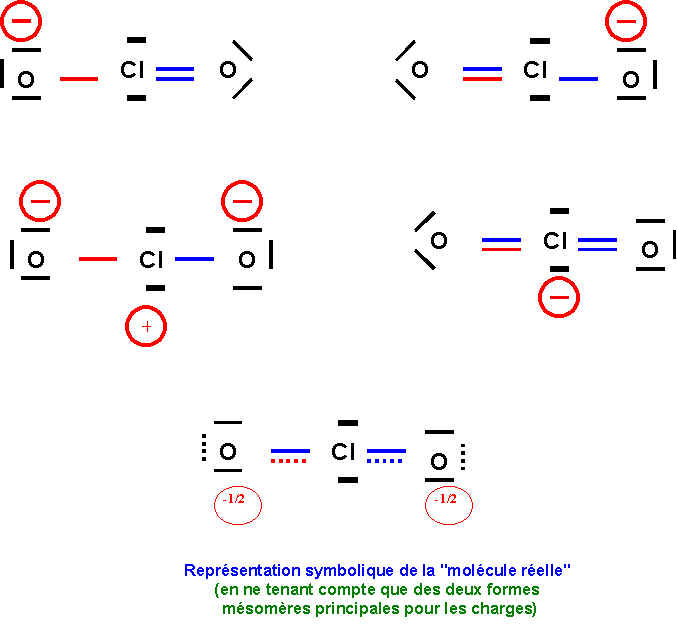
Il existe 4 formes mésomères au total puisque l'on peut écrire soit :
1 double liaison et une simple liaison (deux formes équivalentes)
2 double liaisons (une seule forme)
2 simples liaisons (une seule forme)
Les deux formes principales seront les deux formes équivalentes correspondant à une double et une simple liaison car elles présentent moins de charges et que l'oxygène est légèrement plus électronégatif que Cl (échelle de Pauling).
Géométrie de l'ion Chlorite :
Angle OClO :
Toutes les formes mésomères sont du type AX2E2, la géométrie est donc celle d'un tétraèdre avec deux sommets en moins soit une forme de V avec un angle "théorique" de 109,5° comme dit plus haut. Il faut aussi tenir compte de la présence de doublets libres d'une part et de liaisons multiples d'autre part.. La géométrie observée expérimentalement observée est très proche de celle prévue avec un angle OClO de 110°. On peut penser que les fortes répulsions "double liaison"/"double liaison" sont responsables du très léger agrandissement de l'angle OClO observé. Mais cet effet est compensé par les fortes répulsions doublet libre/doublet libre et les répulsions doublet libre/"doubles liaisons". Globalement ces divers effets se compensent et la géométrie observée est remarquablement proche de la géométrie prévu par la méthode V.S.E.P.R.
Longueur des liaisons Cl-O
Les liaisons Cl-O sont intermédiaires entres des simples liaisons et des doubles liaisons.
La longueur observée expérimentalement (1,55) est bien comprise entre celle de la simple liaison (1,67) et celle de la double liaison (1,44).
5) Montrer que la valeur de l’angle OClO dans la molécule ClO2 (118,5°) est simplement justifiable a partir des résultats de la question 3).
ClO2 est "intermédiaire" entre ClO2+ et ClO2-
L'angle observé pour ClO2 (118,5°) est bien intermédiaire entre celui prévu pour ClO2+ (120°) et celui observé pour ClO2- (110°).
6) Montrer qu’une seule des deux structures A ou B permet d’obtenir l’angle réellement observé.
L'angle OClO observé expérimentalement est très proche de 120°.
Nous avons vu que la structure B de type AX2E2 devrait conduire à un angle proche de 109,5°. De plus, l'environnement de l'atome de Chlore est (au point de vue V.S.E.P.R) identique à celui de Cl dans ClO2-, on devrait donc avoir un angle très peu différent pour ces deux structures.
La structure B ne peut donc expliquer la valeur expérimentale de l'angle ClOCl et c'est donc la structure A qui doit être correcte.
7) On rappelle la formule de Hanay-Smith permettant le calcul approximatif du pourcentage d'ionicité des liaisons : %IAB = 16 DX + 3,5 (DX)2 , on donne les électronégativité de Pauling pour Cl et O :
XCl = 3,16 et Xo = 3,44. On demande d'évaluer le moment dipolaire de la liaison simple Cl-O.
%IAB = 16 DX + 3,5 (DX)2
%IAB = 16 (3,44 - 3,16) + 3,5 (3,44 - 3,16)2 = 4,75 %
%IAB = 100 * d / e
m = d * d
d = m / d
%IAB = 100 m / d /e
m = %IAB * d * e / 100
m = 4,75 * 1,67 10-10 * 1,6 10-19 / 100 = 1,27 10-30 C.m
Avec les unités courantes :
%IAB = 20,8 m(D) / d (A°)
m(D) = %IAB * d (A°) / 20,8 = 4,75 * 1,67 / 20,8 = 0,38 D
soit 0,38 * 3,33 10-30 = 1,27 10-30 C.m