CORRIGE JUIN 98
CHIMIE THEORIQUE - ATOMISTIQUE
Exercice 1 : Molécules O2 et S2
On s'intéresse aux molécules O2 et S2.
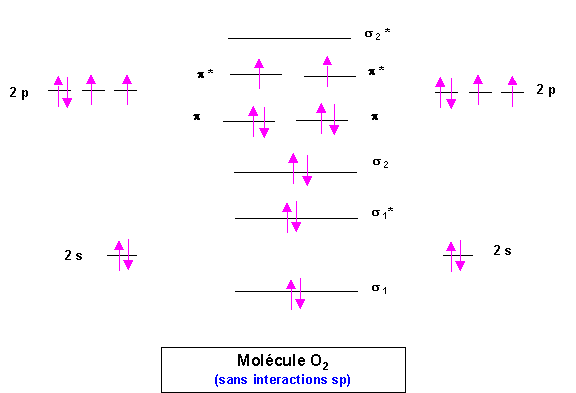
a) Donner un diagramme décrivant la molécule de dioxygène en utilisant l’approximation C.L.O.A (Combinaison Linéaire d’Orbitales Atomiques)
O : Z = 8 1s2 - 2s2 2p4 (couche de valence)
Nous supposerons que les niveaux 2s et 2p sont suffisamment écartés pour que les interactions de type s-p soient absentes. (1 point)

b) Cette molécule est-elle Paramagnétique ou Diamagnétique ? Pourquoi ?
La présence des deux électrons célibataires fait que cette molécule est Paramagnétique.(0,25 point)
c) Cela était-il prévisible par la théorie de Lewis ? Pourquoi ? Donner le schéma de Lewis de cette molécule.
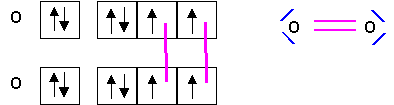
(0,25 point)
Le paramagnétisme de O2 n'apparaît pas dans le schémas de Lewis. Dans ce modèle les électrons apparaissent toujours sous forme de paires. (Sauf bien entendu pour les radicaux qui possèdent un nombre impair d'électrons)(0,25 point)
d) Pour la molécule S2 et les ions moléculaires correspondants ( S2+ ; S22+ ; S2- ; S22-) on trouve les résultats suivants pour les distances de liaisons S-S :
dS-S (A°) 1,72 - 1,79 - 1,88 - 2 - 2,20
Attribuer à chaque espèce sa longueur de liaison.
On pourra utiliser le schéma établi précédemment. Justifier simplement cela.
O et S appartiennent à la même famille (ou groupe ou colonne) de la classification périodique. Ils ont donc la même configuration électronique sur leur couche de valence et des propriétés chimiques très semblables. Le schéma utilisé pour O2 est donc aussi utilisable pour S2.
( la seule différence est que ce sont les niveaux 3s et 3p qui interviendront au lieu de 2s et 2p pour O.) (0,25 point)
Envisageons l'enlèvement d'électrons pour former S2+ et S22+
Les derniers niveaux occupés par des électrons sont les deux niveaux anti-liant p*.
L'enlèvement de ces électrons anti-liant stabilisera la molécule, l'indice de liaison augmentera et la liaison sera plus courte.
On peut le vérifier par le calcul de l'indice de liaison :
S2 : nl = 1/2 ( 8 - 4 ) = 2
S2+ : nl = 1/2 ( 8 - 3 ) = 2,5
S22+ : nl = 1/2 ( 8 - 2 ) = 3
(0,5 point)
Envisageons l'ajout d'électrons pour former S2- et S22-
On peut encore placer 2 électrons supplémentaires niveau anti-liant p*,
L'ajout de ces électrons anti-liant déstabilisera la molécule, l'indice de liaison diminuera et la liaison sera plus longue.
On peut le vérifier par le calcul de l'indice de liaison :
S2 : nl = 1/2 ( 8 - 4 ) = 2
S2- : nl = 1/2 ( 8 - 5 ) = 1,5
S22- : nl = 1/2 ( 8 - 6 ) = 1
(0,5 point)
Soit finalement l'attribution suivante :
| S22+ | S2+ | S2 | S2- | S22- | |
| nl | 3 | 2,5 | 2 | 1,5 | 1 |
| d S-S | 1,72 | 1,79 | 1,88 | 2 | 2,2 |
Exercice 2 : Composés contenant à la fois les éléments O et S
1) Il est très facile de remplacer un atome d’oxygène par un atome de soufre dans diverses molécules. Justifier cette facilité de substitution.
O et S appartiennent à la même famille (ou groupe ou colonne) de la classification périodique. Ils ont donc la même configuration électronique sur leur couche de valence et des propriétés chimiques très semblables. On pourra donc très facilement substituer un atome à l'autre.(0,25 point)
2) Le soufre peut former davantage de liaisons que l’oxygène, pourquoi ?
L'oxygène appartient à la deuxième période de la classification périodique et ne possède pas de niveaux d. Le soufre appartient à la troisième période et possède lui des niveaux d accessibles. Le soufre pourra utiliser ces niveaux 3d pour former des liaisons supplémentaires que ne peut faire l'oxygène.
Rappel : Le nombre de liaisons théoriquement possible pour un atome est égal au nombre de cases quantiques de sa couche de valence. Soit 4 liaisons théoriquement possibles pour O et 9 liaisons théoriquement possibles pour S.
On peut aussi invoquer la possibilité d'excitation du soufre pour justifier ces liaisons supplémentaires.(0,25 point)
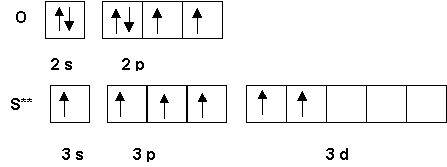
3) Ions Thiosulfate et Tétrathionate
Si on substitue un oxygène de l’ion sulfate (SO42-) par un soufre on obtient l’ion thiosulfate.
a) Quelle est sa formule ? S2O32- (0,25 point)
b) Proposer deux structures de Lewis A et B différentes pour cet ion. (0,5 point)
L'une A pour laquelle les deux charges négatives sont portées par des atomes d'oxygène, l'autre B pour laquelle une charge négative est porté par un oxygène alors que l'autre charge négative est portée par le soufre.
On donnera le schéma de Lewis sous forme de cases quantiques pour au moins une de ces deux structures. (0,5 point)
On montrera comment on passe de l'une à l'autre par déplacements électroniques. (0,5 point)
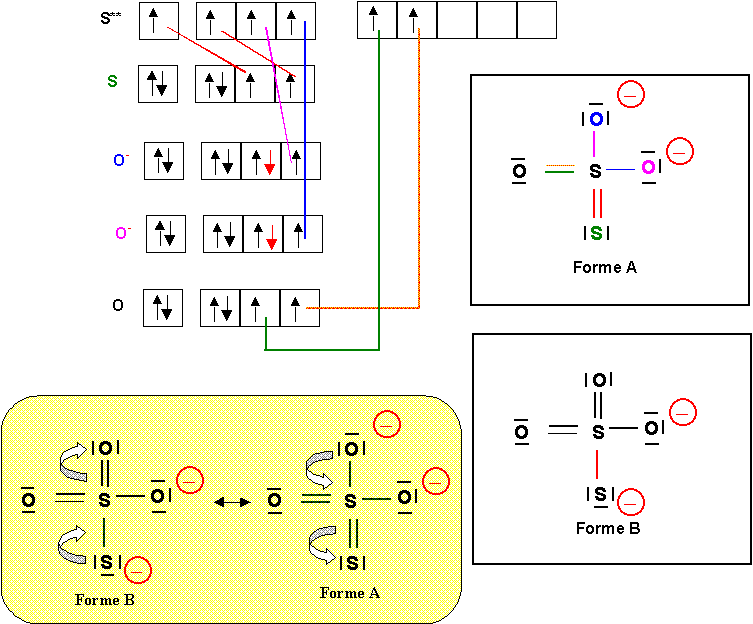
c) Compte tenu des électronégativités de S et O quelle est la structure la plus probable ?(0,25 point)
O étant plus électronégatif que S (situé plus haut dans la même colonne) c'est lui qui doit porter préférentiellement la charge négative. C'est donc la forme A qui est la plus probable.
d) Pour la structure la plus probable existe-t-il d'autres formes mésomères équivalentes ? Si oui les représenter.
Les trois atomes d'oxygène peuvent échanger leurs rôles :(0,75 point)
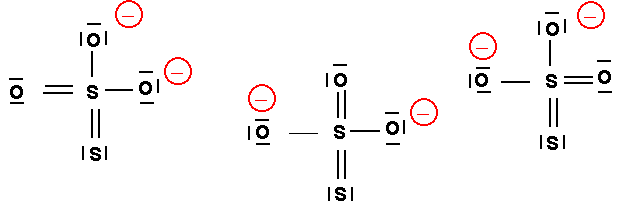
e) Donner une représentation symbolique de la molécule réelle si on ne tient compte que des formes mésomères correspondant a la structure de Lewis la plus probable. (0,5 point)
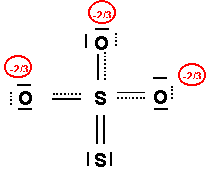
f) Préciser la géométrie de cet ion moléculaire. On indiquera en particulier les valeurs approximatives des angles OSO et OSS.(0,75 point)
Type moléculaire AX4
Figure de répulsion : Tétraèdre
Les angles seront proches de 109,5 °.
Le tétraèdre ne sera pas parfaitement symétrique car deux atomes de nature différentes sont présents (O et S), et d'autre part deux types de liaisons sont présentes simultanément double liaison SS et liaison SO intermédiaire entre simple et double .
L'effet de la différence entre double liaison et liaison intermédiaire (simple/double) est très certainement très faible et ne doit donc pas influer beaucoup sur les angles. Si cet effet se manifeste les angles correspondant à la liaison double (OSS) devrait être légèrement plus grands que les angles correspondant aux liaisons intermédiaires(OSO).
L'effet de la nature différente des atomes latéraux est prévisible par l'électronégativité de ceux-ci. O est plus électronégatif que S et attire donc plus fortement les électrons de liaison que celui-ci. Les doublets des liaisons S-O seront donc plus éloignés du S central que les doublets des liaisons S-S. Etant plus près de l'atome central les doublets de la liaison SS exerceront une répulsion plus importante que ceux des liaisons SO. Les angles OSS seront donc plus grand que les angles OSO.
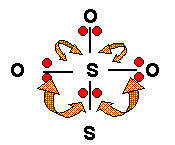
Les deux effets jouant dans le même sens on peut conclure que les angles OSS seront supérieurs à 109,5° et que les angles OSO seront inférieurs à 109,5°.
g) Quelle est l'hybridation de l'atome de Soufre central dans cet ion moléculaire ?
L'ion étant de géométrie tétraédrique, on peut supposer que l'hybridation de l'atome central est sp3. (Les liaisons de type p seront alors obtenues par l'intervention des orbitales atomiques d).(0,25 point)
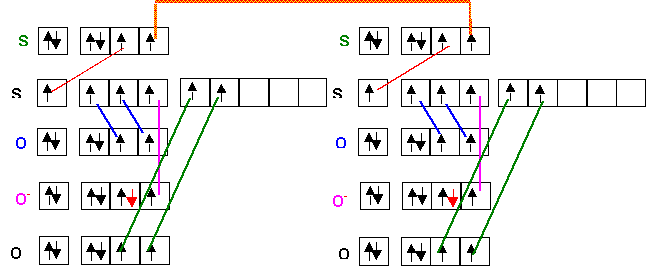
g) Il est possible de former l’ion tétrathionate S4O62- à partir de l’ion thiosulfate par création d’une liaison S - S. Proposer une structure de Lewis pour cet ion. (1 point)
Il suffit de "relier" deux motifs S2O3 en les "attachant" par l'atome de Soufre latéral.
On complète ensuite par les doublets libres en tenant compte de la valence des atomes O et S.
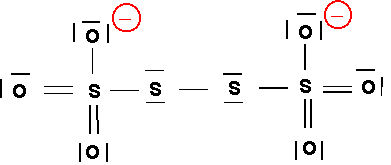
On peut aussi construire le schéma de Lewis sous forme de cases quantiques :
* Préciser sa géométrie par un schéma clair et quelques explications.(0,5 point)
Les atomes de Soufre ont des types moléculaires AX4 ou AX2E2.
Dans les deux cas la figure de répulsion correspondante est le tétraèdre.
On a donc affaire à deux tétraèdres attachés par un sommet.
Tous les angles seront proches de 109,5°.
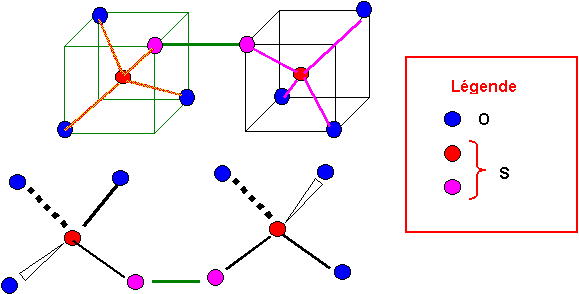
Les doublets libres ne sont pas représentés, mais ils pointent eux aussi dans les directions d'un tétraèdre.
* Déterminer les nombres d'oxydation du soufre et de l'oxygène dans les ions Thiosulfate et Tétrathionate.
L'Oxygène étant plus électronégatif que le Soufre on lui attribue tous les électrons des liaisons SO. Dans les liaisons SS les électrons sont partagés équitablement entre les deux atomes de Soufre. On compte ensuite le nombre d'électrons de chaque atome dans la molécule Nm et on le compare avec son nombre normal d'électrons dans l'atome isolé Na. Le nombre d'oxydation de l'atome est égal à la différence Na - Nm.
Ion Tétrathionate ( S4O62- )(0,25 point)
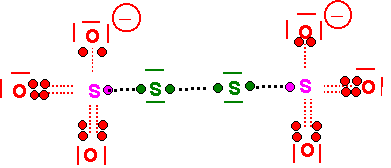
| Atome | Nm | Na | N.O |
| O | 8 | 6 | -2 |
| S | 1 | 6 | +5 |
| S | 6 | 6 | 0 |
Ion Thiosulfate : ( S2O32- )(0,25 point)
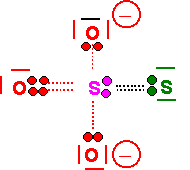
| Atome | Nm | Na | N.O |
| O | 8 | 6 | -2 |
| S | 2 | 6 | +4 |
| S | 6 | 6 | 0 |
On remarque que c'est l'atome de Soufre central qui change de nombre d'oxydation quand on passe de S2O32- à S4O62-.
* Ecrire et équilibrer la 1/2 équation d'oxydoréduction du couple S2O32-/S4O62-
Préciser quel est l'oxydant et quel est le réducteur.(0,25 point)
S4O62- + 2 e- = 2 S2O32-
S4O62- : N.O = + 6 : Oxydant
S2O32- : N.O = + 5 : Réducteur
2 atomes de Soufre passent du degré d'oxydation +6 au degré d'oxydation +5, il ya donc bien échange de deux électrons.
THERMODYNAMIQUE
On étudie la réaction suivante : A(g) + B(s) = 2 C(g)
Pour diverses températures on a déterminé la constante K de cet équilibre. On a trouvé les valeurs suivantes :
| T (° C) | K |
| 27 | 0,018 |
| 127 | 0,222 |
| 327 | 2,725 |
A(g) + B(s) = 2 C(g)
v = N - R + 2 - f - r
N : Nombre de composés chimiques (ici N = 3)
R : Nombre d'équilibres Chimiques (ici R = 1)
F : Nombre de phases (ici f = 2 car les gaz sont toujours miscibles entre eux et A et C forment une seule phase gazeuse tandis que le solide B forme 1 phase distincte)
r : Nombre de relations particulières (r = 0 dans le cas général)
2 : Correspond aux facteurs P et T si ceux-ci sont bien des facteurs de l'équilibre.
Ici P est bien facteur d'équilibre puisque le nombre de mole gazeuses varie au cours de la réaction (Dng = 2 - 1 = 1).
T est aussi facteur de l'équilibre puisque K varie avec la température (DRH0 n'est pas nul)
v = 3 - 1 + 2 - 2 - 0 = 2
Cela signifie pratiquement qu'il suffit de fixer deux variables pour que les autres soient déterminées et donc calculables.
C'est effectivement le cas, si par exemple on se fixe T (K est alors fixé) et P.
On pourra déterminer PC et PA.
A(g) + B(s) = 2 C(g)
| A | B | C | |
| E.I | a | b | c |
| E.F | a - x | b - x | c - x |
nt = a - x + c + 2x = a + c + x (On ne décompte que les moles gazeuses)
K = aC2 / (aA * aB)
aC = PC/P0 ; aA = PA /P0et aB = 1 (B solide pur dans sa phase)
Remarque : P0 = 1 si les pressions sont exprimées en bars ce que nous supposerons par la suite pour alléger l'écriture.
K = PC2 / PA
PC = (c + 2x)P / (a + c + x)
PA = (a - x )P / (a + c + x )
K = {(c + 2x)2 P2/ (a + c + x)2} * {(a + c + x ) / (a - x )P} = (c + 2x)2 P / {(a + c + x ) (a - x )}
P et K sont fixés, a et c sont des données connues et x est donc calculable par la résolution de cette équation.
PA et PC sont donc calculables eux aussi.
La connaissance préalable de P et T est donc suffisante pour que toutes les variables soient fixées et la variance est bien de 2.
2 C(g) = A(g) + B(s)
| C | A | B | |
| E.I | c | 0 | 0 |
| E.F | c - 2 x | x | x |
Il y a ici un petit piège :
Le nombre de moles de A est obligatoirement égal au nombre de moles de B.
On pourrait croire que les pressions partielles de A et de B étant forcément égales, il existerait donc une relation particulière PA = PB. Mais le composé B étant solide sont activité est l'unité et il n'intervient pas dans l'équilibre. La variance reste donc la même.
On voit que K augmente quand T augmente.
Cette réaction est donc favorisée (dans le sens 1) par une élévation de température.
Le principe de Le Chatelier indique que cette réaction est Endothermique et DRH0 est donc positif.
A(g) + B(s) = 2 C(g)
L'entropie est une mesure du désordre. Il suffit donc de voir si le désordre augmente ou diminue au cours de la réaction pour déduire le sens d'évolution de l'entropie et donc le signe de DRS0. Plusieurs facteurs sont à considérer :
Le nombre total de moles : ici il ne varie pas et n'est donc pas un facteur à considérer pour une variation du désordre.
La nature physique des réactif et des produits : On passe d'une mole de gaz et une mole de solide à deux moles de gaz. Il y a donc augmentation du nombre de moles gazeuses et comme les gaz sont par nature plus désordonnés que les solides le désordre augmente.
On peut aussi remarquer que l'on passe de deux réactifs de natures différentes (A et B) à un seul produit C. Selon ce critère l'état final semble donc plus ordonné que l'état initial.
De tous ces facteurs c'est la nature physique des réactifs et des produits qui est de loin le plus important, c'est donc ce facteur qui fixe le sens de variation de l'entropie.
L'entropie augmente donc au cours de la réaction et DRS0 est positif.
3)
a) Déterminer les valeurs de DRH0 et DRS0
(on pourra faire une résolution graphique si on le désire sur la feuille de papier millimétrée).
On donne R = 8,314 J mol-1 K-1
DRG0 = DRH0 - TDRS0
DRG0 = - RT ln K
-RT ln K = DRH0 - TDRS0
RT ln K = -DRH0 + TDRS0
ln K = -(DRH0/RT) + (DRS0/R)
ln K = -(DRH0/R) (1/T )+ (DRS0/R)
Si on porte Ln K en fonction de (1/T) on obtient une droite de pente -(DRH0/R) et d'ordonnée à l'origine (DRS0/R) (0,5 point)
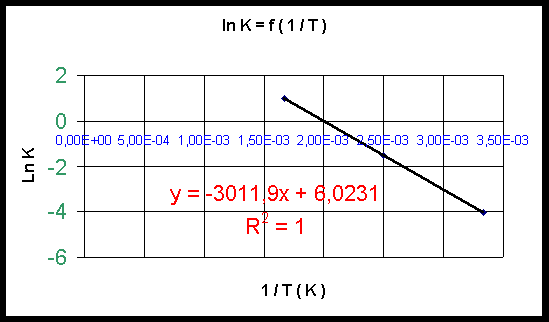
(0,5 point)
Pente : -(DRH0/R) = -3012
DRH0 = 3012 * 8,314 = 25042 J mol-1 K-1
DRH0 = 25 KJ mol-1 K-1 (0,5 point)
Ordonnée à l'origine : (DRS0/R) = 6,0231
(DRS0/R) = 6,0231 * 8,314 = 50,08 J mol-1
DRS0 = 50 J mol-1 (0,5 point)
On appelle température d'inversion d'un équilibre la température pour laquelle sa constante est égale à l'unité. Déterminer la température d'inversion de cet équilibre.
K = 1 è ln K = 0 è DRG0 = 0 è DRH0 = T DRS0 è T = DRH0 / DRS0
T = 25000/50 = 500 K (0,5 point)
4) Prévoir qualitativement l'influence d'une augmentation de pression sur cet équilibre.
A(g) + B(s) = 2 C(g)
Le principe de Le Chatelier indique qu'une augmentation de pression fait déplacer l'équilibre dans le sens de la diminution du nombre de moles gazeuses. Pour cet équilibre, le nombre de mole gazeuse diminue dans le sens 2.
Une augmentation de pression déplacera l'équilibre dans le sens 2 c'est à dire le sens de dissociation de C. (0,5 point)
5) Prévoir qualitativement l'influence à pression constante :
DRG = DRG0 + RT ln Q avec Q = p aini
A l'équilibre DRG=0 et Q = K è DRG = DRG0 + RT ln K è DRG0 = -RT ln K
DRG = -RT ln K + RT ln Q = RT ln (Q / K)
K est une constante ne dépendant que de la température (loi d'action des masses).
Pour juger de l'influence d'un facteur quelconque sur l'équilibre, il suffit d'envisager son effet sur la valeur de Q.
Q = aC2 / (aA * aB)
aC = PC ; aA = PA et aB = 1 (B solide pur dans sa phase)
Q = PC2 / PA
Par définition, la pression partielle d'un gaz dans un mélange est la pression qu'il aurait s'il occupait seul le volume occupé par le mélange.
P = nt RT/V
Pi = ni RT/V
Pi = ni P/nt = xi P (xi = fraction molaire de i)
PA = nAP/nt
PC = nCP/nt
Q=(nCP/nt)2nt/nAP=P(nC2/nAnt)
Ici l'introduction de A fait augmenter nA et nt, nC reste constant, P reste constante.
Q = P(nC2/nAnt) va donc diminuer.
DG va donc diminuer, si on suppose qu'on était à l'équilibre au moment de l'ajout du A supplémentaire on voit que DG devient négatif. L'équilibre se déplace donc dans le sens 1.
Remarque : Un autre raisonnement est possible, il suffit de considérer que la fraction molaire est équivalente au pourcentage en nombre de mole. Le fait d'ajouter un réactif en maintenant le nombre de mole de l'autre réactif constant (ici ajouter A en maintenant nC constant) revient a augmenter la fraction molaire du réactif ajouté et à abaisser la fraction molaire de l'autre (ici xA augmente et xC diminue). Comme les pressions partielles sont proportionnelles aux fractions molaires (puisque on travaille à pression totale constante) PA augmente et PC diminue. Q = PC2/PA diminue donc bien.
B est un solide, son activité est l'unité puisqu'il est pur dans sa phase.
B n'apparaît pas dans l'expression de Q et n'a donc pas d'influence sur celui-ci.
L'équilibre n'est pas modifié.
L'introduction de C fait augmenter nC et nt, nA et P restent constants.
Q = P(nC2/nAnt) = (P/nA)(nC2/nA+nC) va augmenter car le terme nC2 du numérateur augmente plus rapidement que le terme (nA + nC) du dénominateur. La fonction représentant Q est une parabole croissante car nA et nC qui sont des nombre de moles sont forcément positifs.
DG va donc augmenter, si on suppose qu'on était à l'équilibre au moment de l'ajout du C supplémentaire on voit que DG devient positif. L'équilibre se déplace donc dans le sens 2.
Remarque : Comme précédement un autre raisonnement est possible, il suffit de considérer que la fraction molaire est équivalente au pourcentage en nombre de mole. Le fait d'ajouter un réactif en maintenant le nombre de mole de l'autre réactif constant (ici ajouter C en maintenant nA constant) revient a augmenter la fraction molaire du réactif ajouté et à abaisser la fraction molaire de l'autre (ici xC augmente et xA diminue). Comme les pressions partielles sont proportionnelles aux fractions molaires (puisque on travaille à pression totale constante) PC augmente et PA diminue. Q = PC2/PA augmente donc bien.
6) Pour vérifier les prévisions de la question 4) on introduit dans un réacteur 1 mole de A et un très grand excès de B.
Déterminer le nombre de mole de A et C à l'équilibre.(0,75 point)
A(g) + B(s) = 2 C(g)
| A | B | C | |
| E.I | 1 | Excés | 0 |
| E.F | 1 - x | 2 x |
nt = 1 - x + 2x = 1 + x
K = PC2 / PA
PC = 2x P / ( 1 + x )
PA = (1 - x ) P / (1 + x )
K = {( 2x )2 P2/ (1 + x)2} * {(1+ x ) / (1 - x )P} = (2x)2 P / {(1 + x ) (1 - x ) }
K = 4 x2 P / {(1 + x ) (1 - x)} = 4 x2 P/ (1- x2)
K - Kx2 = 4 x2P
K = 4 Px2+ Kx2 = x2 ( 4P + K )
x2 = K / ( 4 P+ K )
Application Numérique
T = 127 °c è K = 0,222
P = 1 bar
x2 = 0,222 / 4,222 = 0,0525
x = 0,229
nC = 2 * 0,229 = 0,458 mole
nA = 1 - 0,229 = 0,771 mole
Déterminer le nombre de mole de A et C à l'équilibre.(0,75 point)
x2 = K / ( 4 P+ K )
Application Numérique
T = 127 °c è K = 0,222
P = 2 bars
x2 = 0,222 / 8,222 = 0,027
x = 0,164
nC = 2 * 0,164 = 0,328 mole
nA = 1 - 0,164 = 0,836 mole
Sous une pression de 2 bars, le nombre de mole de C formé est inférieur à celui obtenu sous une pression de 1 bar. L'augmentation de pression à déplacé l'équilibre dans le sens 2.
C'est bien ce qui avait été prévu qualitativement.
A(g) + B(s) = 2 C(g)
| A | B | C | |
| E.I | 1 | Excés | 1 |
| E.F | 1 - x | 1 + 2 x |
nt = 1 - x + 1 + 2x = 2 + x
K = PC2 / PA
PC = (1+ 2x) P / ( 2 + x )
PA = (1 - x ) P / ( 2 + x )
K = {( 1 + 2x )2 P2/ ( 2 + x )2} * {( 2+ x ) / (1 - x )P} = (1 + 2x)2 P / {( 2 + x ) ( 1 - x ) }
K = (1 + 2 x)2 P / {(2 + x ) (1 - x)}
Avec P = 1 bar
K = (1 + 2 x)2 / {(2 + x ) (1 - x)}
La résolution donne x = - 0,156
nC = 1 + (2 * -0,156) = 0,688 mole
nA = 1 - (-0,156) = 1,156 moles
b) Le résultat est-il en accord avec celui de la question 5-c) (0,5 point)
La valeur négative obtenue pour x montre qu'il y a dissociation de C et donc évolution dans le sens 2.
C'est bien ce qui avait été prévu qualitativement.