SEPTEMBRE 2000 – Rattrapage Deuxième Période – ATOMISTIQUE
SUJET
Question de cours :
Pourcentage d'ionicité d'une liaison :
Définir et expliquer cette notion.
Exercice 1 :
Exercice 2 :
Un peu d’histoire :
La notion d'isomérie fut introduite par Berzélius, Wohler et Liebig en 1823. Wohler travaillait sur l’acide cyanique qu’il obtint à partir du cyanate d’argent et dans le même temps Liébig synthétisait l’acide fulminique à partir du fulminate de mercure un explosif puissant. Ces deux composés étaient bien différents l’un de l’autre de par leurs propriétés chimiques et pourtant les deux chimistes arrivèrent à une formule brute identique CHNO pour ces deux acides. Berzélius leur demanda de vérifier leurs résultats car il paraissait à l’époque impossible que deux composés soient si différents chimiquement et possèdent une même formule. Les deux savants refirent leurs expériences et conclurent qu’il s’agissait bien de deux composés différents ayant la même formule. Ce fut le premier cas d’isomérie qui fut découvert et Berzélius émit l’hypothèse que c’était la manière dont les atomes s’unissaient entre eux qui était différente et conduisait à des propriétés chimiques différentes. Les chimistes furent alors amenés à s’intéresser à la structure spatiale des molécules et non plus seulement à leur formule brute. Ce fut un pas décisif dans l’histoire de la Chimie…
Questions :
1) Acide fulminique :
L’enchaînement des atomes est le suivant : C N O H
a) Donner le schéma de Lewis d'une forme mésomère ne faisant pas apparaître de charges formelles mais n'obéissant pas à la règle de l'octet . Préciser la géométrie.
b) Donner le schéma de Lewis d'une forme mésomère obéissant à la règle de l'octet mais faisant apparaître des charges formelles . Préciser la géométrie.
2) Acide Cyanique et ion cyanate :
L’enchaînement des atomes est le suivant : N C O H
Donner le schéma de Lewis correspondant . Préciser la géométrie.
Donner le schéma de Lewis de l’ion cyanate NCO-
3) Mésomérie de l'ion cyanate
Pour cet ion montrer qu’on peut écrire une forme mésomère pour laquelle la charge négative n’est pas portée par l’atome d’oxygène mais par l’atome d’azote.
4) Acide isocyanique :
La deuxième forme mésomère de l’ion cyanate est appelée ion isocyanate. Cet ion peut théoriquement conduire à l’acide isocyanique isomère des acides cyanique et fulminique. Donner le schémas de Lewis de cet acide isocyanique.
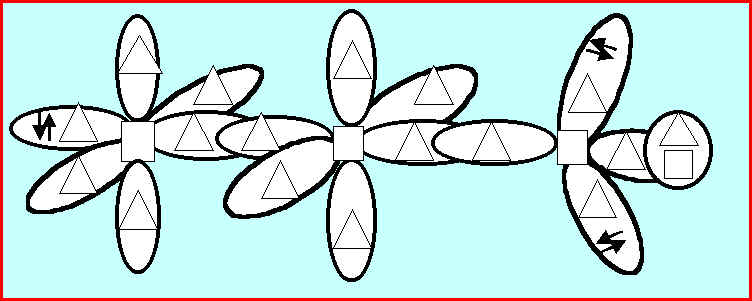
5) Hybridation des orbitales atomiques
On donne sous forme de schéma incomplet une représentation symbolique dans le formalisme de la mécanique quantique par utilisation d’orbitales atomiques hybrides. Complétez ce schéma en indiquant : dans le rectangle prévu a cet effet le symbole des atomes (C, H, N, O), dans le triangle prévu a cet effet le nom (s, p, sp, sp2, sp3 etc) des diverses orbitales atomiques , le nom de l’acide représenté : cyanique – isocyanique ou fulminique. Indiquez aussi la nature des diverses liaisons (s, p) et leur mode de formation.
