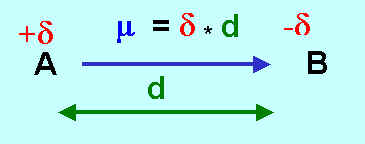
SEPTEMBRE 2000 – Rattrapage Deuxième Période – ATOMISTIQUE
CORRIGE
Question de cours :
Pourcentage d'ionicité d'une liaison :
Définir et expliquer cette notion.
On exprime l'ionicité d'une liaison par son pourcentage d'ionicité.
Sa détermination nécessite la connaissance du moment dipolaire de liaison et de la longueur de celle-ci.
m = d * d soit d = m / d
Si d = 0 la liaison est purement covalente.
Si d = e = 1,6 10-19 C la liaison est purement ionique.
Le rapport d /e mesure directement le pourcentage d'ionicité de la liaison, par exemple :
si d / e = 0,5 on dira que la liaison est ionique à 50 %.
%IAB = 100 * d / e = 100 m / de
%IAB = 100 * m (C.m ) / d ( m ) / e ( C )
Soit en utilisant les unités courantes : %IAB = 20,8 * m (D) / d ( Å )
Exercice 1 :
Décrire la molécule de dichlore Cl2 dans le modèle C.L.O.A -O.M (combinaison linéaire d'orbitales atomiques -orbitales moléculaires)
Le Chlore est un halogène, sa couche de valence est donc de type s2 p5. On suppose qu'il n'y a pas d'intéractions sp. Il y a au total 14 électrons à placer dans les orbitales moléculaires.
Le schéma C.L.O.A - O.M est donc le suivant :
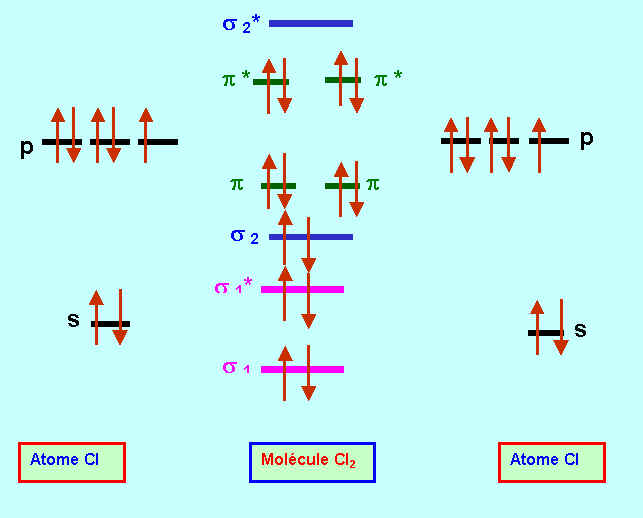
La longueur de liaison mesurée expérimentalement pour la molécule Cl2 dans son état fondamental est de 199 pm. Pour l'ion moléculaire Cl2+ on trouve une distance de liaison de 189 pm seulement. Pour le premier état excité de la molécule Cl2 la distance de liaison est de 247 pm. Expliquer ces variations. (1 pm = 10-12 m)
Comparaison Cl2 / Cl2+
On arrache un électron de l'O.M la plus élevée en énergie, il s'agit ici d'une orbitale anti-liante p*.
On stabilise donc la molécule, l'indice de liaison est augmenté et la liaison est raccourcie.
nl(Cl2) = ( 8 - 6 ) / 2 = 1
nl(Cl2+) = ( 8 - 5 ) / 2 = 1,5
On passe ainsi de 199 pm pour Cl2 à 189 pm pour Cl2+.
Comparaison Cl2 / Cl2*
La seule possibilité d'excitation est le saut d'un électron p* en s*
L'énergie de la molécule est augmentée. On déstabilise donc la molécule, et la liaison est rallongée.
On passe ainsi de 199 pm pour Cl2 à 247 pm pour Cl2*.
Exercice 2 :
Un peu d’histoire :
La notion d'isomérie fut introduite par Berzélius, Wohler et Liebig en 1823. Wohler travaillait sur l’acide cyanique qu’il obtint à partir du cyanate d’argent et dans le même temps Liébig synthétisait l’acide fulminique à partir du fulminate de mercure un explosif puissant. Ces deux composés étaient bien différents l’un de l’autre de par leurs propriétés chimiques et pourtant les deux chimistes arrivèrent à une formule brute identique CHNO pour ces deux acides. Berzélius leur demanda de vérifier leurs résultats car il paraissait à l’époque impossible que deux composés soient si différents chimiquement et possèdent une même formule. Les deux savants refirent leurs expériences et conclurent qu’il s’agissait bien de deux composés différents ayant la même formule. Ce fut le premier cas d’isomérie qui fut découvert et Berzélius émit l’hypothèse que c’était la manière dont les atomes s’unissaient entre eux qui était différente et conduisait à des propriétés chimiques différentes. Les chimistes furent alors amenés à s’intéresser à la structure spatiale des molécules et non plus seulement à leur formule brute. Ce fut un pas décisif dans l’histoire de la Chimie…
Questions :
L’enchaînement des atomes est le suivant : C N O H
a) Donner le schéma de Lewis d'une forme mésomère ne faisant pas apparaître de charges formelles mais n'obéissant pas à la règle de l'octet . Préciser la géométrie.
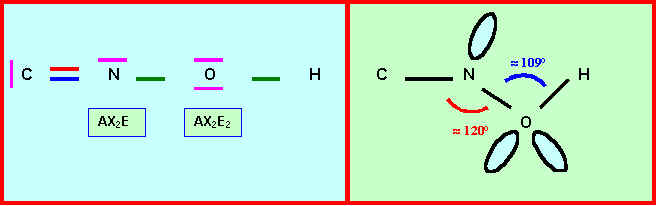
b) Donner le schéma de Lewis d'une forme mésomère obéissant à la règle de l'octet mais faisant apparaître des charges formelles . Préciser la géométrie.
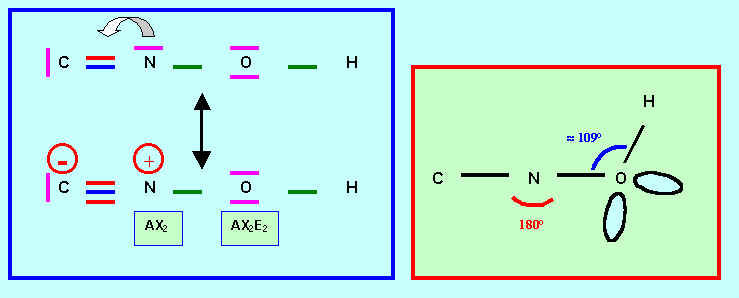
L’enchaînement des atomes est le suivant : N C O H
Donner le schéma de Lewis correspondant . Préciser la géométrie.
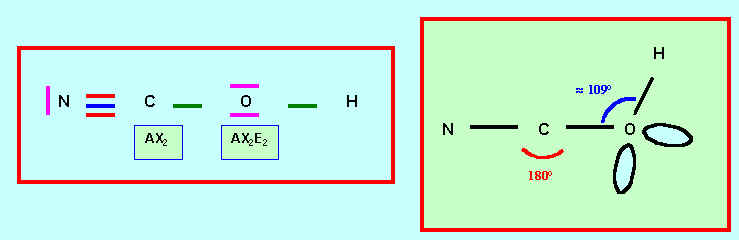
Donner le schéma de Lewis de l’ion cyanate NCO-
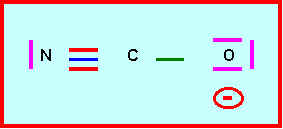
3) Mésomérie de l'ion cyanate
Pour cet ion montrer qu’on peut écrire une forme mésomère pour laquelle la charge négative n’est pas portée par l’atome d’oxygène mais par l’atome d’azote.
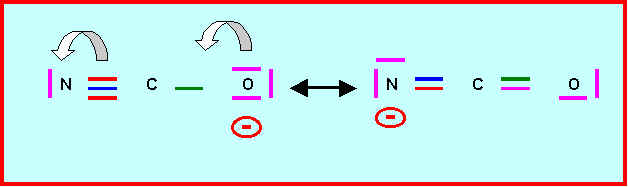
4) Acide isocyanique :
La deuxième forme mésomère de l’ion cyanate est appelée ion isocyanate. Cet ion peut théoriquement conduire à l’acide isocyanique isomère des acides cyanique et fulminique. Donner le schémas de Lewis de cet acide isocyanique.

5) Hybridation des orbitales atomiques
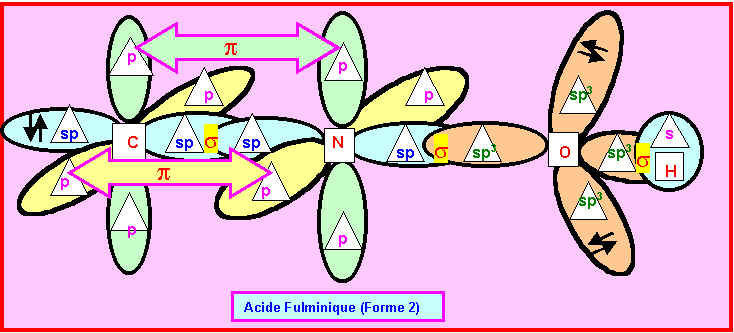
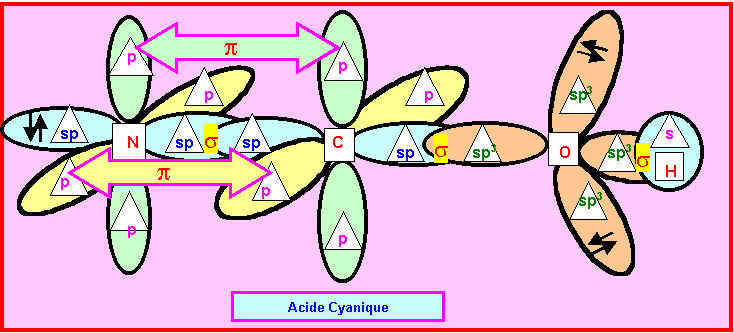
On donne sous forme de schéma incomplet une représentation symbolique dans le formalisme de la mécanique quantique par utilisation d’orbitales atomiques hybrides. Complétez ce schéma en indiquant : dans le rectangle prévu a cet effet le symbole des atomes (C, H, N, O), dans le triangle prévu a cet effet le nom (s, p, sp, sp2, sp3 etc) des diverses orbitales atomiques , le nom de l’acide représenté : cyanique – isocyanique ou fulminique. Indiquez aussi la nature des diverses liaisons (s, p) et leur mode de formation.
Rappelons les diverses possibilités obtenues :
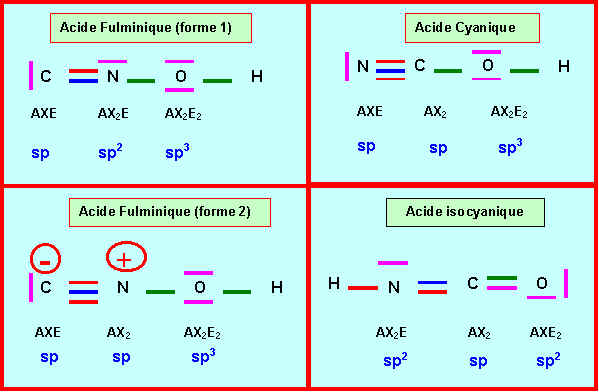
Rappelons les trois types d'hybridations sp3, sp2 et sp
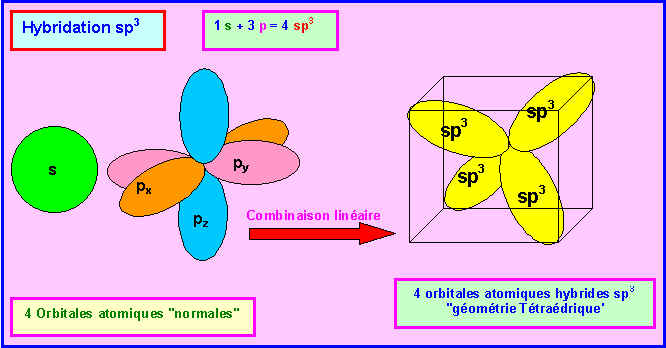
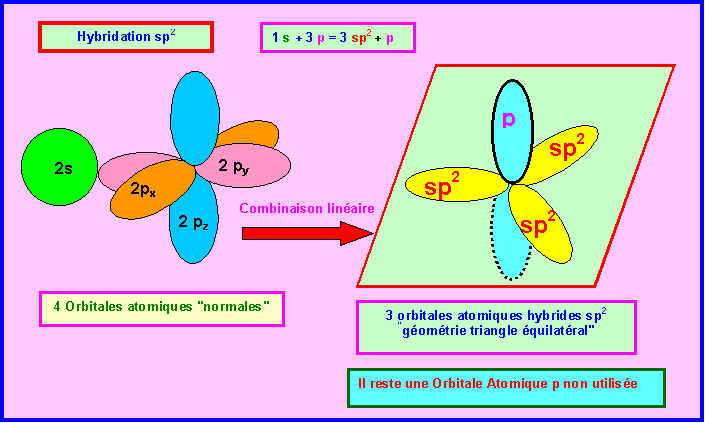
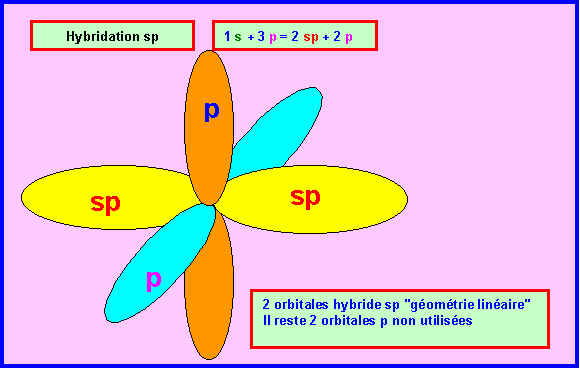
Comme de plus les doublets libres sont figurés sur le schéma fournit il n'est pas difficile d'identifier les divers atomes. L'atome le plus à droite ne peut être que l'atome d'Hydrogène. L'atome possédant deux doublets libres ne peut être que l'atome d'Oxygène. Puisque H et O sont directement liés, l'acide représenté ne peut être l'acide isocyanique qui possède une liaison N-H. Les deux atomes restant sont obligatoirement C et N et présentent une hybridation de type sp. L'acide fulminique sous sa forme 1 présentant un Azote de type sp2 doit donc être éliminé. Il reste finalement deux possibilités soit l'acide cyanique soit l'acide fulminique sous sa forme 2.