Thierry Briere : www.chimie-briere.com
Session de Septembre 2004
Première Année D.E.U.G : SM - SV - ST - STPI - Chimie 21
Initiation à la Chimie Théorique - Atomistique
ELEMENTS DE LA COLONNE 17
1) Complétez le tableau :
Nom |
Symbole |
Z |
Configuration électronique [gaz rare] + couches externes |
Fluor |
|||
Chlore |
|||
Brome |
|||
Iode |
|||
Astate |
At |
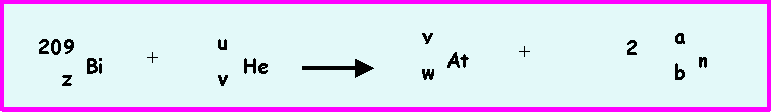
Pour l'obtenir, il a bombardé un noyau de Bismuth (209Bi) par une particule alpha. On obtient un noyau d'Astate (yAt) et 2 neutrons qui sont éjectés.
Processus qu'on peut écrire :

On demande de déterminer les valeurs de a,b,u,v,w,y et z
B) Composés hydrogénés :
Le tableau suivant rassemble quelques données sur les composés hydrogénés des éléments de la colonne 17 : HF, HCl, HBr et HI.
HF |
HCl |
HBr |
HI |
|
| Température d'ébullition (K) : | 292,7 |
189 |
206,1 |
238, 1 |
| Moment dipolaire (D) | 1,74 |
1,07 |
0,79 |
0,38 |
| Energie de liaison (kJ.mol-1) | 574 |
428 |
362 |
295 |
| Masse molaire (g.mol-1) | 20,0 |
36,5 |
80,9 |
127,9 |
Un de ces composés présente un point d'ébullition "anormal". Lequel ?
Comment peut-on justifier cette anomalie ? Quel devrait être approximativement son point d'ébullition "normal" ?
Suggestion : Pour répondre, on pourra tracer un graphique. On précisera les grandeurs portées en abscisses et en ordonnées.

C) Quelques composés des éléments de la colonne 17 :
Pour les composés suivants, proposer un schéma de Lewis, en déduire la géométrie du composé et le représenter dans l'espace. Vérifiez sans calculs que la valeur approximative du moment dipolaire global de chaque composé est bien conforme à celle donnée dans le tableau.
Atome souligné central
Composé |
ClF3 |
ICl4- |
BrF5 |
I3- |
Moment dipolaire global |
m = mFCl |
m = 0 |
m = mFBr |
m = 0 |
Thierry Briere : www.chimie-briere.com