Thierry Briere : www2.univ-reunion/~briere
Session de
Septembre 2004
Première Année
D.E.U.G : SM - SV - ST - STPI - Chimie 21
Initiation à la
Chimie Théorique - Atomistique - Thierry Briere
ELEMENTS DE LA COLONNE 17 : CORRIGE
- Les
atomes :
1) Complétez le tableau :
Nom
|
Symbole
|
Z
|
Configuration
électronique
[gaz rare] + couches externes
|
Fluor
|
F
|
9 |
[He] 2s2 2p5
|
Chlore
|
Cl
|
17
|
[Ne] 3s2 3p5
|
Brome
|
Br
|
35
|
[Ar] 3d10 4s2 4p5
|
Iode
|
I
|
53
|
[Kr] 4d10 5s2 5p5
|
Astate
|
At
|
85
|
[Xe] 4f14 5d10 6s2 6p5
|
2) Si on découvre un jour un nouvel élément de la
colonne 17, quel seront son numéro atomique et sa configuration
électronique ?
Z = 117 : [Rn] 5f14 6d10 7s2 7p5Pour remplir le tableau facilement
il suffit de connaître Z des gaz rares et
d'enlever un électron, pour en déduire Z et
configuration de l'Halogène situé juste avant
en colonne 17. Si on ne connaît pas les Z des
gaz rares "par cœur" il suffit de
compter les électrons à partir du tableau de
Klechkowski. La liste des gaz rares (Hélium
-Néon - Argon - Krypton - Xénon) doit en
revanche être connue "par cœur".
Ainsi que la place des gaz rares dans la
classification (colonne 18) et dans le tableau de
Klechkowski.

3) Le brome possède
seulement deux isotopes stables. L'isotope le
plus abondant est 79Br dont
l'abondance naturelle est de 50,5%. La masse
molaire du Brome naturel est de 79,91 g.mol-1.
Quel est l'autre isotope stable du brome ?
Appelons x le nombre de masse de l'isotope
inconnu.
Faisons les approximations habituelles :
- mp » mn » 1 u.m.a
- Masse des électrons et défaut de
masse négligeable
Soit Mi » Ai
M = S xi Mi
M » S xi Ai
79,91 = 0,505 * 79 + ( 1 - 0,505 ) * x
79,91 = 39,895 + 0,495 * x
79,91 - 39,895 = 0,495 * x
40,015 = 0,495 x
x = 40,015 / 0,495 = 80,838 » 81
L'isotope stable
cherché est 81Br.
4) Il existe aussi un isotope radioactif 80Br
qui est émetteur b+ et /ou émetteur b- selon deux
réactions différentes. Justifier la "double
radioactivité" de cet isotope et compléter les deux
réactions nucléaires.
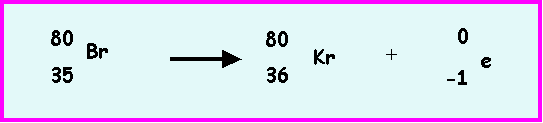
Réaction 1 : 80Br è 80Kr
Réaction 2
: 80Br
è 80Se
Par rapport aux deux isotopes stables 79Br
(35 protons et 44 neutrons) et 81Br (35 protons et 46
neutrons) on voit que 80Br (35 protons et 45 neutrons)
est "intermédiaire".
Il pourra donc se stabiliser soit :
- en transformant un neutron en proton
(émission b-) pour "ressembler" à 79Br.
On obtient alors l'isotope 80Kr
de l'élément suivant le brome dans la classification (Krypton Z
= 36).
Réaction 1 :
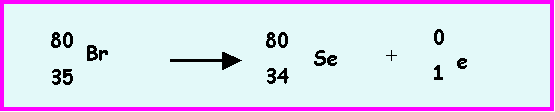
- En transformant un proton en neutron
(émission b+) pour "ressembler" à 81Br.
On obtient alors l'isotope 80Se
de l'élément précédant le brome dans la classification
(Sélénium Z = 34).
Réaction 2 :
5) L'Astate (du grec astatos = instable)
est comme son nom l'indique un élément artificiel radioactif.
L'Astate à été obtenu pour la première fois par Segre en
1940.
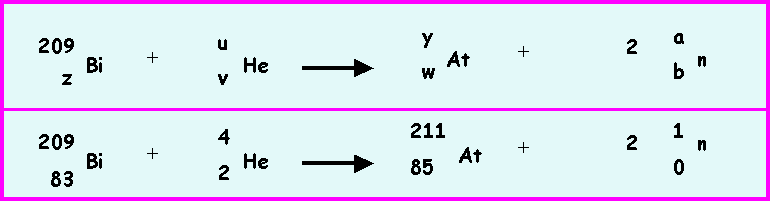
Pour l'obtenir, il a bombardé un noyau de
Bismuth (209Bi) par une particule alpha.
On obtient un noyau d'Astate (yAt)
et 2 neutrons qui sont éjectés.
Processus qu'on peut écrire :
On demande de déterminer les valeurs de
a,b,u,v,w,y et z
B ) Composés hydrogénés :
Le tableau suivant rassemble quelques
données sur les composés hydrogénés des éléments de la
colonne 17 : HF, HCl, HBr et HI.
| |
HF
|
HCl
|
HBr
|
HI
|
Température
d'ébullition (K) :
|
292,7
|
189
|
206,1
|
238, 1
|
Moment dipolaire (D)
|
1,74
|
1,07
|
0,79
|
0,38
|
Energie de liaison (kJ.mol-1)
|
574
|
428
|
362
|
295
|
Masse molaire (g.mol-1)
|
20,0
|
36,5
|
80,9
|
127,9
|
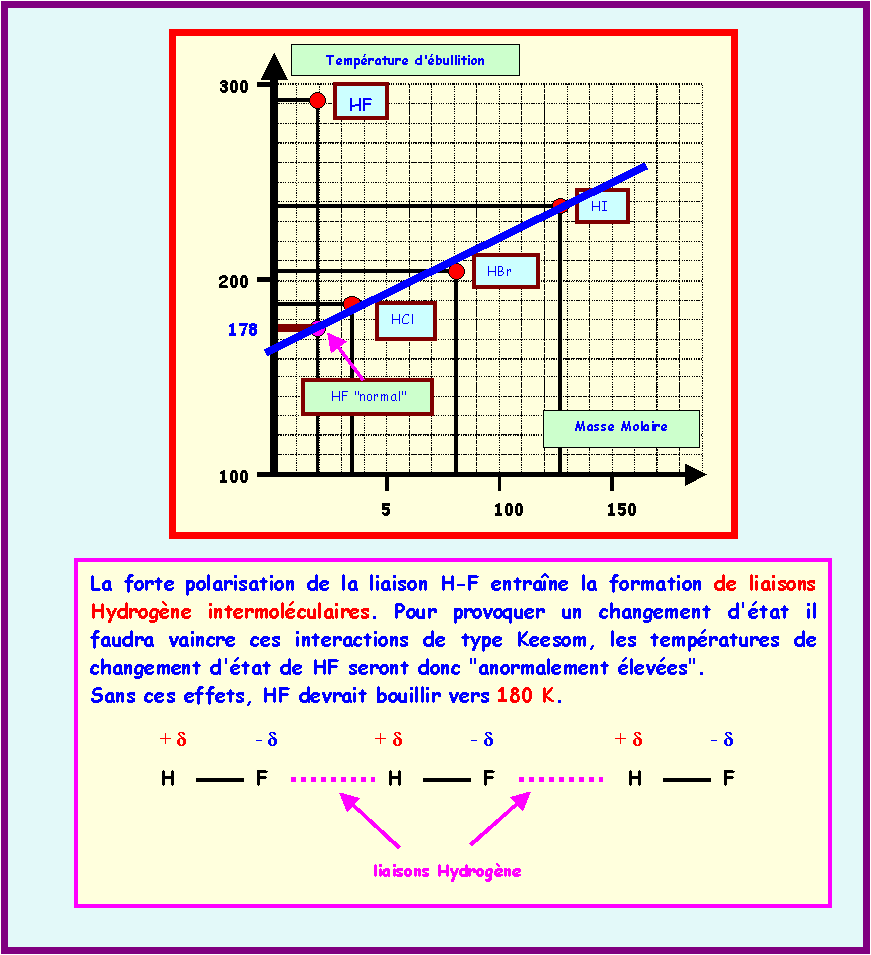
L'un de ces composés présente un point
d'ébullition "anormal". Lequel ?
Comment peut-on justifier cette anomalie
? Quel devrait être approximativement son point d'ébullition
"normal" ?
Suggestion : Pour répondre,
on pourra tracer un graphique. On précisera les grandeurs
portées en abscisses et en ordonnées.
C) Quelques
composés des éléments de la colonne 17 :
Pour les composés suivants,
proposer un schéma de Lewis, en déduire la géométrie du
composé et le représenter dans l'espace. Vérifiez sans calculs
que la valeur approximative du moment dipolaire global de chaque
composé est bien conforme à celle donnée dans le tableau.
Composé
|
ClF3
|
ICl4-
|
BrF5
|
I3-
|
Moment dipolaire global
|
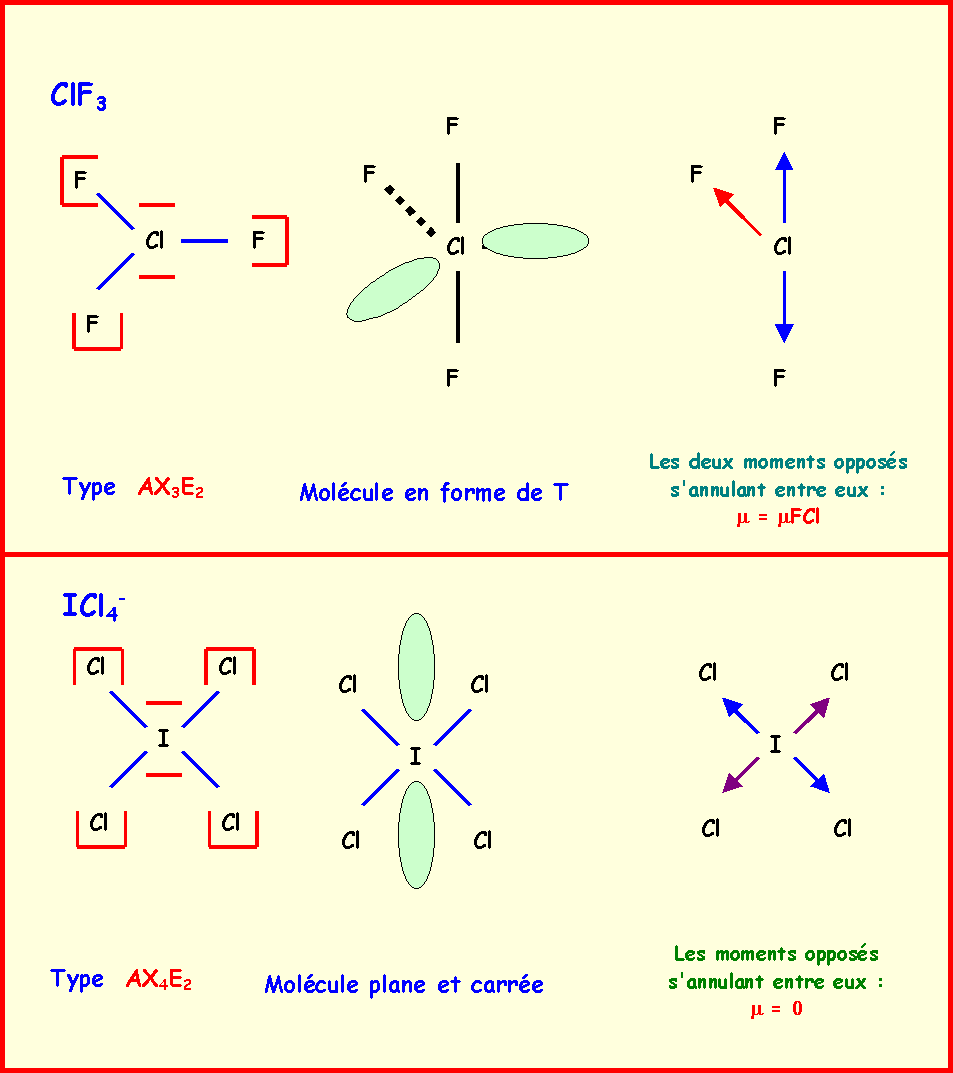
m = mFCl
|
m = 0
|
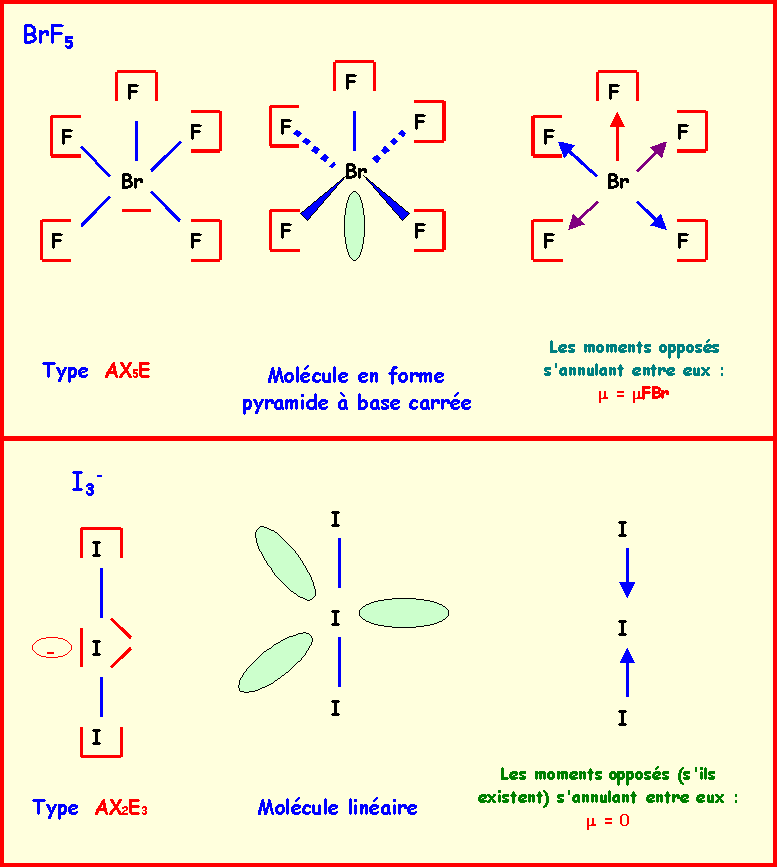
m = mFBr
|
m = 0
|
Les Halogènes possèdent tous 7
électrons sur leur couche de valence.
Les halogènes latéraux feront
donc chacun une liaison et posséderont trois doublets libres.
ClF3
* Dans ClF3, le chlore
central fera donc trois liaisons et aura deux doublets libres.
Type AX3E2,
bi-pyramide à base triangle avec deux sommets manquants, les
doublets libres encombrants se placent en équatorial, la
molécule aura donc la forme d'un T.
ICl4-
* Dans ICl4-,
l'iode central (7 + 1 = 8 électrons) fera donc quatre liaisons
et aura deux doublets libres.
Type AX4E2,
bi-pyramide à base carrée (octaèdre) avec deux sommets
manquants. Les deux doublets libres se placent à l'opposé l'un
de l'autre.
La molécule aura donc la forme
d'un carré.
BrF5
* Dans BrF5, le brome
central fera donc cinq liaisons et aura un doublet libre.
Type AX5E, bi-pyramide
à base carrée (octaèdre) avec un sommet manquant.
La molécule aura donc la forme
d'une pyramide à base carrée.
I3-
* Dans I3-,
l'iode central (7 + 1 = 8 électrons) fera donc deux liaisons et
aura trois doublets libres.
Type AX2E3,
bi-pyramide à base triangle avec trois sommets manquants, les
doublets libres encombrants se placent en équatorial, la
molécule sera donc linéaire.
Thierry Briere : www2.univ-reunion/~briere






