CORRIGE
DONNEES :
Volume Molaire du gaz parfait : 22,4 L.mol-1 sous P = 1 atm et à 0°C
Masses Molaires Atomiques :
H = 1 g.mol-1 - N = 14 g.mol-1 - O = 16 g.mol-1 - Zn = 65,4 g.mol-1
Ag = 108 g.mol-1 - Au = 197 g.mol-1 – Cl = 35,5 g.mol-1
Numéro atomiques : Zn = 30 - Ag = 47 - Au = 79
Potentiels de référence d'oxydoréduction :
H+/H2 = 0 v - Zn2+/Zn = -0,76 v - Ag+/Ag = 0,8 v - Au+/Au = 1,68 v - HNO3/NO = 1 v
Remarques :
* Les acides chlorhydrique et nitrique sont en réalité deux acides forts totalement dissociés dans l’eau. HCl = H3O+ + Cl- et HNO3 = H3O+ + NO3-.
On pourra tout de même utiliser les écritures simplifiées HCl et HNO3.
** On supposera dans tout le problème être assez proche des conditions standards pour que les réactions d’oxydoréduction se produisant réellement soient les réactions spontanées dans les conditions standard.
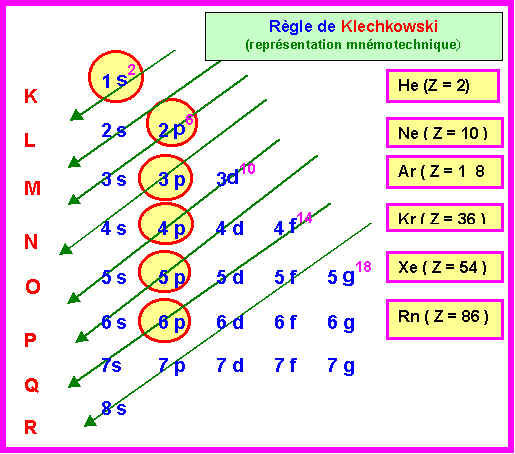
1) Déterminer par utilisation de la règle de Klechkowski les configurations électroniques des éléments Zinc (Zn), Argent (Ag) et Or(Au).

Zn : Z = 30 = 18 +12 : (Ar) 4s2 3d10 : (Ar) 3d10 4s2
Ag : Z = 47 = 36 + 11 = (Kr) 6s2 4d9 : (Kr) 4d9 6s2
Au : Z = 79 = 54 + 25 = (Xe) 6s2 4f14 5d9 : (Xe) 4f14 5d9 6s2
2) Donner le schéma de Lewis (avec cases quantiques) de ces trois éléments.
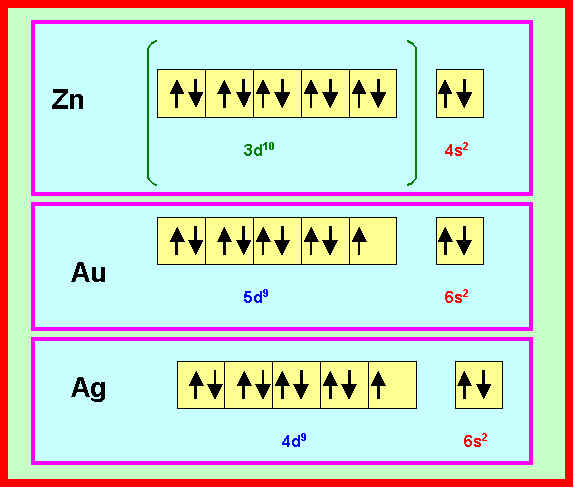
3) Deux de ces éléments sont en fait des exceptions à la règle de Klechkowski.
Quels sont ces éléments ? Donner leur configuration électronique réelle.
Ag et Au ont une sous-couche d avec 9 électrons. Une sous-couche remplie amenant une stabilité supplémentaire, un électron de la sous-couche s " sautera " sur la sous-couche d pour la compléter à 10 électrons. On aura donc pour Ag et Au les configurations électroniques réelles suivantes :
Ag : (Kr) 4d10 6s1 - Au : (Xe) 4f14 5d10 6s1
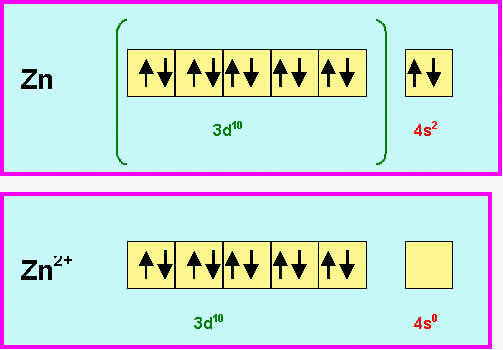
4) Prévoir dans le cas du Zinc la nature de son ion le plus stable et donner la configuration électronique de cet ion.
L’atome de Zinc perdra facilement ses deux électrons 4s pour donner l’ion Zn2+ qui possède une couche 3 d totalement remplie et sera donc très stable.
5) Les ions de Ag et Au sont respectivement Ag+ et Au+.
Montrer qu'il est assez simple de justifier leur formation à partir des configurations électroniques de Ag et Au.
Ag : (Kr) 4d10 6s1 - Au : (Xe) 4f14 5d10 6s1
Ces deux éléments vont perdre facilement leur électron s pour donner les ions Ag+ et Au+, qui seront stables en raison de leur niveau d totalement rempli.
Ag+ : (Kr) 4d10 6s0 - Au+ : (Xe) 4f14 5d10 6s0
B) Application : Détermination de la composition d’un alliage
On traite 30 g d’un alliage Zinc - Argent - Or par un excès d’acide chlorhydrique (HCl) concentré.
1) Montrer que dans ces conditions, seul le Zinc est attaqué par l'acide chlorhydrique alors que l'Argent et l'Or ne réagissent pas.
HCl = H+ + Cl- : H+ est l’oxydant du couple H+/H2
Potentiels de référence d'oxydoréduction :
Zn2+/Zn = -0,76 v - H+/H2 = 0 v - Ag+/Ag = 0,8 v - HNO3/NO = 1 v - Au+/Au = 1,68 v
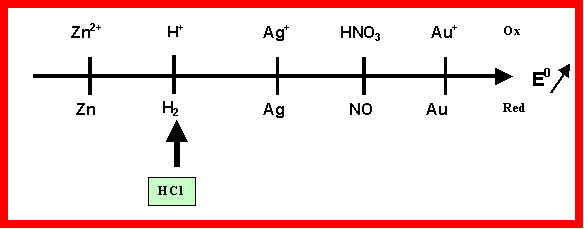
Dans les conditions standard, la réaction spontanée se produisant entre deux couples se prévoit par la règle suivante : L’oxydant le plus fort (de E0 le plus élevé réagit avec le réducteur le plus fort (de E0 le plus faible). On peut retrouver cette règle par le moyen mnémotechnique du a (ou du g).
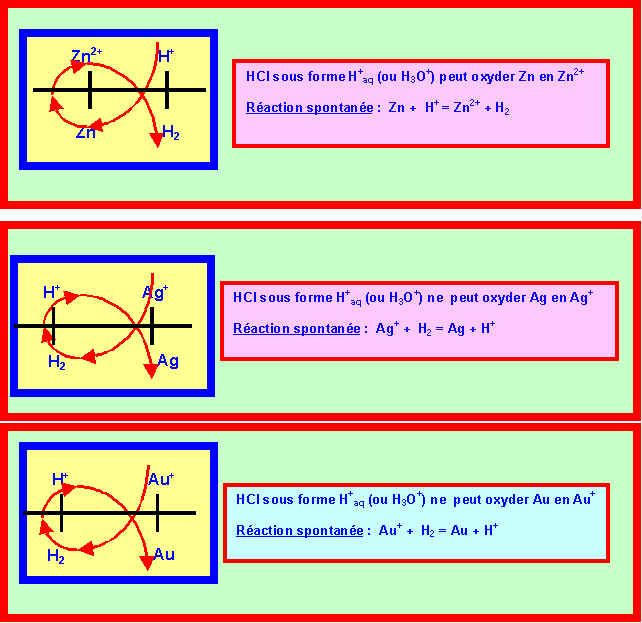
2) Ecrire et équilibrer la réaction qui se produit entre Zn et HCl.
Montrer qu'on peut la considérer comme totale en calculant sa constante d'équilibre.

3) L’acide chlorhydrique commercial est pur à 35 % en masse et sa masse volumique est de 1,043 g/cm3.
1 litre de solution commerciale pèse 1043 g et contient 1043 * 0,35 » 365 g d’acide chlorhydrique pur soit 365 / 36,5 = 10 mole. La molarité de la solution de HCl du commerce est donc C0 » 10 mol.L-1.
b) Quel volume minimal doit-on ici en utiliser pour sur qu’il soit bien en excès ?
Supposons que l’alliage soit du Zinc pratiquement pur.
30 g contiennent donc 30 / 65,4 » 0,46 mole de Zinc.
Il faudra utiliser au minimum 2 * 0,46 = 0,92 » 1 mole de HCl soit 100 ml de solution du commerce.
On récupère le dihydrogène (H2) formé au cours de la réaction.
On en obtient 1158 cm3 à la température de 30°C et sous la pression P = 1 atm.
4) Déterminer la pourcentage massique en Zinc de l’alliage.
Zn + 2 H+ = Zn2+ + H2
Zn |
H+ |
Zn2+ |
H2 |
|
E.I |
n0 |
Excès |
0 |
0 |
E.F |
0 |
Excès |
n0 |
n0 |
Nombre de mole de H2 récupérées :
P V = n R T
n = PV /RT = 1 * 1,158 / 0,082 / 303 = 0,04585 mole
n0 = 0,04585 mole
Masse de Zinc dans 30 g d’alliage :
mZn = 0,04585 * 65,4 = 2,999 g
Pourcentage de Zinc dans l’alliage :
(2,999 / 30) * 100 = 9,995 % » 10 %
Le résidus solide de l'expérience précédante (qui contient toujours l'Or et l'Argent de l'alliage) est traité par un excès d'acide nitrique (HNO3).
5) Montrer que dans ces conditions l'Argent est attaqué par HNO3 alors que l'Or ne réagit toujours pas.
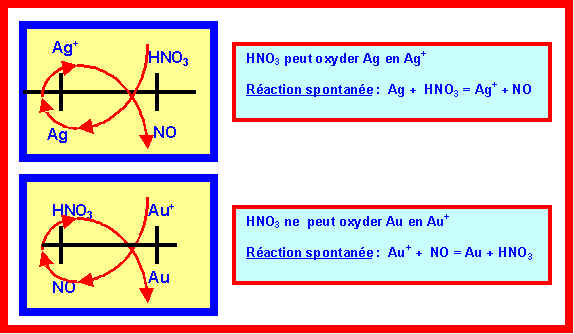
6) Ecrire et équilibrer la réaction qui se produit entre Ag et HNO3. Montrer qu'on peut la considérer comme totale en calculant sa constante d'équilibre.
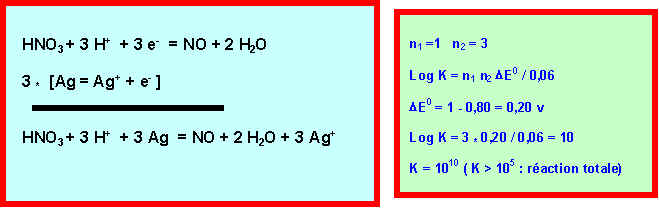
On récupère le monoxyde d'azote (NO) formé au cours de la réaction.
On en obtient 234 cm3 à la température de 30°C et sous la pression P = 1 atm.
7) Déterminer le pourcentage massique en Argent de l'alliage.
3 H+ + 3 Ag + 3 HNO3 = 3 Ag+ + NO + 3 H2O
Ag |
HNO3 |
Ag+ |
NO |
|
E.I |
n0 |
Excès |
0 |
0 |
E.F |
0 |
Excès |
n0 |
n0 / 3 |
Nombre de mole de NO récupérées :
P V = n R T
n = PV /RT = 1 * 0,234 / 0,082 / 303 = 0,009265 mole
n0 = 0,009265 * 3 = 0,0278 mole
Masse d’Argent dans 30 g d’alliage :
mAg = 0,0278 * 108 = 3,002 g
Pourcentage d’Argent dans l’alliage :
(3,002 / 30) * 100 » 10 %
8) Déduire des résultats précédants le pourcentage massique en Or de l'alliage.
%Au = 100 – 20 = 80 %