Thierry BRIERE
S.M.1 - MIAS 1 : CORRIGE DES T.D 'Initiation à la chimie théorique"
Première période : Les Atomes
CORRIGE DES EXERCICES : 2001 - 2002
SERIE 2 : SPECTRE DE L'HYDROGENE
SERIE 3 : Configurations électroniques - Classification périodique
SERIE 4 : Approximations de Slater - Propriétés atomiques
Atomistique
mp = 1,00727 u.m.a mn = 1,00866 u.m.a me = 9,1095 10-31 kg
N = 6,022 1023 RH = 1.097 107 m-1 h= 6.62 10-34 Js C = 3 108 ms-1
Le noyau de l'atome de Lithium est formé de 4 neutrons et trois protons. Calculer en u.m.a la masse théorique de ce noyau. La comparer à sa valeur réelle de 7,01601 u.m.a. Calculer l'énergie de cohésion de ce noyau en J et en MeV.
Masse théorique du noyau : mthéo = 4 * 1,00866 + 3 * 1,00727 = 7,05645 u.m.a
1 u.m.a = 1 / N g
mthéo = 7,05645 / N = 1,17178 10-23 g = 1,17178 10-27 Kg
La masse réelle du noyau est inférieure à sa masse théorique, la différence Dm ou défaut de masse correspond à l'énergie de cohésion du noyau.
Défaut de masse : Dm = 7,05645 - 7,01601 = 0,04044 u.m.a/noyau = 6,71538 10-29 Kg / noyau = 0,04044 g / mole de noyaux
Energie de cohésion :
E = Dm C2
E = 6,71538 10-29 (3 108)2 = 6,04384 10-12 J/noyau = 37,77 MeV/noyau
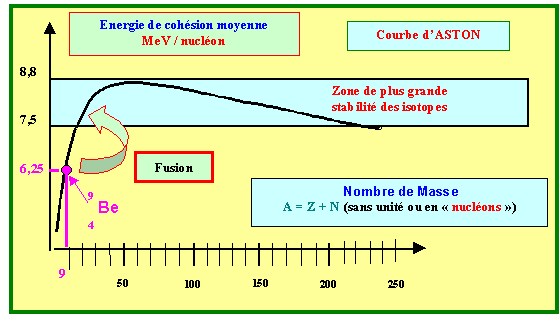
Moyen de vérification : On peut vérifier que l'ordre de grandeur obtenu est correct en calculant l'énergie moyenne de cohésion par nucléons ici on trouve 5,4 MeV/nucléon ce qui correspond bien à l'ordre de grandeur de la courbe d'Aston d'environ 8 MeV/nucléon pour les atomes stables 30 < Z < 80.
Soit la réaction suivante :
2 2 H (deutérium) -----> 3 H (tritium) + 1 H
On donne les masses atomiques suivantes en u.m.a :
Hydrogène M = 1,00783 Deutérium M = 2,01410 Tritium M = 3,01605
a) Quelle quantité d'énergie est libérée par la fusion de 1 kg de deutérium ?
2 2H à 3H + 1H
Dm = 3,01605 + 1.00783 – (2 * 2,0141) = -0,00432 u.m.a
Dm = - 0,00432 u.m.a / 2 atomes ou Dm = -0,00432 g / 2 moles
DE = Dm * C2 = - 3,89 1011 J / 2 moles
Le signe négatif indique que l’énergie est dégagée par cette réaction "exothermique".
Soit 3,89 1011 / 2 = 1,94 1011 J / mole ; soit 1,94 1011 / 2,0141 = 9,65 1010 J / g
soit finalement : 9,65 1013 J / Kg
b) Le pouvoir calorifique du charbon est de 33400 KJ Kg-1, quelle masse de charbon doit-on brûler pour produire l'énergie équivalente à celle produite par la fusion d'un Kg de deutérium ?
Masse de charbon équivalente : MC = 9,65 1013 / 33400 103 » 3000 tonnes
L'énergie dégagée par les processus nucléaires est beaucoup plus importante que celle dégagée par les processus chimiques ordinaires (ici 3 106 fois plus). Cela explique l’utilisation de l'énergie nucléaire malgré tous les risques potentiels.
Le Béryllium Be ne possède qu’un seul isotope stable. Sa masse molaire atomique est 9,012 g mol-1.
a) Calculez l’énergie de cohésion de cet isotope stable, en J mol-1 puis en MeV par noyau puis en MeV par nucléon.
Masse "théorique" du noyau :
On sait que ZBe = 4, de plus on sait que M » A.
On a donc ici A = 9 et donc N = 5.
Mthéo = Z mp + N mn = 4 * 1,00727 + 5 * 1,00866 = 9,07238 u.m.a / noyau = 9,07238 g mol-1
Défaut de masse :
Dm = ½ 9,012 - 9,07238 ½ = 0,06038 u.m.a / noyau = 0,06038 g mol-1
La masse réelle du noyau est inférieure à sa masse " théorique ", le noyau est plus stable que ses constituants séparés. Il y a donc dégagement d’énergie lors de la formation du noyau à partir de ses constituants. La masse perdue est entièrement convertie en énergie.
Energie de cohésion :
E = Dm C2 = 0,06038 10-3 * 9 1016 = 5,4342 1012 J.mol-1
Soit 5,4342 1012 / e (en eV. mol-1) soit 5,4342 1012 / N e (en eV. noyau-1)
or N.e = F = 96500 C
Soit 5,4342 1012 / 96500 = 56,31 106 eV / noyau = 56,31 MeV / noyau
Soit pour l'énergie moyenne par nucléon : 56,31 / 9 = 6,26 MeV / nucléon
b) On a sommairement représenté la courbe d’Aston. Complétez ce schéma en indiquant les grandeurs représentées (et leurs unités !) en abscisses et en ordonnée. Que représentent les deux traits horizontaux ? Placer approximativement cet isotope sur la courbe. Fait-il parti des isotopes les plus stables ? Si non, par quel type de processus peut-il se stabiliser ?

c) Cet isotope est utilisé comme " générateur de neutrons " dans l’industrie nucléaire. Un atome de cet isotope fixe en effet une particule a , un neutron est libéré et il se forme un autre noyau dont on précisera la nature exacte. Ecrire la transformation correspondante. Est-elle en accord avec la réponse à la question précédante?
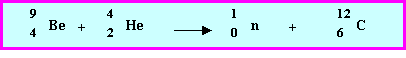
Il s’agit bien d’une réaction de fusion dans laquelle deux noyaux " légers " s’unissent pour donner un noyau plus " gros ".
Il existe également trois isotopes radioactifs du Béryllium 7Be , 8Be et 10Be.
d) L'isotope 8Be est émetteur de type a ce qui peut paraître surprenant puisque ce type de radioactivité est généralement observé pour les atomes lourds de Z > 84. Qu’a-t-il de particulier qui justifie cette forme de radioactivité ? Ecrire la réaction nucléaire correspondante.
Le noyau de 8Be est équivalent à deux particules a il se scinde donc facilement en deux particules a individuelles.
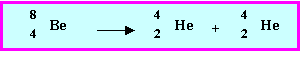
Remarque : Au début du siècle, à l’aube des études sur l’atome et la radioactivité on a pensé que les particules a étaient des particules élémentaires.
e) Les deux autres isotopes sont des émetteurs de type b. Attribuez à chacun son type de radioactivité b+ ou b- en justifiant simplement la réponse. Ecrire les réactions nucléaires correspondantes.
Isotope 7Be :
Par comparaison avec l'isotope stable 9Be pour lequel Z = 4 et N = 5
On constate que cet isotope instable 7Be pour lequel Z = 4 et N = 3 présente un " déficit " de neutrons, il cherchera donc à se stabiliser en transformant un proton en neutron. Il sera donc émetteur b+.
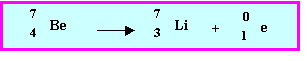
Isotope 10Be :
Par comparaison avec l'isotope stable 9Be pour lequel Z = 4 et N = 5
On constate que cet isotope instable 10Be pour lequel Z = 4 et N = 6 présente un " excès " de neutrons il cherchera donc à se stabiliser en transformant un neutron en proton. Il sera donc émetteur b-.
![]()
Le Magnésium (Z=12) possède trois isotopes stables 24Mg, 25Mg et 26Mg leurs abondances naturelles sont respectivement : 78,6% - 10,1 % et 11,3% . Calculer la masse molaire atomique approchée du Magnésium et expliquer pourquoi le résultat obtenu n’est qu’approximatif.
On peut faire l’approximation mp » mn » 1 u.m.a, on néglige de plus la masse des électrons et surtout le défaut de masse du noyau.
M = S xi Mi
Mi » S xi Ai
MAl = 0,786 * 24 + 0,101* 25 + 0,113 * 26 = 24,3 g mol-1
Si on vérifie sur une table on constate que ces approximations ne faussent que très peu le résultat. Le premier chiffre après la virgule reste correct. On pourra donc dans la plupart des cas et si on n'a pas besoin d'une extrême précision assimiler Nombre de Masse A et masse molaire atomique pour un isotope donné.
Spectre de l’Hydrogène et des Hydrogénoïdes
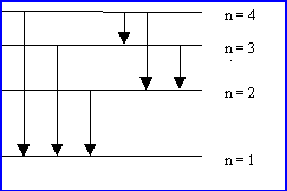
Si l’électron de l’Hydrogène est excité au niveau n=4, combien de raies différentes peuvent-elles être émises lors du retour à l’état fondamental. Calculer dans chaque cas la fréquence et la longueur d’onde du photon émis.
6 raies possibles :
Modèle de Bohr : En = - E0 / n2
Formule de Rydberg : 1/l = RH (1/n2 – 1/p2)
E n,p = -E0 / n2 + E0 / p2 = E0 (1/p2 - 1/n2)
E = h . n et n = C / l
E0 = h C RH = 6,62 10-34 * 3 108 * 1,097 107
E0 = 2,18 10-18 J ( 13,6 eV )
Raie - Transition |
Energie (J ) |
Fréquence n ( 1015 Hz ) |
Longueur d’onde (nm) |
Domaine spectral |
Série |
4 à 3 |
1,06 10-19 |
0,16 |
1874 |
I.R |
Bracket |
4 à 2 |
4,09 10-19 |
0,62 |
486 |
Visible |
Balmer |
4 à 1 |
2,04 10-18 |
3,09 |
97,2 |
U.V |
Lyman |
3 à 2 |
3,02 10-19 |
0,46 |
656 |
Visible |
Balmer |
3 à 1 |
1,93 10-18 |
2,93 |
102,5 |
U.V |
Lyman |
2 à 1 |
1,63 10-18 |
2,5 |
121,5 |
U.V |
Lyman |
Remarques :
- Une erreur fréquente consiste à penser que les niveaux sont équidistants, ce qui ramènerait le nombre de raies a trois seulement.
- on peut vérifier que la valeur obtenue pour l est du bon ordre de grandeur si on se rappelle que la série de Lyman (n=1) est dans l'Ultra-Violet, que la série de Balmer (n=2) est dans le visible et que toutes les autres séries sont dans l'Infra.Rouge.

Si un atome d’Hydrogène dans son état fondamental absorbe un photon de longueur d’onde l1 puis émet un photon de longueur d’onde l2, sur quel niveau l’électron se trouve-t-il après cette émission ?
a) l1 = 97,28 nm et l2 = 1879 nm
b) l1 = 97,28 nm et l2 = 78.15 nm
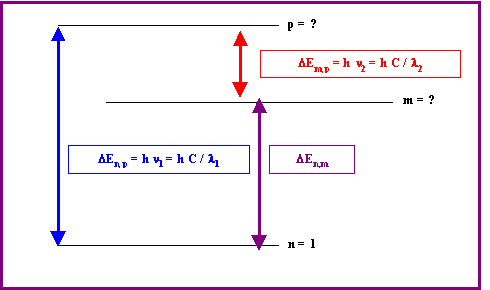
DEn,m = Em – E1 = E0 ( 1 - 1/m2 )
DE = h (n1 – n2) = h C ( 1/l1 – 1/l2) = h C A
h C RH ( 1 – 1/m2) = h C A
RH ( 1 – 1/ m2 ) = A
1 - 1/m2 = A / RH
1/m2 = 1 – (A / RH)
m2 = 1 / [ 1 – ( A / RH ) ] avec A = ( 1/l1 – 1/l2 )
Application numérique :
En partant de son niveau fondamental, l’atome ne peut évidemment pas restituer une énergie supérieure a celle reçue initialement.
Le Lithium présente dans son spectre d’émission une raie rouge intense de longueur d’onde 671 nm.
Calculer l’énergie associée à cette longueur d’onde.
L'énergie associée à une radiation lumineuse est proportionnelle à sa fréquence n et inversement proportionnelle à sa longueur d'onde l :
E = h n = h C / l
E = ( 6,62 10-34 * 3 108 ) / 671 10-9 = 2,96 10-19 J = 1,85 eV
La figure suivante donne les niveaux d’énergies de l’atome de Lithium déterminés à partir de son spectre d’émission.
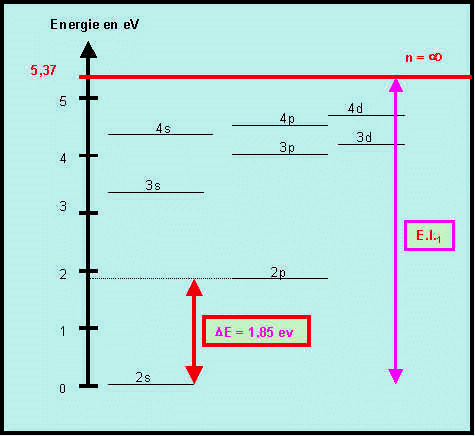
Pourquoi le niveau 2s est-il pris comme niveau zéro pour l’énergie ?
La configuration du Lithium est [He] 2s1 ou 1s2 , 2s1
Le niveau 2s est donc le dernier niveau occupé dans l'état fondamental de l'atome de Lithium.
Ce sont les électrons situés sur ce niveau qui pourront " sauter " sur un niveau supérieur par excitation, il est donc pris comme référence pour l'énergie. C'est le niveau fondamental de l'atome de lithium.
Il s'agit de l'énergie d'ionisation de l'atome de Lithium à partir de son état fondamental 2s1, c'est l'énergie qu'il faut fournir pour amener l'électron du niveau fondamental à l'infini c'est à dire pour ioniser Li en Li+. (voir figure)
La transition dont l’énergie vaut 1,85 eV est la transition entre les niveaux 2s et 2p
(voir figure)
Configurations électroniques - Nombres Quantiques -
Notion de Couche et de sous-couche - Classification périodique
Etablir les configurations électroniques des atomes suivants.Vérifier le résultat obtenu sur une classification périodique. Justifier les éventuelles anomalies.
Ca (Z=20) - Fe(Z=26) - Br(Z=35) - Cs(Z=55) - Cr (Z=24) - Mo (Z=42) - Au (Z=79) -
Règle de Klechkowski :
A quelques exceptions près, le remplissage des couches et des sous-couches se fait dans l’ordre des valeurs de ( n + l ) croissant. Si plusieurs combinaisons possibles conduisent à la même valeur, on choisit celle possédant la plus petite valeur de n .
Soit la représentation mnémotechnique suivante :
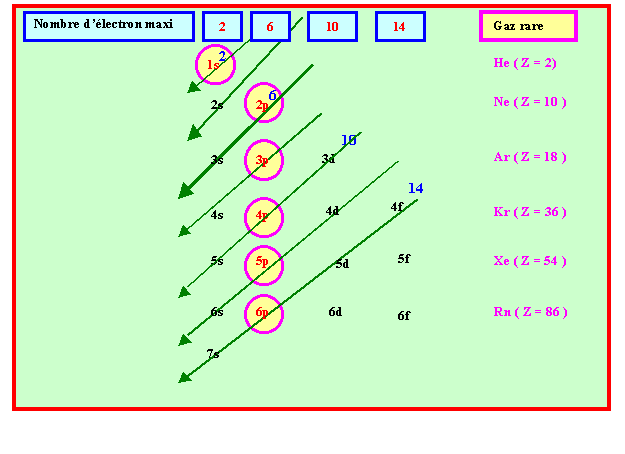
Calcium (Ca) : Z = 20 = 18 + 2 à ( Ar ) 4s2
Fer (Fe) : Z = 26 26 = 18 + 8 à ( Ar ) 4s2 3d6 ( Ar ) 3d6 4s2
Brome (Br) : Z = 35 = 18 + 17 à ( Ar ) 4s2 3d10 4p5 ( Ar ) 3d10 4s2 4p5
Césium (Cs) : Z = 55 = 36 + 19 à ( Ar ) 4s2 3d10 4p6 5s1 ( Ar ) 3d10 4s2 4p6 5s1
Chrome (Cr) : Z = 24 = 18 + 6 à ( Ar ) 4s2 3d4 ( Ar ) 3d4 4s2
Molybdène (Mo) : Z = 42 = 36 + 6 à ( Kr ) 5s2 4d4 ( Kr ) 4d4 5s2
Or (Au) : Z = 79 = 54 + 25 à ( Xe ) 6s2 4f14 5d9 ( Xe ) 4f14 5d9 6s2
Comparaison avec les configurations électroniques réelles :
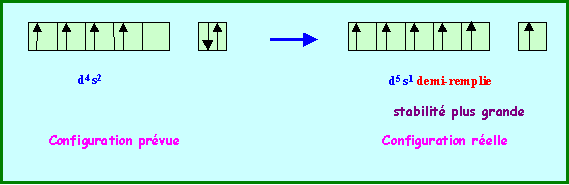
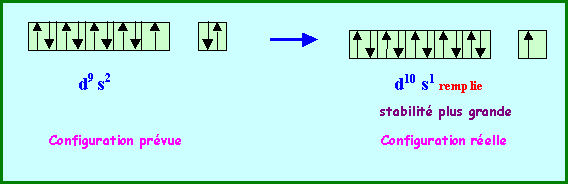
La règle de Klechkowski ne permet pas d’obtenir à coup sur la configuration électronique réelle des atomes. A partir de n = 3 de nombreuses exceptions à cette règle apparaissent. Nous ne chercherons pas à justifier toutes ces exceptions mais on peut expliquer certaines d’entre elles en admettant qu’une sous-couche totalement remplie ou à demi-remplie apporte une stabilité supplémentaire.
Ainsi la configuration d5 s1 est-elle plus stable que la configuration d6 s2 ( Cr et Mo)
De même la configuration d10 s1 est plus stable que la configuration d9 s2 ( Au )
Les configurations réelles de ces trois éléments sont donc :
Cr : ( Ar ) 3d5 4s1
Mo : ( Kr ) 4d5 5s1
Au : ( Xe ) 4f14 5d10 6s1
Nous admettrons cette règle et l’appliquerons quand ces cas semblables se présenteront.
Nous rencontrerons des situations analogues lors de l’étude des énergies de première ionisation et pour expliquer la formation de certains ions.
Remarque : Si la configuration est modifiée la position dans la classification périodique ne l’est pas.
Les affirmations suivantes sont-elles exactes ou inexactes? Pourquoi ?
a) Si l = 1, l’électron est dans une sous couche d.
l = 1 à sous-couche p : FAUX
b) Si n = 4 l’électron est dans la couche O.
n = 4 à couche N : FAUX
c) Pour un électron d, m peut être égal à 3.
d à l = 2 à ml = -2, -1, 0, 1, 2 : FAUX
d) Si l = 2, la sous-couche correspondante peut recevoir au plus 6 électrons.
l = 2 à ml = -2, -1, 0, 1, 2 à 5 cases quantiques à 10 électrons maximum : FAUX
e) Le nombre n d’un électron d’une sous-couche f peut être égal à 3.
n = 3 à l = 0, 1, 2 (s,p,d) à pas de f sur couche 3 : FAUX
f) Si deux " édifices atomiques " ont la même configuration électronique, il s’agit forcément du même élément.
" édifice atomique " = atome " neutre " ou ion
Un ion a la même configuration électronique qu’un atome neutre d’un autre élément : FAUX
Exemples : Na+ , Ne et O2- ont la même configuration électronique.
g) Si deux " édifices atomiques " ont des configurations électroniques différentes il s’agit forcément de deux éléments différents.
L’ion et l’atome neutre du même élément ont forcement des configurations électroniques différentes : FAUX
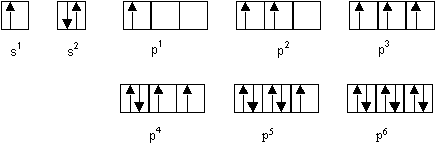
Un élément a moins de 18 électrons et possède 2 électrons célibataires. Quelles sont les configurations électroniques possibles pour cet élément ? Quel est cet élément sachant qu'il appartient à la période du lithium(3) et au groupe de l'étain(50).
L’élément en question appartient à l’une des trois premières lignes de la classification.
La représentation sous forme de cases quantiques montre que seules les configurations p2 et p4 possèdent "exactement" deux électrons célibataires. On peut aussi considérer que la configuration s2p3 peut convenir puisqu'elle compte 3 électrons célibataires. L’élément en question ne peut donc être que : C, Si, O , S , N ou P.
On sait qu’il appartient a la période du lithium, donc Si , S et P sont éliminés.
Cherchons la configuration de l'étain ( Z = 50)
50 = 36 + 14 à (Kr) 4d10 5s2 5p2
L’élément cherche appartenant au même groupe que l’étain est donc le Carbone C.
s1 |
s2 |
p1 |
p2 |
p3 |
p4 |
p5 |
p6 |
H |
He |
||||||
Li |
Be |
B |
C |
N |
O |
F |
Ne |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
Les alcalino-terreux
On connaît actuellement 6 éléments appartenant à cette famille qui sont (classés par ordre croissant de leur numéro atomique) : Béryllium – Magnésium - Calcium – Strontium – Baryum et Radium.
Colonne 2
Il suffit de savoir qu'un alcalino-terreux est équivalent "à un gaz rare auquel on a ajouté 2 électrons"
Z |
Configuration électronique |
||
| Béryllium | Be |
4 |
1s2 2s2 = (He) 2s2 |
| Magnésium | Mg |
12 |
(He) 2s2 2p6 3 s2 = (Ne) 3s2 |
| Calcium | Ca |
20 |
(Ne) 3s2 3p6 4s2 = (Ar) 4s2 |
| Strontium | Sr |
38 |
(Ar) 3 d10 4s2 4p6 5s2 = (Kr) 5s2 |
| Baryum | Ba |
56 |
(Kr) 4d10 5s2 5p6 6s2 = (Xe) 6s2 |
| Radium | Ra |
88 |
(Xe)4f14 5d10 6s2 6p6 7s2 = (Rn) 7s2 |
Hélium He : Z = 2 soit 1s2 2s2 mais il appartient à la famille des gaz rares (chimiquement presque inertes) et est donc placé en colonne 18.
Z = 120
(Rn) 7s2 5f14 6d10 7p6 8s2
Ils perdent leurs deux électrons ns2 pour ressembler au gaz rare précédent : X2+
O prend 2 électrons pour ressembler à Ne soit O2-
M2+ + O2- = MO
Avec 2 électrons seulement sur leur couche de valence, les alcalino-terreux sont tous des métaux et leurs oxydes sont donc basiques. (Règle de Sanderson)
Approximations hydrogénoïdes de Slater - Propriétés atomiques
On donne les valeurs expérimentales des énergies de première ionisation des éléments de la 2° période EI1 exprimées en KJ.mol-1
Li |
Be |
B |
C |
N |
O |
F |
Ne |
520 |
899 |
800 |
1086 |
1402 |
1314 |
1678 |
2084 |
a)Comment passe-t-on des kJ.mol-1 aux eV ?
KJ / mole * 1000 / N / e à eV / atome
N * e = F = 96500 C
KJ mol-1 / 96,5 à eV/atome
b) Convertir ces énergies en eV.
Li |
Be |
B |
C |
N |
O |
F |
Ne |
5,4 |
9,3 |
8,3 |
11,3 |
14,5 |
13,6 |
17,4 |
21,6 |
c) Par utilisation de l’approximation hydrogénoïde de Slater calculer ces énergies de première ionisation.
Nous allons montrer sur deux exemples comment on peut calculer la valeur approximative de l'énergie d’ionisation grâce aux approximations hydrogenoides de Slater.
Oxygène ( Z = 8 )
| O | 1s2 | 2s2 , 2p4 |
| 2 E1 | 6 E2 | |
| O+ | 1s2 | 2s2 , 2p3 |
| 2 E1 | 5 E'2 |
O à O+ + 1 e-
Energie de première ionisation :
E.I1 = EO+ - EO
E O+ = 2 E1 + 5 E'2
EO = 2 E1 + 6 E2
E.I1 = 5 E'2 - 6 E2
Calcul de Z*E2 et E2 :
Z*E2 = 8 – (5 * 0,35) - (2 * 0,85) = 4,55
E2 = -13.6 * 4,552 / 4 = -70,39 eV
Calcul de Z*E'2 et E'2 :
Z*E'2 = 8 – (4 * 0,35) - (2 * 0,85) = 4,9 (soit plus simplement 4,55 + 0,35 = 4,9)
E'2 = -13.6 * 4,92 / 4 = -81,63 eV
Calcul de E.I1 :
E.I1 = 5 E'2 - 6 E2 = (5 * -81,63) - (6 * -70,39) = 14,2 eV
Carbone ( Z = 6)
| C | 1s2 | 2s2 , 2p2 |
| 2 E1 | 4 E2 | |
| C+ | 1s2 | 2s2 , 2p1 |
| 2 E1 | 3 E'2 |
C à C+ + 1 e-
Energie de première ionisation :
E.I1 = EC+ - EC
E C+ = 2 E1 + 3 E'2
EO = 2 E1 + 4 E2
E.I1 = 3 E'2 - 4 E2
Calcul de Z*E2 et E2 :
Z*E2 = 6 – (3 * 0,35) - (2 * 0,85) = 3,25
E2 = -13.6 * 3,252 / 4 = -35,91 eV
Calcul de Z*E'2 et E'2 :
Z*E'2 = 6 – (2 * 0,35) - (2 * 0,85) = 3,6 (soit plus simplement 3,25 + 0,35 = 3,6)
E'2 = -13.6 * 3,62 / 4 = -44,06 eV
Calcul de E.I1 :
E.I1 = 3 E'2 - 4 E2 = (3 * -44,06) - (4 * -35,91) = 11,5 eV
d) Comparer les valeurs expérimentales aux valeurs obtenues par le calcul.
Résultats :
Valeur calculée |
Valeur expérimentale |
Ecart ( % ) |
|
Li |
5,7 |
5,4 |
6,4 |
Be |
7,9 |
9,3 |
-15,4 |
B |
9,8 |
8,3 |
17,8 |
C |
11,5 |
11,3 |
1,4 |
N |
12,9 |
14,5 |
-10,9 |
O |
14,2 |
13,6 |
4,1 |
F |
15,2 |
17,4 |
-12,8 |
Ne |
16,0 |
21,6 |
-26,0 |
e) Justifier les écarts observés par comparaison des schémas de Lewis (sous forme de cases quantiques) des " atomes neutres " et des ions correspondants.
Interprétation :
Cette méthode simple de calcul permet d’atteindre l’ordre de grandeur de l’énergie de première ionisation d’un atome. L’écart moyen est de 6 %, cette précision est appréciable eut égard à la simplicité du modèle utilisé. La courbe des valeurs calculées est régulière alors que la courbe expérimentale présente des discontinuités.
Cette tendance générale à l’augmentation souffre deux " accidents " correspondant à B et N pour lesquels on observe une diminution de l’énergie d’ionisation. On peut comprendre (sinon expliquer) ces accidents en examinant la structure électroniques des atomes et ions correspondants. Rappelons la règle: " une couche ou sous-couche à demi remplie ou complètement remplie apporte une stabilité supplémentaire ".
Si cette règle est respectée, les atomes ayant une couche de ce type seront très stables et donc difficiles à ioniser puisqu’on perd alors cette stabilité supplémentaire ; leur énergie d’ionisation sera alors "anormalement élevée ".
Les atomes de ce type sont Be, N et Ne et on trouve effectivement que la valeur expérimentale de l’énergie d’ionisation est plus élevée que sa valeur calculée.
Inversement, les ions possédant une couche remplie ou demi remplie seront très stables et l’atome correspondant aura donc une énergie d’ionisation "anormalement faible ".
Les atomes de ce type sont B et O et on trouve effectivement que la valeur expérimentale de l'énergie d’ionisation est plus faible que sa valeur calculée.
Le carbone n’appartient à aucune de ces catégories et son énergie d’ionisation calculée est très proche de la valeur expérimentale.
Le Lithium est un cas particulier, sa couche de valence 1s1 le placerait à la limite dans la première catégorie, mais l’ion forme possède une couche totalement remplie (1s2). C’est cet effet qui l’emporte et on trouve que la valeur expérimentale de l’énergie d’ionisation est plus faible que sa valeur calculée.
Reste enfin le cas de l’atome de Fluor qui comme le carbone devrait conduire à des valeurs calculée et expérimentale proches. Ce n’est pas le cas, et la valeur expérimentale est beaucoup plus élevée que la valeur calculée. Le fort écart observé pour cet atome traduit la difficulté d’arracher des électrons alors qu’il suffirait d’en ajouter un pour atteindre la structure de gaz rare. C’est une manifestation de la règle de l’octet. Enfin, cela traduit aussi la forte electronégativité de l’atome de Fluor qui retient fortement les électrons.
Classer les atomes suivante par rayon atomique croissant :
S(16) ; Mg(12) ; F(9) ; Be(4) ; O(8) ; Si(14)
a) Par simple comparaison des n2/Z*
b) En utilisant la formule R (A°) = 0,215 (n2/Z*) + 0,148 n + 0,225
c) Comparer aux valeurs données par les tables. Conclusion ?
Z* |
n |
n2/Z* |
R Calculé |
R expérimental |
|
F |
5,2 |
2 |
0,77 |
0,69 |
0,72 |
O |
4,55 |
2 |
0,88 |
0,71 |
0,73 |
S |
5,45 |
3 |
1,65 |
1,02 |
1,02 |
Be |
1,95 |
2 |
2,05 |
0,96 |
0,90 |
Si |
4,15 |
3 |
2,17 |
1,13 |
1,11 |
Mg |
2,85 |
3 |
3,16 |
1,35 |
1,36 |
Classements
On constate que la valeur de n2/Z* permet un classement qualitatif des atomes, malgré une inversion (S et Be).
La formule R = 0,215 n2/Z* + 0,148 n + 0,225 permet un calcul assez précis des valeurs des rayons de covalence et un bon accord avec les valeurs expérimentales. (voir article BUP)
Classer les éléments suivants par électronégativité croissante :
a) O ; Li et N b) Si ; P ; Cl ; Na et S c) I ; Cl ; F et Br
Li < N < O ( même ligne)
Si < P < Cl ( même ligne )
I < Br < Cl < F ( même colonne )

Exercice 4 :
Pour évaluer les rayons ioniques Pauling a supposé que ceux-ci étaient proportionnels à n2/Z* comme les atomes neutres. D’autre part, il a supposé, que dans les cristaux ioniques, les anions et les cations étaient au contact et que la distance internucléaire d accessible par diffraction des rayons X était égale à la somme des rayons ioniques de l’anion et du cation.
Dans NaF d = 2.31 A° : Evaluer les rayons ioniques de Na et F
Dans LiF d = 2.01 A° : Evaluer les rayons ioniques de Li et F
Comparer les valeurs obtenues pour F. Conclusion.
Affectons l’anion de l’indice A et le cation de l’indice C.
d = RC + RA
RC = k nC2 / Z*C
RA = k nA2 / Z*A
RC / RA = ( nC2 / nA 2 ) ( Z*A / Z*C )
RC = ( nC2 / nA 2 ) * ( Z*A / Z*C ) * RA = K RA
D = ( K + 1 ) RA
RA = d / ( K + 1 )
RC = K RA
d |
Z*C |
nC |
Z*A |
nA |
K |
RA |
RC |
|
NaF |
2,31 |
6,85 |
2 |
4,85 |
2 |
0,708 |
1,35 |
0,96 |
LiF |
2,01 |
2,7 |
1 |
4,85 |
2 |
0,449 |
1,39 |
0,62 |
Les valeurs trouvées pour le rayon ionique du fluor ne sont pas tout à fait identiques mais sont tout de même très proches.
Cette méthode très simple permet donc d’évaluer de proche en proche les valeurs des différents rayons ioniques. Une valeur moyenne sera retenue à partir de déterminations sur plusieurs solides ioniques différents. Ces valeurs des rayons ioniques de Pauling ont été tabulées et sont largement utilisées en cristallographie.
D’autres tables plus modernes existent, telle que la table de Schanon et Prewitt qui ont corrélés les distances inter-nucléaires de plus de mille oxydes. En pratique, les différences sont faibles entre les diverses tables et la table de Pauling est encore très utilisée actuellement.
Soit 4 éléments X, Y, Z et W.
On sait que ces 4 éléments sont situés dans les 3 premières lignes de la classification périodique.
On donne les 5 premières énergies d’ionisation (en eV) de ces quatre éléments.
On donne d’autre part une représentation graphique de la variation de ces énergies d’ionisation.
Voir tableau et courbes pages suivantes.
E.I |
Atome X |
E.I |
Atome Y |
E.I |
Atome Z |
E.I |
Atome W |
1 |
8,26 |
1 |
11,22 |
1 |
8,12 |
1 |
5,14 |
2 |
25 |
2 |
24,27 |
2 |
16,27 |
2 |
47,3 |
3 |
37,75 |
3 |
47,65 |
3 |
33,35 |
3 |
71,6 |
4 |
258,1 |
4 |
64,22 |
4 |
44,93 |
4 |
98,9 |
5 |
338,5 |
5 |
390,1 |
5 |
156,6 |
5 |
138,4 |
1) Identifiez pour chacun de ces éléments sa colonne dans la classification.
Pour attribuer à chaque élément sa colonne, il suffit de chercher pour quelle ionisation on observe une brusque élévation. Ce saut correspond à la structure du gaz rare très stable.
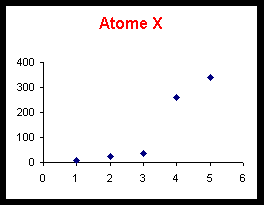
Elément X : le saut se produit pour la quatrième ionisation. X3+ possède la structure d’un gaz rare et X appartient à la colonne 13 de la classification : X = B ou Al.
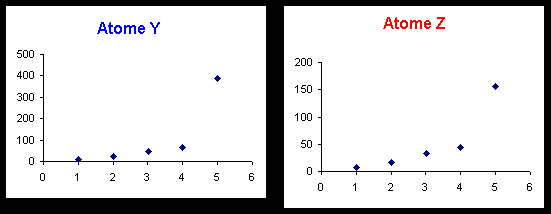
Eléments Y et Z : le saut se produit pour la cinquieme ionisation. X4+ et Z4+ possèdent la structure d’un gaz rare et X et Z appartiennent à la colonne 14 de la classification : Y et Z = C ou Si.
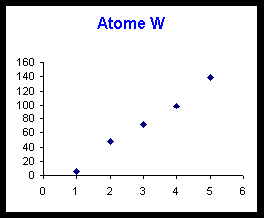
Elément W : le saut se produit pour la deuxième ionisation. X+ possède la structure d’un gaz rare et X appartient à la colonne 1 de la classification : W = Li ou Na.
2) Pour un de ces 4 éléments on peut sans hésitation attribuer aussi sa ligne dans la classification. De quel élément s’agit-il ? Donner son symbole chimique et son nom.
Parmi les éléments possibles (B, Al, C, Si, Li et Na) on peut éliminer Li puisque celui-ci ne possède que trois électrons et ne peut donc avoir 5 ionisations successives. L'élément W appartenant à la colonne 1 est donc le sodium Na. W = Na.
3) Deux de ces éléments appartiennent à un même groupe de la classification, comment cela se traduit-il sur la représentation graphique ?
Attribuer à ces deux atomes leur symbole et leur nom.
Les atomes Y et Z appartiennent à la même colonne. Cela se traduit par une grande similitude des courbes (parallélisme évident).
L'énergie de première ionisation varie en sens inverse du rayon atomique.
Plus l’atome est petit, plus l'électron est près du noyau et plus il est difficile à arracher.
Le rayon atomique variant sensiblement comme n2/Z* augmente quand on descend dans une colonne car l’augmentation de n2 l’emporte largement sur celle de Z*. L'élément ayant l'énergie de première ionisation la plus élevée est donc l'élément situé le plus haut.
Y est le carbone et Z le silicium.
4) Enfin l’attribution certaine d’une ligne est difficile pour un de ces éléments.
Lequel ? Proposer pour cet élément les deux possibilités pour son symbole et son nom. Pour lever l’indétermination sur la nature de cet élément calculer ses trois premières énergies d’ionisation par les approximations hydrogénoïdes de Slater. Identifier cet élément par comparaison avec les valeurs expérimentales.
Il ne reste qu’a identifier X qui peut être B ou Al.
Calculons les trois premières énergies d’ionisation de B :
| B | 1s2 | 2s2 , 2 p1 |
| 2 E1 | 3 E2 | |
| B+ | 1s2 | 2s2 |
| 2 E1 | 2 E'2 | |
| B2+ | 1s2 | 2s1 |
| 2 E1 | E''2 | |
| B3+ | 1s2 | |
| E1 |
EB = 2 E1 + 3 E2
EB+ = 2 E1 + 2 E’2
EB2+ = 2 E1 + E’’2 EB3+ = 2 E1
Energie de première ionisation :
B à B+ + 1 e- E.I.1 = EB+ - EB = 2 E’2 – 3 E2
Energie de deuxième ionisation :
B+ à B2+ + 1 e- E.I.2 = EB2+ - EB+ = E’’2 – 2 E’2
Energie de troisième ionisation :
B2+ à B3+ + 1 e- E.I.3 = EB3+ - EB2+ = - E’’2
E2 = -13,6 * Z*E22 / 4 E’2 = -13,6 * Z*E’22 / 4 E’’2 = -13,6 * Z*E’’22 / 4
Z*E2 = Z*B = 5 – ( 2 * 0,35 ) – ( 2 * 0,85 ) = 2,6
Z*E’2 = Z*B+ = 2,6 + 0,35 = 2,95
Z*E’’2 = Z*B2+ = 2,95 + 0,35 = 3,3
E2 = -13,6 * 2,62 / 4 = -22,98 eV
E’2 = -13,6 * 2,952 / 4 = -29,58 eV
E’’2 = -13,6 * 3,32 / 4 = -37,03 eV
E.I.1 = 2 E’2 – 3 E2 = ( 2 * -29,58 ) – ( 3 * - 22,98 ) = 9,8 eV
E.I.2 = E’’2 – 2 E’2 = -37,03 – ( 2 * -29,58 ) = 22,1eV
E.I.3 = - E’’2 = 37,0 eV
Calculé pour B |
Expérimental pour X |
Ecart % |
|
E.I.1 |
9,8 |
8,26 |
18,6 |
E.I.2 |
22,1 |
25 |
-11,6 |
E.I.3 |
37,0 |
37,8 |
-2,1 |
L’examen du tableau montre que les valeurs calculées pour le Bore s’accordent assez bien avec celles données pour l’atome X. On peut donc supposer que X est le Bore.
A titre de vérification, calculons les trois premières énergies d’ionisation de Al :
| Al | 1s2 | 2s2 , 2p6 | 2s2 , 2 p1 |
| 2 E1 | 8 E2 | 3 E3 | |
| Al+ | 1s2 | 2s2 , 2p6 | 2s2 |
| 2 E1 | 8 E2 | 2 E'3 | |
| Al2+ | 1s2 | 2s2 , 2p6 | 2s1 |
| 2 E1 | 8 E2 | E''3 | |
| Al3+ | 1s2 | 2s2 , 2p6 | |
| E1 | 8 E2 |
Al 1s2 2s2, 2p6 3s2 , 3p1 ( E1, E2 ,E3 )
Al+ 1s2 , 2s2 2p6 , 3s2 ( E1 , E2 , E’3 )
Al2+ 1s2 , 2s2 2p6 , 3s1 ( E1 , E2 , E’’3 )
Al3+ 1s2 2s2, 2p6 ( E1 , E2)
EAl = 2 E1 + 8 E2 + 3 E3
EAl+ = 2 E1 + 8 E2 + 2 E’3
EAl2+ = 2 E1 + 8 E2 + E’’3
EAl3+ = 2 E1 + 8 E2
Energie de première ionisation :
Al à Al+ + 1 e- E.I.1 = EAl+ - EAl = 2 E’3 – 3 E3
Energie de deuxième ionisation :
Al+ à Al2+ + 1 e- E.I.2 = EAl2+ - EAl+ = E’’3 – 2 E’3
Energie de troisième ionisation :
Al2+ à Al3+ + 1 e- E.I.3 = EAl3+ - EAl2+ = - E’’3
E3 = -13,6 * Z*E32 / 4 E’3 = -13,6 * Z*E’32 / 4 E’’3 = -13,6 * Z*E’’32 / 4
Z*E3 = Z*Al = 13 – ( 2 * 0,35 ) – ( 8 * 0,85 ) – ( 2 * 1 ) = 3,5
Z*E’3 = Z*Al+ = 3,5 + 0,35 = 3,85
Z*E’’3 = Z*Al2+ = 3,85 + 0,35 = 4,2
E3 = -13,6 * 3,52 / 9 = -18,51 eV
E’3 = -13,6 * 3,852 / 9 = -22,40 eV
E’’3 = -13,6 * 4,22 / 9 = -26,66 eV
E.I.1 = 2 E’3 – 3 E3 = ( 2 * -22,40 ) – ( 3 * - 18,51 ) = 10,7 eV
E.I.2 = E’’3 – 2 E’3 = -26,66 – ( 2 * -22,40 ) = 18,1 eV
E.I.3 = - E’’3 = 26,7 eV
Expérimental pour X |
Calcule pour Al |
Expérimental pour Al | Ecart % |
|
E.I.1 |
8,26 |
10,7 |
6,0 |
78 |
E.I.2 |
25 |
18,1 |
18,8 |
-3,7 |
E.I.3 |
37,8 |
26,7 |
28,5 |
-6,3 |
L’examen du tableau montre que les valeurs calculées pour l’Aluminium ne s’accordent aucunement avec les données concernant l’atome X. L’atome X n’est donc pas l’Aluminium mais bien le Bore comme nous l’avions trouve précédemment.
En revanche les valeurs calculées pour E.I2 et E.I3 s’accordent assez bien avec les valeurs expérimentales (colonne 4), ce qui confirme l'intérêt des règles de Slater. L'écart énorme trouvé pour E.I1 peut s’expliquer par les configurations électroniques de Al et Al+.
Al+ possédant une couche complètement remplie est stabilisé, il est donc formé facilement et E.I 1 est "anormalement " faible. (voir exercice 1)
Conclusion : X = B
5) Pour l’atome Y sur le graphique on constate que les énergies d’ionisation successives se répartissent en deux groupes de deux (EI1 et EI2) (EI3 et EI4) ; EI5 étant très différente. Justifiez cette répartition.
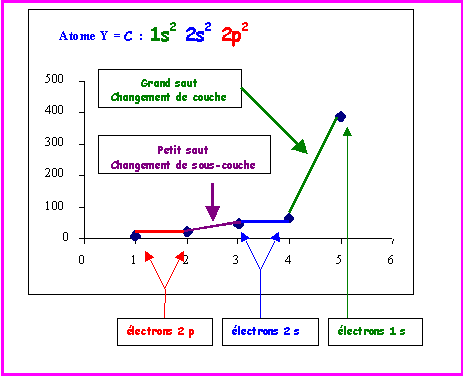
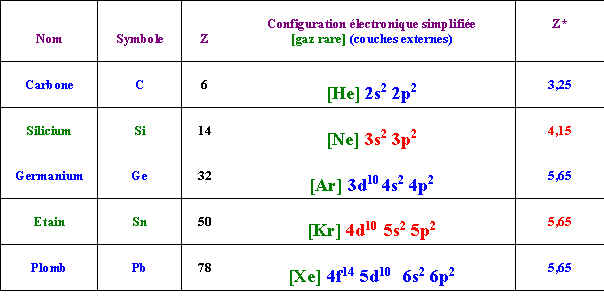
Exercice 6 : Les éléments de la colonne 14
Les éléments de la colonne 14 de la classification périodique sont dans l'ordre de leur numéro atomique croissant : Carbone - Silicium - Germanium - Etain - Plomb
Le tableau suivant résume quelques données sur ces éléments :
Nom |
Rayon de covalence (A°) |
Rayons ioniques (A°) |
Carbone |
0,77 |
|
Silicium |
1,18 |
|
Germanium |
1,22 |
0,53 - 0,93 |
Etain |
1,40 |
0,71 - 1,12 |
Plomb |
1,46 |
0,84 - 1, 20 |
Modèle de Bohr des atomes hydrogénoïdes : (Aucune démonstration n'est demandée)
2-1: Enoncer le postulat de Bohr
Le moment cinétique de l'électron est quantifié et ne peut prendre que des valeurs multiples de h / (2p).
m v R = n * [ h / (2p) ]
avec n = nombre quantique principal = nombre entier naturel non nul
2-2: Donner l'expression obtenue pour le rayon d'une orbite de Bohr.
R = (h2 e0 / p m e2) [ n2 / Z ] = a0 [ n2 / Z ]
Avec a0 = premier rayon de Bohr = 0,529 A°
2-3 : Donner l'expression obtenue pour l'énergie de l'électron sur une orbite de Bohr.
ET = - [m e4 / 8 e02 h2 ] * [ Z2 / n2 ]
Avec : [m e4 / 8 e02 h2 ] = 2,17 10-18 J = 13,6 eV = E0
ET = - E0 * [ Z2 / n2 ]
2-4 : Que deviennent les deux expressions précédantes dans le cadre du modèle des approximations hydrogénoïdes de Slater.
R = a0 [ n2 / Z * ]
ET = - E0 * [ Z*2 / n2 ]
3) Rayons de covalence et rayons atomiques
On évalue parfois le rayon atomique par l'expression Ra = a0 n2 / Z*
On peut donc calculer en utilisant cette expression les rayons atomiques des éléments de la colonne 14.
3-1 : Complétez le tableau.
n2 / Z* |
Rayon atomique (A°) |
|
Carbone |
1,23 |
0,65 |
Silicium |
2,17 |
1,15 |
Germanium |
2,83 |
1,50 |
Etain |
4,42 |
2,34 |
Plomb |
6,37 |
3,37 |
3-2 : Donner la définition du rayon de covalence d'un atome.
Le rayon de covalence d’un atome est une donnée expérimentale.
Supposons la molécule A2, dans cette molécule il existe une liaison A - A dont la longueur est mesurable expérimentalement.
Par définition, le rayon de covalence de l ’atome A sera la moitié de cette distance de liaison.
3-3 : Représenter graphiquement l'évolution du Rayon de covalence en fonction du rayon atomique (définit comme précédemment) pour les éléments de la colonne 14.
élément |
Rayon de Covalence (A°) |
Rayon atomique (A°) |
Carbone |
0,77 |
0,65 |
Silicium |
1,18 |
1,15 |
Germanium |
1,22 |
1,50 |
Etain |
1,40 |
2,34 |
Plomb |
1,46 |
3,37 |
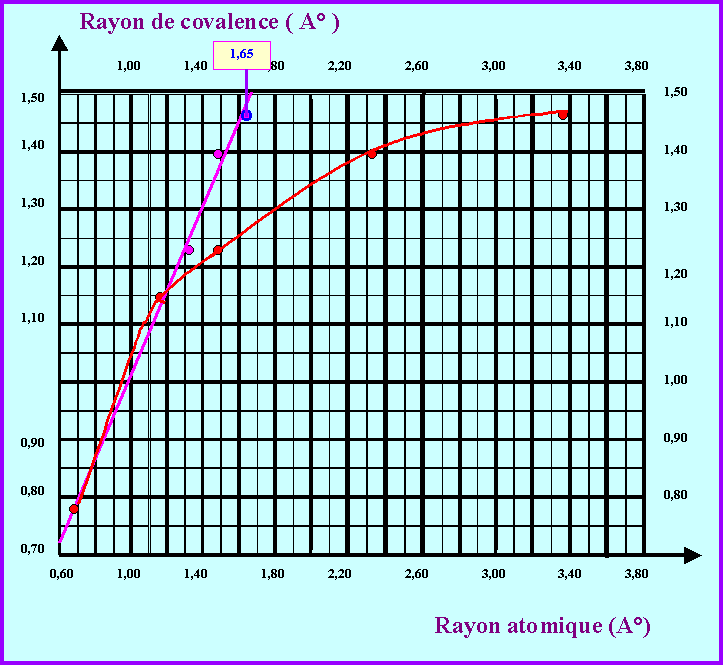
3-4 : Existe-t-il une relation de proportionnalité entre Rayon de covalence et rayon atomique pour les éléments de la colonne 14 ?
Non, la courbe n'est pas une droite passant par l'origine, il n'y a donc pas proportionnalité.
3-5 : En fait, pour "améliorer "le modèle de Slater on utilise des valeurs "corrigées" de n notées n*. Pour n = 1, 2 ou 3 on a simplement n* = n, pour n = 4 on prend n* = 3,7 et pour n = 5 on prend n* = 4. Sur le graphique précédant faire figurer les points obtenus en utilisant ces valeurs corrigées de n.
élément |
n* |
n*2 / Z* |
Rayon atomique corrigé (A°) |
Carbone |
2 |
1,23 |
0,65 |
Silicium |
3 |
2,17 |
1,15 |
Germanium |
3,7 |
2,42 |
1,28 |
Etain |
4 |
2,83 |
1,50 |
3-6 : Le résultat obtenu est-il plus satisfaisant ?
Avec les valeurs "corrigées" on obtient une assez bonne corrélation linéaire, il n'y a pas proportionnalité au sens strict, car la droite ne passe pas tout à fait par l'origine. La relation linéaire est néanmoins assez satisfaisante.
3-7 : Quelle valeur faut-il donner à n* quand n = 6 ?
On lit graphiquement que le rayon atomique du Plomb doit être de 1,65 A° environ pour obtenir un bon alignement avec les autres points.
R = a0 n*2 / Z*
n*2 = R * Z* / a0 = 1,65 * 5,65 / 0,529 = 17,623
soit : n* = 4,2
4) Rayons ioniques :
Pour chaque rayon ionique de la table fournie donner la nature de l'ion correspondant.. Justifier qualitativement vos réponses.

On constate que les rayons ioniques donnés sont toujours inférieurs aux rayons de covalence, cela montre qu'il s'agit de cations. En effet, en perdant des électrons l'atome voit son Z* augmenter par diminution de l'effet d'écran, les électrons sont donc soumis à une attraction plus importante du noyau et ils se rapprochent donc de lui, soit une diminution du rayon atomique. Cette contraction est d'autant plus importante que la charge de l'ion augmente, les rayons ioniques les plus petits correspondent donc aux fortes charges.
La prévision des ions stables donnés par un atome (des blocs s ou p) se fait en première approximation en utilisant la règle de l'octet. L'atome cherche à acquérir la structure électronique du gaz rare le plus proche dans la classification périodique. Dans le cas de la colonne 14 située au milieu de la classification les éléments ont deux possibilités pour satisfaire à la règle de l'octet : ressembler au gaz rare qui les précèdent en perdant 4 électrons ou ressembler au gaz rare qui les suit en gagnant 4 électrons.
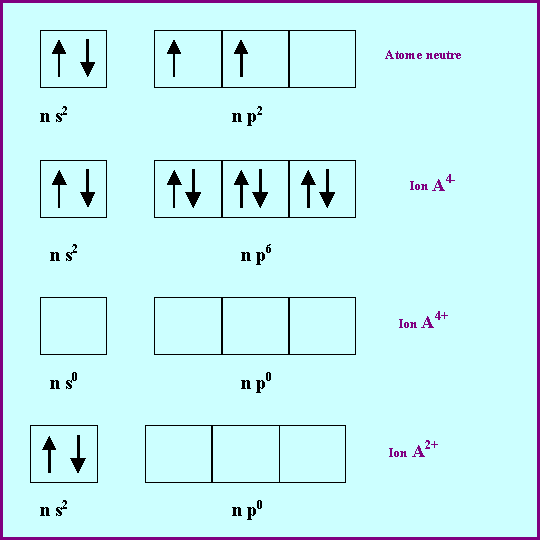
La règle de l'octet permet donc de prévoir l'existence d'ions du type A4+ et A4-.
Dans le cas des éléments de la colonne 14, la configuration électronique de la couche de valence est du type : n s2 - n p2. Ils peuvent donc perdre les 4 électrons de leurs couche de valence pour donner l'ion A4+. Ils peuvent également ne perdre que les deux électrons p pour donner l'ion A2+, cet ion est également stable en raison de la sous-couche n s2 totalement remplie.
La formation d'anions en gagnant 4 électrons est également possible, à condition toutefois que l'élément ne soit pas un métal. Le carbone non métal caractérisé pourra donner l'ion C4-. Le Plomb et l'Etain non-métaux caractérisés ne le feront pas. Le Silicium et le Germanium sont des semi-métaux intermédiaires entre métaux et non-métaux.