Cinquième série de T.D
Hybridation et recouvrement des Orbitales Atomiques
Mésomérie
Exercice 7 :
Décrire la géométrie, l'état d’hybridation des atomes et les liaisons dans les molécules suivantes :
HCN, HCHO, BeH2 , PCl5, CH2 = C =CH2
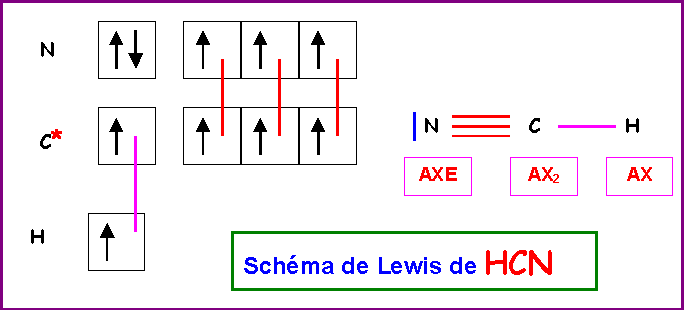
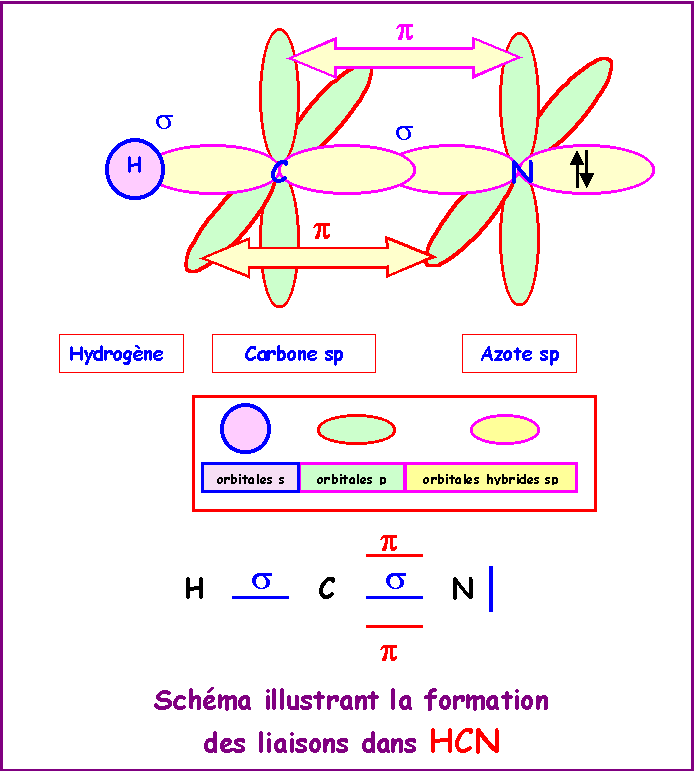
HCN

Atome de Carbone :
La géométrie autour de l'atome de Carbone central est du type AX2 .
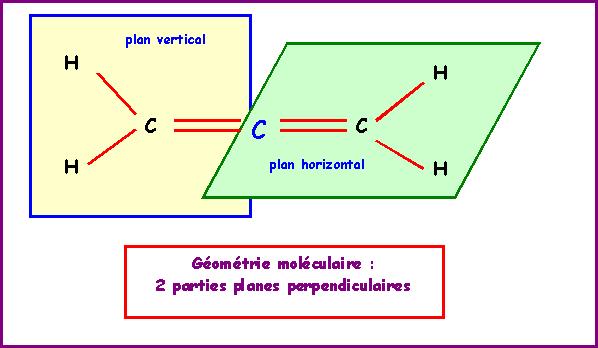
La molécule est donc linéaire.
L'hybridation de l'atome de Carbone convenant pour décrire cette géométrie linéaire est l'hybridation de type sp.
Atome d'Azote :
Autour de l'Azote on a une géométrie du type AXE donc linéaire également.
L'hybridation de l'atome d'Azote convenant pour décrire cette géométrie linéaire est l'hybridation de type sp.
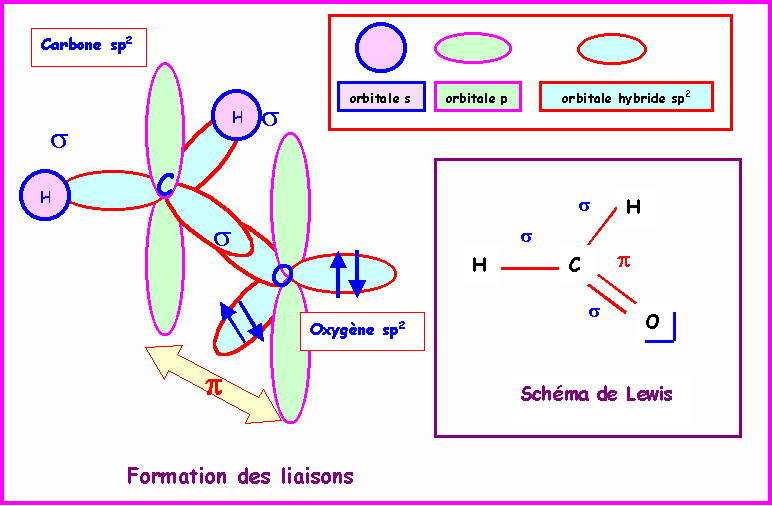
Méthanal : HCHO
Le Carbone central est hybridé sp2 pour une géométrie trigonale de type AX3, la molécule est plane.
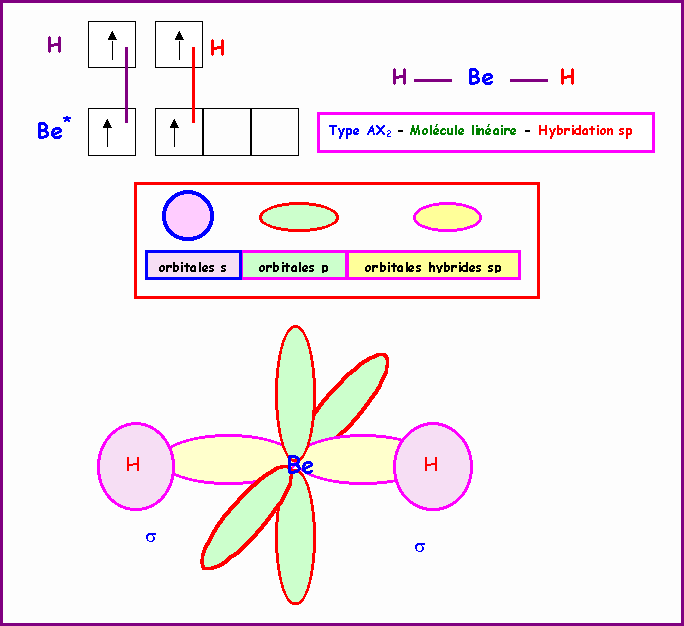
BeH2
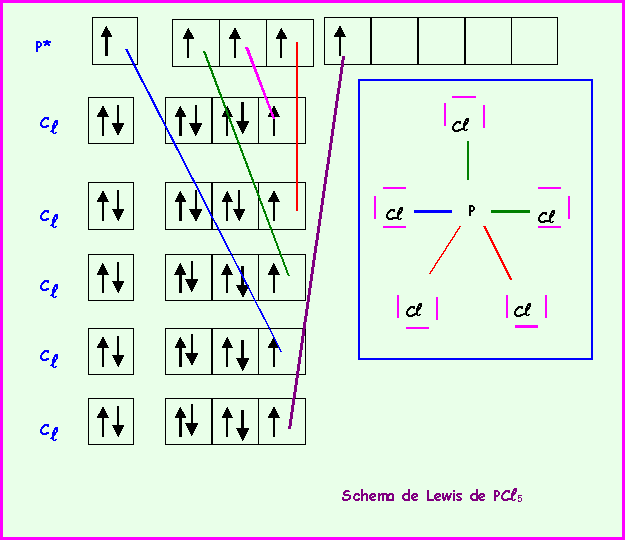
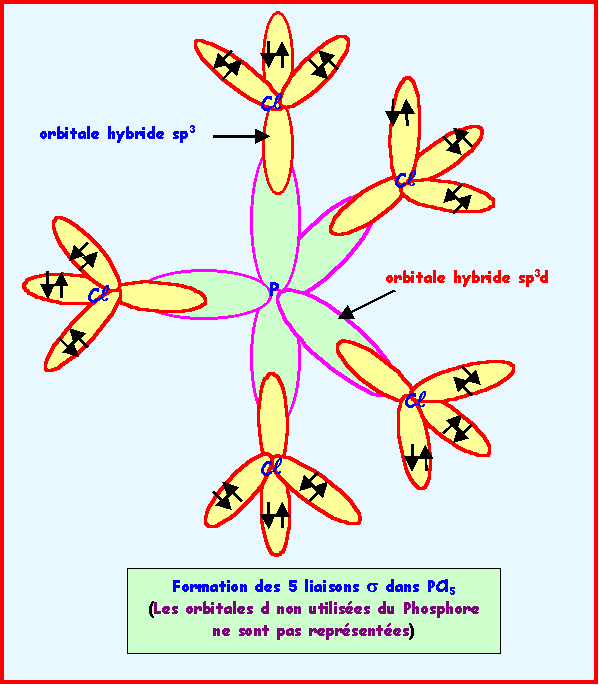
PCl5
L'hybridation de l'atome de phosphore est du type sp3d ce qui correspond à la géométrie de type AX5. Les cinq orbitales hybrides sp3d pointent dans les directions d'une bi-pyramide à base triangle. On peut supposer une hybridation de type sp3 pour le chlore. Une orbitale sp3 du chlore recouvre axialement une orbitale hybride sp3d du phosphore pour former une liaison de type s.
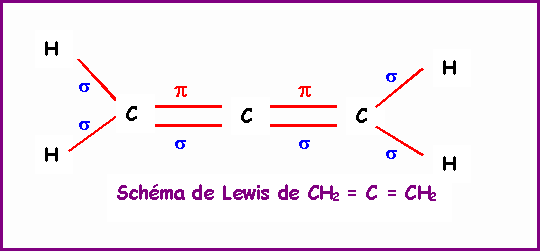
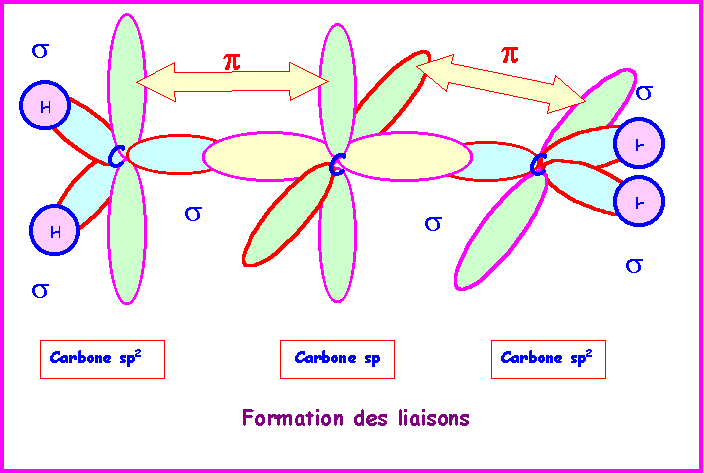
Allène : CH2 = C = CH2
Atome |
CH2 |
= C = |
CH2 |
Géométrie |
AX3 |
AX2 |
AX3 |
Hybridation |
sp2 |
sp |
sp2 |
Exercice 8 :
On s’intéresse à la géométrie de la molécule de prop-2-énal :
CH2 = CH - CHO
a) en appliquant la méthode V.S.E.P.R donner la géométrie autour de chaque carbone. Peut-on prévoir la géométrie globale de la molécule ?
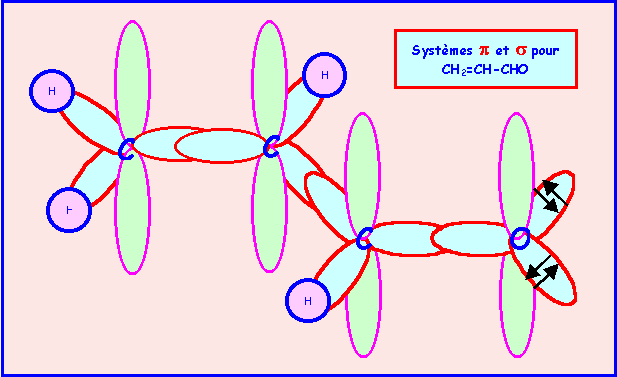
Les 3 atomes de Carbone ont une géométrie du type AX3, on à donc affaire à trois triangles équilatéraux mais rien n'indique si ces trois triangles sont ou non coplanaires.
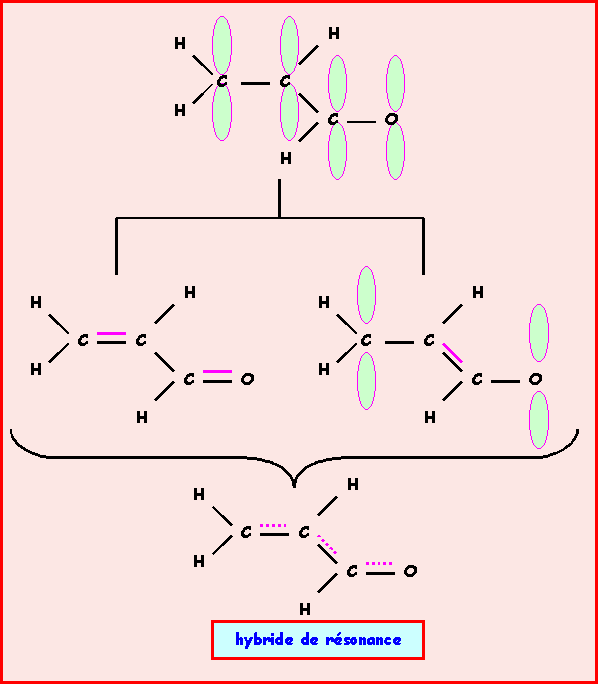
b) L’expérience montre que la molécule est plane. Représenter le système p et justifier ce fait expérimental.
La géométrie de type AX3 correspond à une hybridation de type sp2.
Pour que les liaisons p puissent se former, la molécule adopte une conformation totalement plane. Toutes les orbitales hybrides sp2 se placent dans un même plan et toutes les orbitales p sont alors parallèles, cela permet un recouvrement maximal des orbitales p entre elles ce qui stabilise la molécule. On a affaire à un système dit conjugué, un "nuage" p délocalisé englobe les trois atomes de Carbone et l'atome d'Oxygène.
c) Que peut-on prévoir pour les longueurs de liaison C-C ?
Ces liaisons seront en fait intermédiaires entre simple et double liaison. La molécule est un hybride de résonance entre plusieurs formes mésomères qui diffèrent par la position des doubles liaisons.
Exercice 9 :
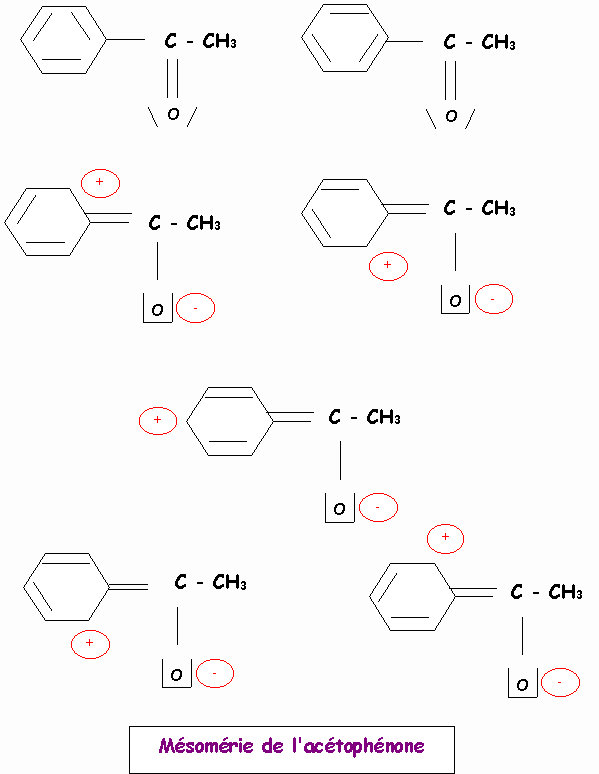
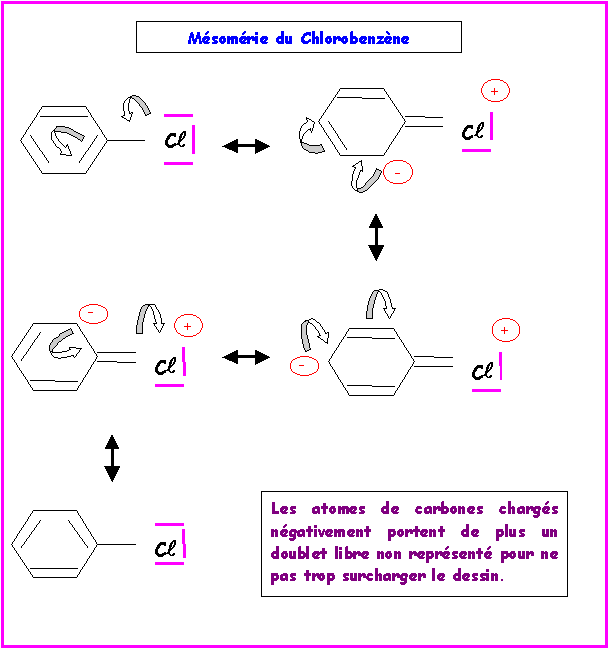
Donner les formes limites de résonance des espèces suivantes :
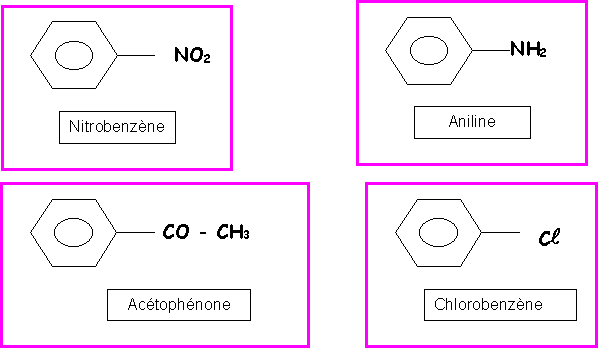
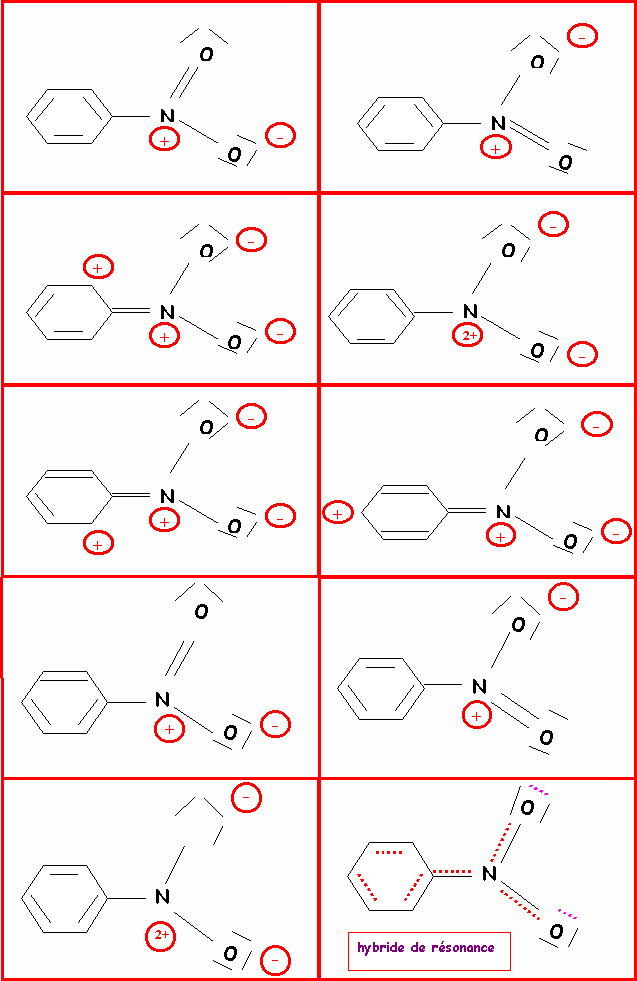
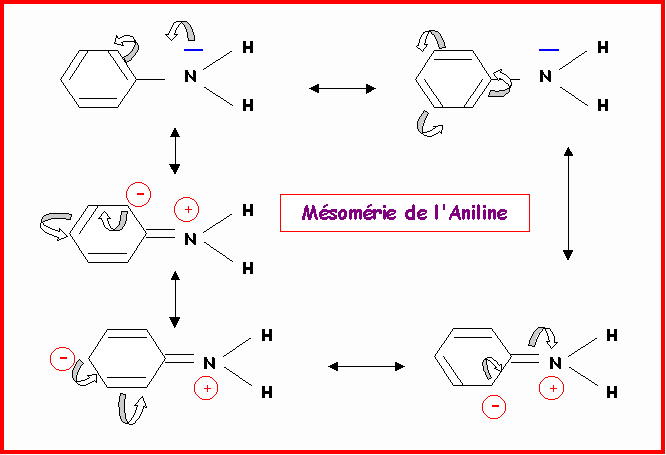
Remarque : Pour ne pas trop surcharger le dessin, les doublets libres portés par les carbones chargés négativement n'ont pas été représentés.