Exercice 2 : (Première partie)
Pour les molécules ou ions suivants :
a) Proposer une structure de Lewis.
b) Par application de la Méthode V.S.E.P.R déterminer la géométrie.
AlCl3 ; SO2 ; PO43- ; CO32-
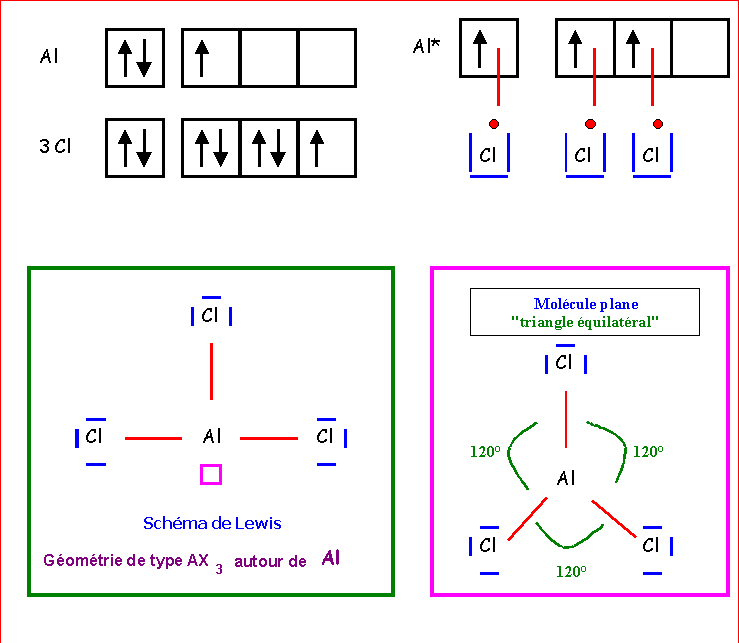
AlCl3

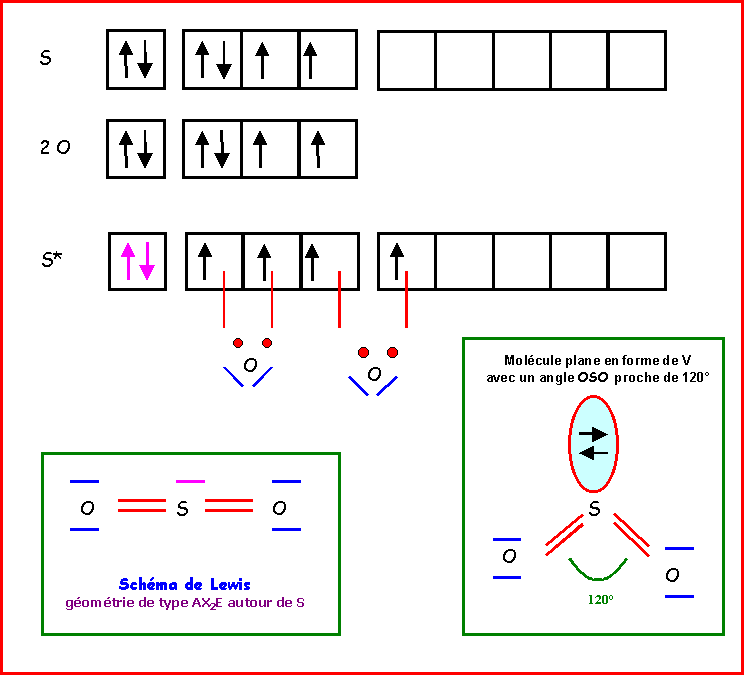
SO2

PO43-
Nous allons utiliser la "méthode rapide".
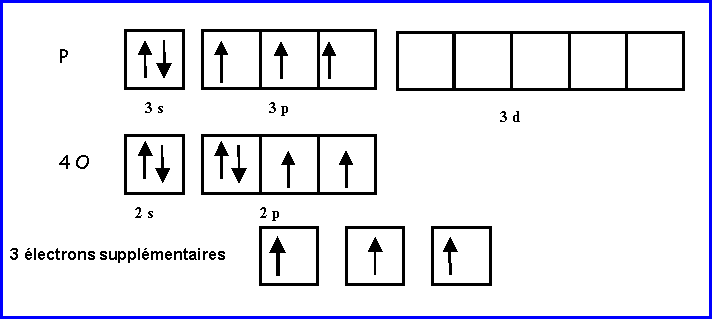
Les atomes latéraux O sont supposés faire des doubles liaisons puisqu'ils possèdent 2 électrons célibataires.
L'atome central P possède 5 électrons et on lui attribue de plus les 3 électrons supplémentaires soit 8 électrons au total.
Il utilise ses 8 électrons pour faire 4 doubles liaisons avec les 4 atomes d'oxygène et ne possédera donc pas de doublets libres.
Sur cette base on peut facilement déduire un schéma de Lewis provisoire.
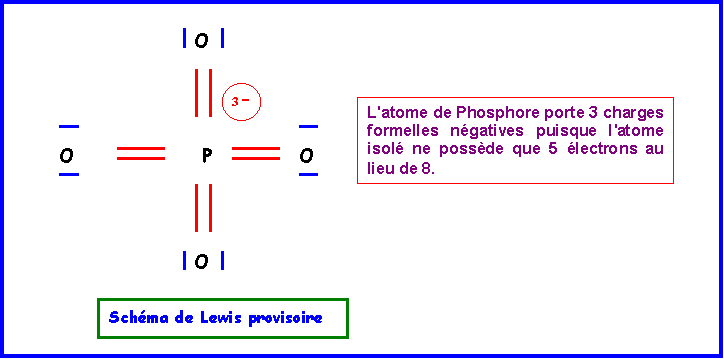
Cette première structure ne présenta pas d'impossibilités puisque qu'avec ses 9 cases quantiques ( 3s , 3p, 3d ) il peut théoriquement former jusqu'à 9 liaisons. Néanmoins cette forme possède deux grands défauts qu'il convient de corriger :
- 3 charges sur un même atome
- électronégativité non respectée puisque O est plus électronégatif que P.
Echelle de Pauling : XO = 3,44 - XP = 2,12
Le remède consiste à "rabattre" les doublets vers l'atome d'oxygène.
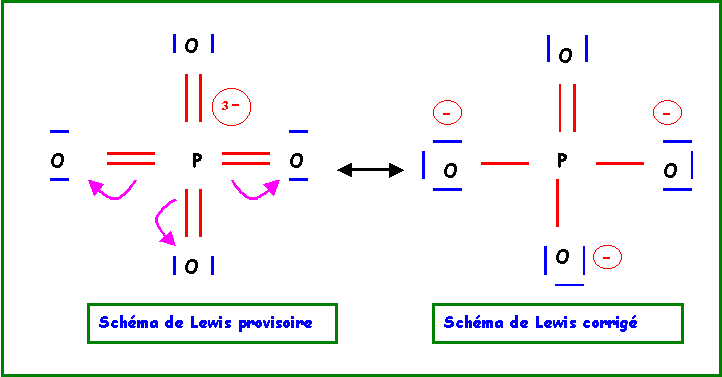
Cette forme mésomère de haut poids statistique existe en fait sous 4 formes totalement équivalentes en permutant les rôles des quatre atomes d'Oxygène. La molécule réelle sera un hybride de résonance entre ses 4 formes.
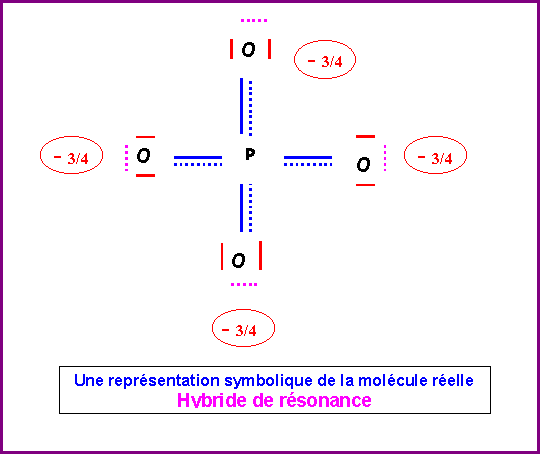
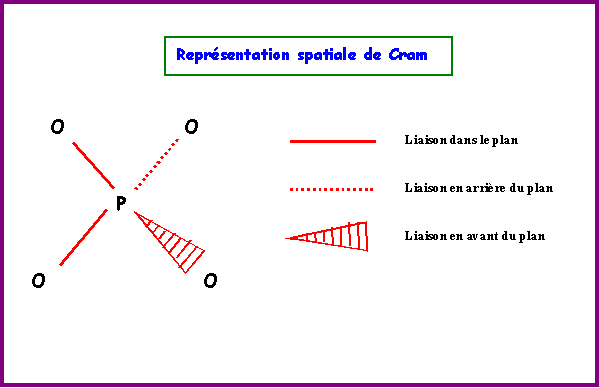
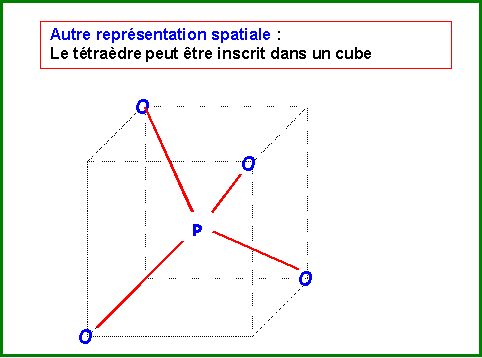
La molécules réelle est parfaitement symétrique avec une géométrie de type AX4 autour de l'atome de Phosphore central.
La molécule est donc de forme tétraédrique avec des angles OPO de 109,5°.
CO32-
Méthode rapide :
C central : 4 électrons + 2 électrons de charge = 6 électrons
3 O latéraux * 2 électrons célibataires => 3 doubles liaisons => 6 liaisons pour C
6 électrons et 6 liaisons => C ne possède pas de doublets libres.
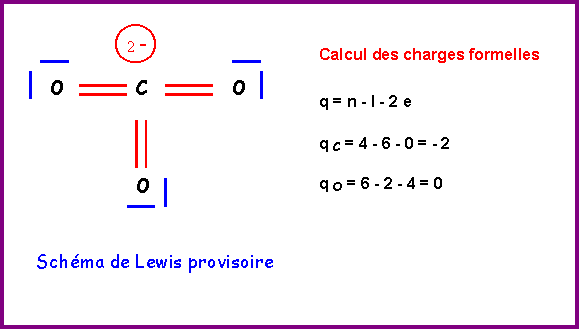
Ce schéma provisoire présente plusieurs gros défauts :
- C élément de la deuxième période présente 6 liaisons ce qui est impossible
- 2 charges sont présentes sur un même atome.
- L'électronégativité n'est pas respectée (XO > XC)
Pour le corriger, il suffira de "rabattre" les doublets vers les atomes d'Oxygène.
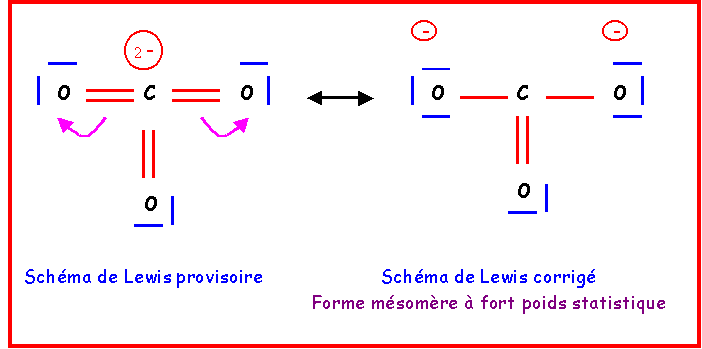
Cette forme existe en réalité sous trois formes mésomères totalement équivalentes en échangeant simplement le rôle des oxygènes.
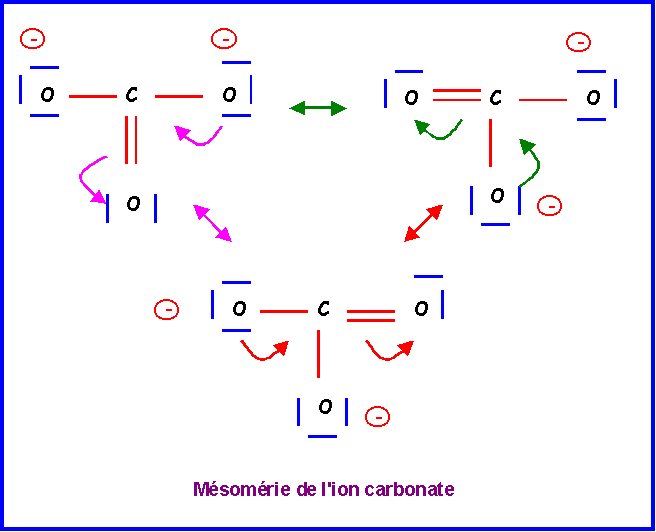
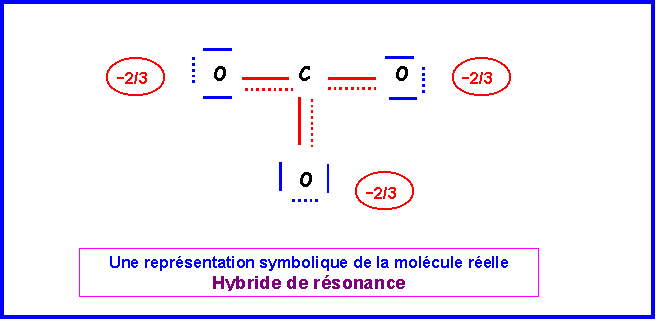
La molécules est du type AX3 avec une symétrie parfaite. Triangle équilatéral plan avec des angles de 120 ° exactement. Les trois liaisons sont identiques et intermédiaires entre la simple et la double liaison.