Exercice 5 :
Déterminer la géométrie de : ClF3 ; I3- ; ICl2- ; PCl4F ; PF4Cl ; PCl4I
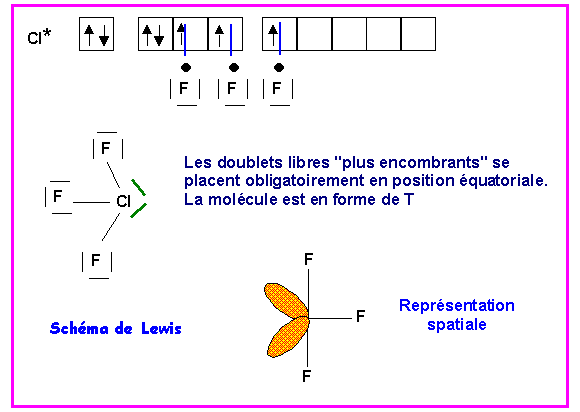
ClF3

I3-
Méthode rapide :
I central : 7 e-
Charge négative : 1 e-
Soit 8 e- au total pour le I central
I latéral : 1 e- célibataire soit une simple liaison
L'atome central fait donc deux liaisons, il lui reste 8 - 2 = 6 e-, soit 3 doublets libres

ICl2-
ICl2- étant iso-électronique de I3- sa structure est semblable.
PCl4F
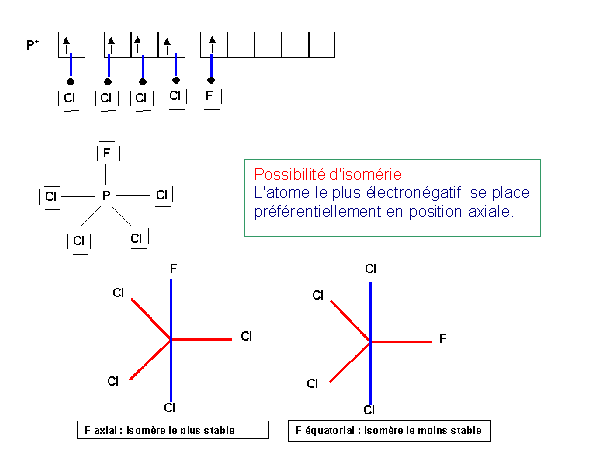
PF4Cl
PF4Cl est isoélectronique de PCl4F
Il existe ici aussi deux isomères : l'atome de Chlore se placera préférentiellement en position équatoriale.
PCl4I
PCl4I est isoélectronique de PCl4F et de PF4Cl
Il existe ici aussi deux isomères : l'atome d'Iode se placera préférentiellement en position équatoriale.